第一节 大鼠与小鼠骨髓细胞检查标准操作程序
一、大鼠骨髓细胞采集及应用细胞离心涂片机制备大鼠骨髓细胞涂片
(一)目的
规范应用细胞离心涂片机制备大鼠骨髓细胞涂片的程序。
(二)材料
1.器械:剪刀、骨剪、尖头镊子、10~15ml玻璃试管、尖头玻璃滴管、橡胶头、干净载玻片(将载玻片放入95%乙醇溶液中,浸泡2小时以上,用纱布拭干乙醇,再用绸布擦亮备用)。
2.血清:胎牛血清或应用同种动物的血清。
3.仪器准备:将标有动物编号的载玻片、双孔滤纸固定于固定夹及漏斗之间,放入细胞离心机备用。
(三)程序
1.完整摘取大鼠股骨,用骨剪从膝关节向髋关节处纵剖,使骨髓暴露。
2.用尖头镊子,将骨髓内容物混合均匀,用镊子取出少量骨髓,大约0.5mm3,放入事先装有1.5~2ml血清的试管中。
3.再用尖头玻璃滴管反复吹打30次左右,抽吸混有骨髓的血清,使骨髓细胞均匀分散其中。注意,尽量不要将血清吹打出气泡。
4.用微量加样器取骨髓细胞液30~50μl(视所取骨髓量而定),加入细胞离心涂片机的小漏斗中,以600~800转、离心10分钟,取出载玻片,涂片标本制作完成。
注意事项:①在处死动物后,在尽可能短的时间内摘取动物股骨并采集骨髓细胞,关键是完整取出股骨,剔除附着的肌肉;②摘除股骨后,尽快采集骨髓细胞,不要让骨髓接触空气过久;③骨髓细胞涂片标本制作完成后,需干燥20分钟以上,再进行染色。
二、旋转器制备大鼠骨髓细胞涂片
(一)目的
规范旋转器制备大鼠骨髓细胞涂片的程序。
(二)材料
1.器械:剪刀、骨剪、镊子、2ml注射器、18号长7厘米的针头、10~15ml玻璃试管、尖头玻璃滴管、橡胶头、干净载玻片(将载玻片放入95%乙醇溶液中,浸泡2小时以上,用纱布拭干乙醇,再用绸布擦亮备用)。
2.血清:胎牛血清或同种动物血清。
(三)程序
1.完整摘取大鼠股骨,在股骨两端齐关节处,用骨剪沿横切面剪开,暴露骨髓腔。
2.用2ml带18号针头的注射器,自一端刺入骨髓腔,用血清将骨髓冲洗至玻璃试管中,再从另一端冲洗骨髓腔,确保大鼠整根股骨腔中骨髓细胞完全被冲洗出来。
3.用尖头玻璃滴管抽吸混有大鼠骨髓细胞的血清,反复吹打30次左右,使骨髓细胞均匀分散其中。注意,尽量不要将血清吹打出气泡。
4.以600转/分、离心5分钟,弃上清液后,用玻璃滴管将沉淀的骨髓细胞轻轻吹散;将制备好的骨髓细胞悬液滴在载玻片上,应用Spinner旋转涂片机,在1.0秒钟内进行涂片,制作骨髓细胞标本。
注意事项:①在处死动物后,在尽可能短的时间内摘取动物股骨并采集骨髓细胞,关键是完整取出股骨,剔除附着的肌肉;②摘除股骨后,应尽快采集骨髓细胞,不要让骨髓接触空气过久;③骨髓涂片标本制作完成后,需干燥20分钟以上,再进行染色。
三、大鼠骨髓细胞涂片的Wright-Giemsa 染色程序
(一)目的
规范大鼠骨髓细胞涂片的Wright-Giemsa 染色程序。
(二)程序
1.5% Giemsa染液配制:用M/150磷酸缓冲液(pH 6.8)与Giemsa原液按95∶5比例稀释而成。
2.将骨髓细胞涂片标本浸泡于Wright染液的染缸中,静置2分钟。
3.将骨髓细胞涂片标本移至5% Giemsa染液中,上下轻振数次,静置20分。
4.水洗骨髓细胞涂片3~4次,干燥。
四、大鼠骨髓细胞涂片的May-Giemsa染色程序
(一)目的
规范大鼠骨髓细胞涂片的May-Giemsa染色程序。
(二)程序
1.5% Giemsa染液配制(同上)。
2.50% May-Grunwald染液配制:May-Grunwald原液与蒸馏水按1∶1比例稀释而成。
3.将骨髓细胞涂片标本浸泡于May-Grunwald原液中,静置3分钟。
4.将骨髓细胞涂片标本移至50% May-Grunwald染液中,静置1分钟。
5.将骨髓细胞涂片标本移至5% Giemsa染液中,上下轻振数次,静置20分。
6.水洗骨髓细胞涂片3~4次,干燥。
五、猴骨髓吸出和活检标准操作规程
(一)概述
骨髓吸出和活检技术是将一个硬的、带孔的针头插入长骨或扁平骨的骨髓腔中,吸出骨髓。在较大的非人灵长类动物中,已经报道有大量骨髓细胞采集部位可以应用,包括髂骨顶部的前面、股骨的坐骨结节和转子窝。通常,在非人灵长类动物的骨髓细胞采集部位,骨髓采集使用的方法类似于对犬的描述。
对于进行骨髓细胞采集的动物,应该适当进行麻醉,骨髓细胞采集或活检要求应用无菌技术,包括剔除采集部位的毛发,用聚乙烯吡啶酮-碘擦拭骨髓细胞采集部位并覆盖采集部位。
对于骨髓采集,要求用一个带中心探针的特殊针头。现在,可以从市场上获得几种不同类型的骨髓细胞采集针头,这些针头在长度、号码、斜面和处理类型方面不同,对于较小的NewWorld种属,应用20号、3.8厘米长的脊髓针头采集骨髓;应用Jamshidi针头、最小14号针头采集骨中的活检样品。
当进行骨髓采集时,应该注意以下几点:①注射器和针头在应用前,应该用肝素冲洗;②对重复采集骨髓样品的动物,轮换采集部位;③在骨髓采集后,应该进行镇痛处理。
(二)猴骨髓采集程序
1.将动物适当麻醉,腹侧位躺着。
2.剔除髂骨顶部的毛发(骨盆根部),应用聚乙烯吡啶酮-碘消毒局部皮肤并覆盖局部皮肤。
3.触摸髂骨顶部,应用外科手术刀片,在髂骨顶部的前面皮肤切一个切口。
4.通过切口插入骨髓穿刺针头,直到髂骨顶部脊的前面。
5.然后沿腹侧继续进针到髂骨顶部,通过恒定的压力,向前向后旋转针头。当进针时,该针头应该保持平行于髂骨的矢状面。
6.当针头进入骨皮质时,会感到阻力减小,然后固定(如果前面摆动,针头将不摆动)。
7.从针头中移出探针,连接20ml注射器,通过拉出注射器栓产生负压,吸出骨髓进入注射器内。
8.如果没有吸出骨髓,旋转针头90°~180°,重新吸取骨髓细胞。如果仍不能吸出骨髓,稍微进针或撤针,重新吸取骨髓细胞。
9.骨髓细胞标样是暗红色的,比血液更黏稠,并含有灰白色骨针状物。
10.对于诊断用标样,要求少于1ml,如果需要较大体积,应该从多部位采集。
11.对于骨髓标样采集,移出针头后,小切口用外科组织胶黏合或缝合切口。
(三)从坐骨结节采集骨髓细胞标本(https://www.xing528.com)
可以从恒河猴的坐骨结节采集少量骨髓标本,这个技术与从髂骨顶部采集的方法一样。对于这个技术,动物可以采用侧位或腹侧位躺着、后腿弯曲、紧贴该动物的身体,在动物坐骨硬结处(垫)触摸坐骨结节,并从该处插入骨髓针头,向动物头部方向并进入坐骨结节。样本采集同(二)的程序。
(四)从股骨转子窝采集骨髓细胞标本
对于较小动物(小于5kg)股骨转子窝是一个有用的采集部位,这个技术本质上与髂骨顶部采集的方法一样。对于这个技术,动物采用侧躺位,采集人用手紧握住动物股骨的大腿近端,转子窝位于中央,针头直接插入转子窝向股骨移动,进入髓腔,采集样本同(二)的程序。
(五)近端肱骨处采集骨髓细胞标本
从近端肱骨处采集骨髓细胞标本,对于小动物也是一个有用的部位。这个技术在本质上与股骨转子窝采集的方法一样,仅部位不同。对于这个技术,动物采用侧位躺着,采集人握住近端上肢,拇指放在肱骨的侧面。
(六)中心骨活检
从同样部位吸出骨髓获得的标本,骨活检和骨髓吸出的主要差异在固定包埋穿刺针头入骨内之后,应用针头吸出骨髓,在吸骨髓的情况下移出探针,连接注射器,应用负压抽出骨髓。在中心骨活检的情况下,移出探针,并进一步进针,进入骨内(1~2cm),通过轻柔旋转和稳定施压,然后,通过旋转和向前向后摇摆针头使针头转动,接着部分撤出针头,并再次插入骨内,重新定位针头,确保获得较大体积的标本。为了移出活检样品,应旋转针头并前后移动针头,然后平衡拉撤出。
六、骨髓涂片的评价程序
(一)目的
规范骨髓涂片的评价程序。
(二)程序
1.在显微镜下进行观察时,应该预先确定观察部位不要偏离。必须按从小到大的顺序逐渐放大倍数,以便观察整体状况。随后,在100倍油镜下,分类计数骨髓细胞。每张涂片至少应该计数500个细胞的各类细胞的百分比值。
2.骨髓细胞形态学分类
(1)骨髓细胞形态学分类方法有两种:一种方法是粗略分类即红细胞系(Erythrocytes series)、粒细胞系(Myeloid series)、淋巴细胞(Lymphocytes Series)等。即使是粗略分类,也能显示出各个细胞系的增减,所以,有助于与外周贫血相应的结果评价。另一种方法是以细胞直径为标准进行分类。除了分类外,还可以观察混杂的成熟红细胞数量的增减、具有小核的红细胞的出现、形态的异常(过分节、多倍体、分裂异常、胞质异常等)。混杂的成熟红细胞数量增加与减少,表示骨髓细胞的增生与减少。分类计数的骨髓细胞及英文缩写如表2-1所示。
表2-1
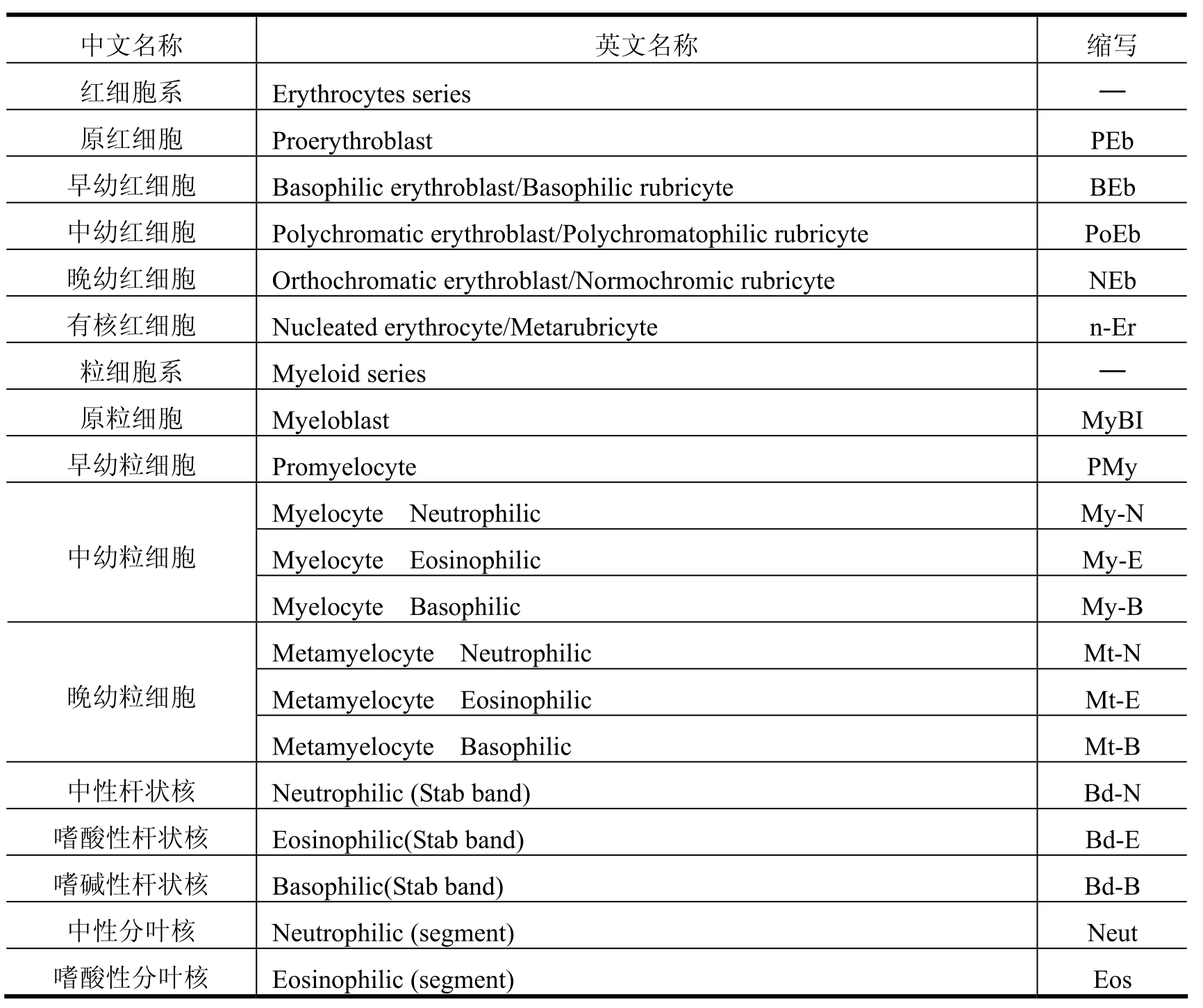
(续表)
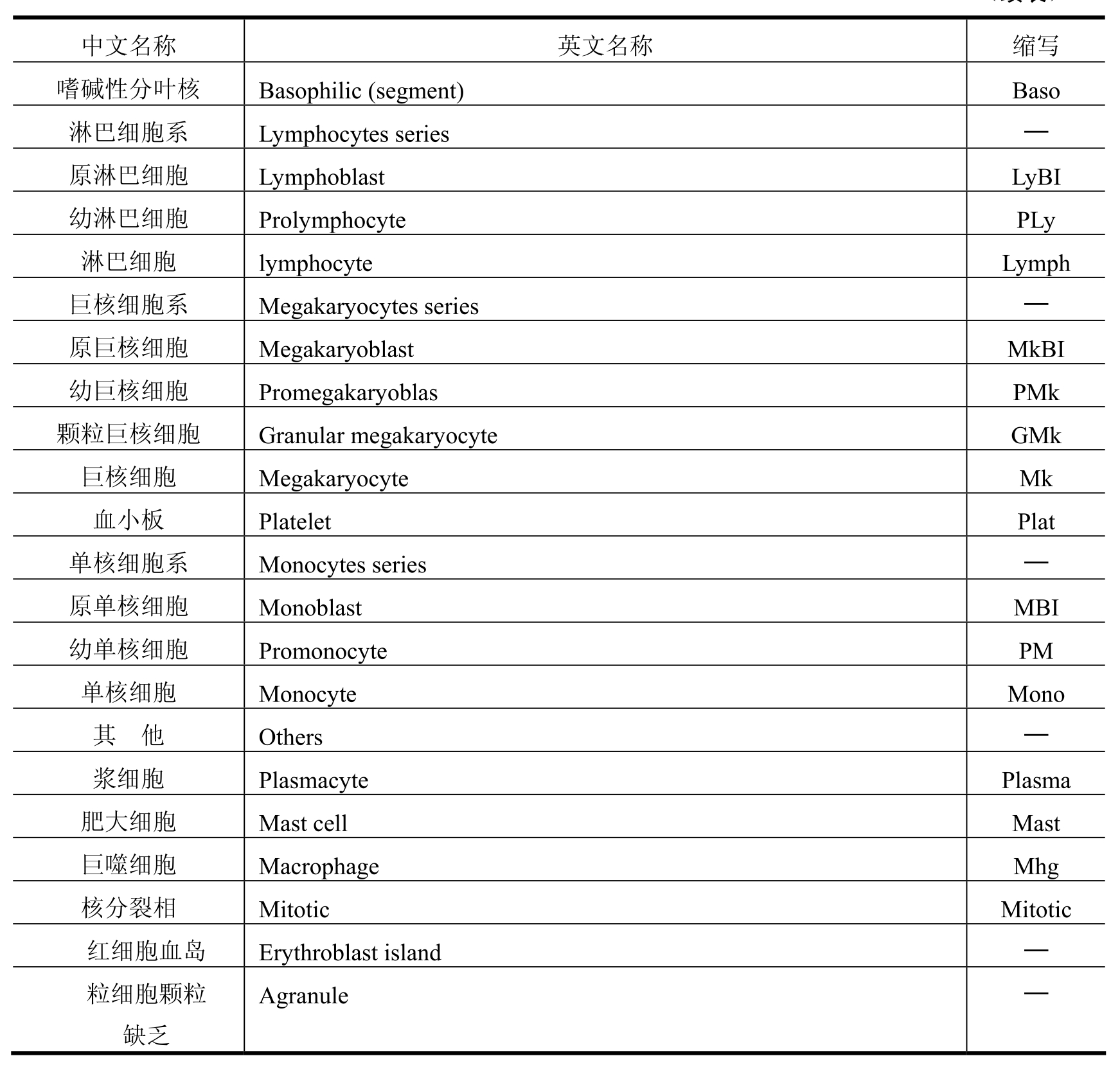
(2)骨髓细胞增生标准
骨髓细胞增生以有核细胞占全部骨髓细胞的百分比表示。①极度增生,有核细胞占全部骨髓细胞的百分比在50%以上;②增生,有核细胞占全部骨髓细胞的百分比在10%以上;③正常,有核细胞占全部骨髓细胞的百分比为1%~10%;④减少,有核细胞占全部骨髓细胞的百分比在1%以下;⑤极度减少,有核细胞占全部骨髓细胞的百分比在0.5%以下。
正常情况下,在造血干细胞分化、发育到成熟的整个演变过程中,存在着一定的规律性。造血干细胞逐级分化形成各系列、各阶段的骨髓细胞,虽然造血干细胞在光学显微镜下无法鉴别,分化发育为各系列原始、幼稚细胞后,其形态学特征才较为明显,掌握这些规律对正确识别骨髓细胞的系列及其分化、成熟阶段是十分必要的。
(3)红系细胞形态学
红系细胞依分化顺序分为红系祖细胞、原红细胞、早幼红细胞、中幼红细胞、晚幼红细胞、网织红细胞和红细胞。红系祖细胞目前尚缺乏形态学了解。可以认识的红系各期形态概述如表2-2所示。红系细胞的基本特征为胞体胞核圆形、规则(形状基本一致);大小及胞浆着色变化显著。
表2-2 红系各期形态概述

(4)粒系细胞形态学
粒系细胞依分化顺序分为粒系祖细胞、原粒细胞、分叶核粒细胞,并从早幼粒细胞开始依颗粒特性分为中性、嗜酸和嗜碱三种。粒系分化中最显著的特点是胞核的变化,从最早阶段的圆形到成熟阶段的杆状分叶,划分细胞阶段的主要依据便是其胞核发育中的变化,而胞质颗粒属性对判定是否对其他系细胞有意义。各期形态概述如表2-3所示。
嗜酸和嗜碱性细胞的胞核形态与中性粒细胞大致相似。一般在早、中幼粒细胞阶段起即可明显区别特殊颗粒。通常成熟嗜酸分叶核呈哑铃状,颗粒多而粗大,有中空感,呈暗红色至红棕色。嗜碱粒细胞胞核的结构常模糊,颗粒粗大常散在于胞核上,呈蓝紫色。
表2-3 粒系细胞各期形态

(5)单核、巨噬细胞形态学
依分化顺序可分为单核祖细胞、原单核细胞、幼单核细胞和单核细胞。单核细胞进入组织后或在骨髓中转化为巨噬细胞,其胞体胞核增大、胞质丰富、吞噬功能显著增强。
①原单核细胞——有两种形态:一为胞体大(直径12~22µm)而不规则(胞体胞核不规则),胞质丰富(胞核/胞质比例低),蓝紫色无颗粒;另一为胞体小(直径10~15µm)且较规则,核染色质纤细,胞核/胞质比例高,无颗粒。后一种原单核细胞仅凭形态学常常不易与原粒细胞区分,必要时可用CD系统检测以区别之。
②幼单核细胞——胞体直径为15~25µm,胞体胞核大多不规则,核染色质浓密,核仁隐约或无核仁,胞核常位于细胞中或偏向一侧。
③单核细胞——胞体直径为12~20µm,胞体圆形或不规则;胞核呈扭、曲、折,核膜粗糙,核染色质明显浓集;胞质丰富浅灰蓝色,也可呈浅红色,可含有细尘样颗粒,部分胞质少,类似T淋巴细胞。
④巨噬细胞——胞体大或巨大,直径为15~40µm;胞核呈不规则状,明显偏位;胞质十分丰富,为浅灰蓝色或浅红色,常含有空泡或吞噬少量细胞碎屑或成熟衰老的红细胞。
⑤组织细胞——一般认为组织细胞与巨噬细胞同义,组织细胞是单核细胞转化后的幼稚阶段,而巨噬细胞则为单核细胞转变后的成熟细胞。形态学上可见单核细胞向两者转化,但常将胞体大、不规则状、胞核大、核染色质疏松、可有核仁、胞质呈明显嗜碱性的(尤其在胞体周边)及几乎不见吞噬现象者称为组织细胞。
(6)淋巴及浆细胞形态学
淋巴及浆细胞系包括淋巴干细胞、淋巴祖细胞、原淋巴细胞、幼淋巴细胞和淋巴细胞,并分T和B两个系统。在抗原刺激下B淋巴细胞最后转化为浆细胞,可分为原浆细胞和幼浆细胞及成熟浆细胞。
①原淋巴细胞——胞体较小(直径为12~20µm)而规则;胞膜核膜厚而清晰;核仁0~3个,染色质呈粗粒状紫红色,胞核/胞质比例高;胞质较少,淡蓝色,无颗粒。
②幼淋巴细胞——胞体直径为10~18µm;核仁消失或模糊,核染色质有浓集倾向。
③淋巴细胞——分大小两种。大淋巴细胞胞体直径为10~15µm;胞核圆形或肾形常偏位,核染色质明显浓集,可见核仁痕迹;胞质丰富、淡蓝色或灰蓝色,可见少许紫红色嗜天青颗粒。这种含颗粒的淋巴细胞常与免疫分型上的自然杀伤细胞相似。小淋巴细胞胞体直径为6~10µm;胞核圆但有轻度不规则(如有小切迹),核染色质呈紧密块状、深紫红色;胞质少,一般无颗粒。淋巴细胞胞核不规则的多属T细胞。
④原浆细胞——胞体直径为14~20µm;胞核圆形或椭圆形,偏位或轻度偏位,约占细胞的2/3,核染色质细致均匀,核仁1~4个;胞质丰富,深蓝色。
⑤幼浆细胞——胞体直径为12~20µm;外形呈不规则状;胞核圆形或椭圆形,约占细胞的1/2,明显偏位,核染色质有浓集现象,核仁隐约或不见;胞质丰富、嗜碱性强或呈多染色性。
⑥浆细胞——胞体直径为8~15µm;胞核小,约占细胞的1/2,圆形或椭圆形,明显偏位,核染色质粗而浓集,间有空隙,一部分似车轮状;胞质丰富,深蓝色、灰蓝色或多色性。
(7)巨核细胞形态学
①原巨核细胞——原巨核细胞由巨核祖细胞分化而来,正常骨髓中不见或少见。胞体直径为10~30µm,外形不规则,可呈毛刺状突起;胞核大、类圆形,双核多见,核染色质呈疏松网状结构,核仁2~4个,淡蓝色;胞质较少,深蓝色,染色常不均匀呈层状或云雾状。
②幼巨核细胞——胞体直径为25~50µm,外形不规则;胞核巨大,为多个胞核紧缩或重叠在一起,核染色质明显聚集,核仁不定;胞质较丰富,呈蓝色,可在胞核处出现区域性颗粒,也可见少量血小板形成。
③颗粒型巨核细胞——胞体直径为40~70µm;胞核巨大,常重叠在一起呈不规则状或互相聚集成环状,核染色质粗密;胞质十分丰富,含细小紫红色颗粒。
④裸核型巨核细胞为巨核细胞仅见胞核者。
⑤血小板——直径为2~4µm,呈圆形或椭圆形的双凹盘状,往往成群出现;胞质周围染成淡蓝色,称为透明区,中央部分含有细小紫红颗粒,为颗粒区。
(8)其他细胞形态学
①网状细胞——为造血的支架细胞之一。胞体大小不一,呈星状或多突状,直径为10~40µm;胞核圆形无皱褶,染色质细致疏松呈网状;胞质丰富,浅灰蓝色或淡蓝色,近核处常较深,而细胞周边淡染,甚至难以看清其边界。
②肥大细胞——又称组织嗜碱细胞,胞体直径为8~25µm,外形变异大;胞核圆形,居中或偏位,染色质常被颗粒覆盖而结构不清;胞质丰富,常充满大小不一的深蓝、紫黑或暗紫红色的嗜碱颗粒,排列紧密。
③脂肪细胞——胞体直径为30~50µm,胞膜易破裂;胞核较小不规则,常被挤在一边,核染色致密,无核仁;胞质充满多量脂肪小球,有时呈大脂肪空泡。
④成骨细胞——胞体直径为20~40µm,长椭圆形或不规则形,单个或多个成簇分布;胞核圆形,常偏于一端,可见1~3个深蓝色核仁;胞质丰富,暗蓝色或蓝色,不均匀,离核较远处常有一淡染区,酷似鱼肚白。由于胞质偏于一侧呈裙边状,似飘扬的旗帜。
⑤破骨细胞——破骨细胞与成骨细胞是一对作用相反的参与骨代谢的细胞。破骨细胞起溶骨作用,胞体大,直径为20~100µm;胞核从数个至数十个不等,核仁明显;胞质丰富,含有粗大的暗红色或紫红色溶酶体颗粒。
3.临床前安全评价试验中的骨髓检查
(1)骨髓细胞计数结果
实验动物的股骨骨髓细胞数量差别很大。动物越小骨髓细胞数量越高。这种关系与血细胞的寿命和骨髓腔容积差有关。骨髓细胞的粒细胞系/红细胞系(M/E)为0.8~2.0,淋巴细胞数为10%~30%;小鼠为2.67±0.22、大鼠为2.12±0.19、非洲小型长尾猴为1.28±0.20、食蟹猴为0.64±0.17、犬为0.35±0.15。
(2)骨髓细胞分类计数正常值范围(见附录)。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




