第二十五章 肿瘤患者的营养支持
恶性肿瘤发病率有不断增加的趋势,目前已成为人类死亡的第二大原因。虽然手术、化疗、放疗及生物治疗已取得了很大进步,但肿瘤治疗的效果仍未能达到令人满意的程度。临床上,肿瘤患者中营养不良的发生率相当高,部分患者常有恶病质征象,表现为厌食、进行性体重下降、贫血、低蛋白血症等,这种状态将直接影响整个治疗过程,不利于原发病的治疗,降低了患者的生活质量,甚至影响预后。因此,合理、有效地提供营养支持,对大部分营养不良肿瘤患者是有积极意义的,这已成为人们的共识。近年来,人们发现营养与肿瘤的发病、预防及治疗有关,营养对改善肿瘤患者的预后及生活质量方面均具有积极作用。
一、营养不良的原因
肿瘤患者中营养不良的发生率相当高,在各类肿瘤患者中,有1/3~2/3可发生恶病质。肿瘤患者出现营养不良与恶病质的原因和机制颇为复杂,有肿瘤本身的原因和肿瘤治疗的影响。恶病质常见于各种恶性肿瘤患者,在某些肿瘤患者中的发生率较高,且较严重。在诸多种类的肿瘤中,最易发生恶病质的是胃癌和胰腺癌患者。恶病质大多发生在肿瘤进展期,但也可见于肿瘤早期。许多研究发现,恶病质与肿瘤负荷、疾病进程、细胞类型之间无恒定关系。事实上,恶病质发生机制很复杂,没有一个单一理论可以满意地解释恶病质状态,有许多因素可能同时或相继作用从而产生恶病质。目前认为,肿瘤恶病质主要与患者厌食、营养物质代谢异常、细胞因子的作用、肿瘤治疗影响等有关。
(一)厌食
厌食是一种复杂的进食障碍,是引起肿瘤患者营养不良的主要因素之一。食欲丧失是恶性肿瘤患者常见症状,同时还常伴有饱感、味觉改变、恶心、呕吐等症。厌食的原因很多,主要是大脑进食调节中枢功能障碍所致。正常情况下,进食取决于下丘脑进食中枢与饱食中枢之间的平衡。动物实验发现,在肿瘤生长过程中,中枢和外周因素参与厌食的发生。血糖、脂肪酸、体内乳酸水平升高,外界温度、渗透压、血浆氨基酸浓度等变化均被认为是影响进食行为的外界因素,其中血浆氨基酸浓度变化对饮食的影响尤其引起人们的注意。目前认为,有两大类神经介质系统,即儿茶酚胺和色氨酸系统在进食行为中起重要作用,尤其是后者。动物实验表明,大脑5-羟色胺浓度与厌食有关。肿瘤生长增加了血浆色氨酸浓度,大脑中色氨酸浓度增加可导致下丘脑5-羟色胺合成增加,而大脑中5-羟色胺浓度增加与厌食明显相关。
此外,引起厌食的因素还有:①肿瘤本身局部作用是导致进食减少的另一因素,尤其是消化道肿瘤,如口腔、咽、食管肿瘤的患者由于吞咽困难、进食障碍使得摄入减少。胃肿瘤造成梗阻,出现腹胀、恶心、呕吐等症,导致进食减少、厌食。②由于对甜、酸、咸味的阈值下降,以及某些微量元素(如锌)的缺乏,肿瘤患者往往有味觉异常。③对乳酸的清除率下降,特别是肝功能障碍的患者,由于不能清除无氧糖酵解葡萄糖而产生的乳酸,更易产生厌食和恶心。④肿瘤细胞释放的恶病质素可作用于下丘脑的喂养中枢而导致厌食。⑤化疗药物既可作用于中枢的化学受体激发区,又可局部作用于胃肠道,从而导致恶心、呕吐和厌食。⑥心理因素、压抑、焦虑等也可影响食欲及进食习惯。
食欲缺乏或食欲低下是肿瘤的早期症状,也可在肿瘤生长或扩散时出现。肿瘤生长影响患者的营养状况,因为吸收降低,使患者低血糖、氨基酸不平衡和丘脑下部(调节食欲及饱足感)生理功能受干扰。丘脑下部的低分子肽也影响脑功能,所以肽、核苷酸以及其他低分子量代谢物可能对肿瘤患者的食欲缺乏起作用。这些物质也可作用于中枢神经系统的感觉及反应细胞而发生无食欲现象。
(二)营养物质代谢改变
肿瘤患者营养不良的另一重要原因是由于营养物质代谢异常所致。机体能量消耗改变、糖类(碳水化合物)代谢异常、蛋白质转变率增加、骨骼肌及内脏蛋白消耗、血浆氨基酸谱异常,以及脂肪动员增加、机体体脂储存下降和水、电解质失衡等,均是恶性肿瘤患者营养物质代谢的特征,也是导致营养不良和恶病质的主要原因。
1.机体能量消耗改变 导致肿瘤患者恶病质的一个常见原因是机体代谢率改变。早期的一些研究发现,恶性肿瘤患者机体的静息能量消耗明显高于正常人群,因此认为是由于能量消耗的增加,导致患者进行性热量缺乏,从而引起机体各组织群不断消耗,产生恶病质。有研究发现,急性白血病患者的基础能量消耗呈不同程度增高趋势,其增高程度与白细胞数和疾病严重程度相一致,当治疗有效时,机体代谢率降至正常。Streck和Mulholland报道52例多源性肿瘤患者中,80%患者的能量消耗高于正常值的110%。Warnold认为肿瘤患者能量消耗增高是导致恶病质的重要原因之一。肿瘤患者机体Cori循环增加,葡萄糖转化为脂肪的增加,蛋白质转化增加,糖原合成增加等均是机体能量消耗增高的原因。事实上,肿瘤患者能量消耗增加和能量利用无效是营养不良发生的重要原因之一。肿瘤患者能量消耗增加有两个原因:一是肿瘤本身在细胞迅速分裂、肿瘤生长的过程中需要大量的能量;二是癌瘤在生长过程中产生一些物质影响宿主的代谢,使能量消耗增加。
近年来,随着能量消耗测定技术的进步,一些多中心、大样本的临床研究发现,恶性肿瘤患者并非均处于高代谢状态,即使是进展期广泛转移的患者,其能量消耗也可处于正常范围。我们的研究也发现,肿瘤患者处于不同的代谢水平,并非所有的肿瘤患者都处于高代谢状态。影响肿瘤患者能量消耗的主要因素是负荷肿瘤的时间、疾病的早晚,而与肿瘤的类型和部位无明显相关。一般说来,荷瘤时间长,则晚期恶性肿瘤患者往往处于高代谢状况,其营养不良的发生率也较高。
2.碳水化合物代谢变化 肿瘤患者碳水化合物代谢障碍主要表现在葡萄糖转化增加和外周组织利用葡萄糖障碍。从乳酸和成糖氨基酸的糖异生作用增加是肿瘤患者葡萄糖转化增加的最主要特征。此过程需消耗大量能量,从而增加患者的基础能量消耗,导致恶病质产生。与宿主细胞不同,肿瘤组织的葡萄糖利用率增高。事实上,葡萄糖是合适的能源物质,肿瘤组织主要是通过糖酵解通路,从而产生大量乳酸到肝脏再转化为葡萄糖,这样进一步增加了宿主的能量消耗。有研究发现,Cori循环增加与机体体重丧失之间存在明显关系。此外,恶病质患者中丙氨酸、甘油转化成葡萄糖增加,恶病质患者其肝脏葡萄糖产生较对照组增加40%,而饥饿时肝脏葡萄糖产生减少。正常情况下,Cori循环占20%葡萄糖转化,而在恶病质的肿瘤患者中则增至50%,可处理60%产生的乳酸。
稳定性同位素标记示踪测定结果表明:早期或无体重下降的肿瘤患者的葡萄糖更新率近似正常,或是葡萄糖耐量降低。而晚期癌症患者,尤其伴体重下降者,葡萄糖生成明显增加,其更新率的增加相当于每天葡萄糖摄入量的42%。原因之一是乳酸-葡萄糖再循环增加;原因之二是肿瘤组织的葡萄糖生成亦增加。进一步的研究还发现,不同类型的肿瘤在这方面的代谢改变不尽相同。肉瘤、白血病患者的葡萄糖更新率是正常者的2~3倍,胃肠道肿瘤患者葡萄糖生成率的增加与肿瘤负荷程度相关,而淋巴瘤患者的变化则与常人相差无几。
尽管肿瘤患者葡萄糖更新加速,但机体对葡萄糖的耐受力却较差,这可能是周围组织对胰岛素的阻抗所致。由于部分肿瘤患者表现为血浆胰岛素水平低下,故又推测是周围组织敏感性和胰岛素释放量双重下降的结果。但若周围组织对葡萄糖利用障碍,这些大量生成的葡萄糖就有可能被肿瘤摄取,经无氧酵解而被大量消耗,随之释放的大量乳酸成为葡萄糖再生成的前体之一。由于每摩尔葡萄糖酵解仅产生2摩尔ATP,而自乳酸再合成葡萄糖需耗费6摩尔ATP,这种周而复始、消耗ATP的恶性循环成为荷瘤状态下的葡萄糖代谢特点。即Cori循环虽增强,却为无效代谢,成为引起癌性恶病质的原因之一。此外,对于肿瘤患者对葡萄糖耐量差和对胰岛素产生阻抗的另一解释是肿瘤患者存在高胰高糖素血症,而且即使输注葡萄糖也不能抑制胰高糖素的分泌。由于胰高糖素的作用,进展期肿瘤患者的葡萄糖更新率更趋加速。
3.蛋白质代谢变化 肿瘤患者蛋白质代谢异常,表现为蛋白质合成和分解增加,蛋白质转变率增加,血浆氨基酸谱异常,机体呈现负氮平衡。骨骼肌蛋白消耗增加是恶性肿瘤患者蛋白质代谢的特征之一,也是导致恶病质的主要原因之一。此外,肿瘤患者机体肌肉蛋白合成减少,肝脏结构蛋白合成正常,而分泌蛋白如急性相反应蛋白合成则增加,恶病质是机体总蛋白质转化率增加所致。
肿瘤患者内源性氮的丢失首先表现在骨骼肌部分,因为肌肉占总体氮的45%和总体钾的85%,有一定的“缓冲”能力。其后才是内脏蛋白,如循环蛋白质的耗竭。随着疾病的进展,总体蛋白质更新率增加,肌肉蛋白质合成和分解率亦增加,但以分解率的增加更为明显。不同类型肿瘤患者中,总体蛋白质更新率增加的幅度不一致,如肉瘤患者的蛋白质更新约增加50%以上,肺癌和结、直肠癌患者增加50%~70%,但也有些肿瘤患者的蛋白质更新率处于正常状态。有人比较了处于饥饿状态(10d)的营养不良的肿瘤患者与营养不良的良性疾病者和健康者的总体蛋白质更新率,发现肿瘤患者较之后两组分别高出32%和35%,提示肿瘤患者伴营养不良时总体蛋白质更新率增加。利用亮氨酸稳定同位素标记示踪测定方法,比较另一组维持正常体重的良性疾病者与无体重丢失的肿瘤患者的总体蛋白质合成、总体蛋白质分解和净蛋白质分解率,各组之间未见明显差异。但体重丢失≥15%的癌性恶病质患者的总体蛋白质分解率明显上升。净蛋白质分解率也上升;虽然总体蛋白质合成率同步上升,但幅度很小,仅骨骼肌内、肝内蛋白质和清蛋白的合成率相对高些。表明癌性恶病质患者的蛋白质大量丢失是总体蛋白质分解率增加的结果,而总体蛋白质合成率的小幅度增加根本不足以代偿该丢失速度。
近年来的动物实验和临床实践发现,肿瘤蛋白质代谢改变可导致血浆氨基酸谱变化,其中血浆色氨酸浓度增高在进行性营养物质消耗中起着关键性作用。色氨酸是大脑5-羟色胺前体物质,而5-羟色胺可刺激下丘脑饱食中枢,引起厌食。大脑中的游离色氨酸是由血浆中游离色氨酸水平及游离色氨酸与中性氨基酸比值来调节的,因为游离色氨酸和中性氨基酸在脑中通过共同的载体转运。所以,血浆游离色氨酸水平或游离色氨酸与中性氨基酸比值增高,使得大脑中游离色氨酸和5-羟色胺浓度增高,从而引起厌食和恶病质。因此,提高血浆中性氨基酸浓度,降低色氨酸浓度可改善肿瘤患者的饮食状况,改善恶病质状况。
4.脂肪代谢变化 脂肪消耗是恶病质的主要特征之一,并且可发生在肿瘤早期。肿瘤患者存在脂肪代谢障碍,表现为内源性脂肪水解增高,而外源性三酰甘油水解则低于正常,有恶病质的肿瘤患者其甘油和脂肪酸的转化率增加。有研究发现,恶性肿瘤患者血浆游离脂肪酸浓度增加,这与内源性脂肪水解增强、氧化率增加有关。由于脂肪是高热量价值物质,是宿主代谢过程中主要供能物质。此外,有些多不饱和脂肪酸如亚油酸和花生四烯酸是肿瘤生长所必需的,所以恶病质时脂类的利用对宿主和肿瘤均有益处。一些临床研究发现,肿瘤患者在体重丧失前就已经存在游离脂肪酸活动增加现象,这与某些细胞因子和肿瘤代谢因子的作用有关。
肿瘤患者存在脂肪代谢障碍的原因不甚明确,可能机制包括:①摄入减少和营养不良;②肾上腺髓质受刺激致血儿茶酚胺水平升高和胰岛素阻抗;③肿瘤本身或髓样组织产生并释放脂肪分解因子。
当脂肪分解和脂肪酸氧化率均增加时表现为体重丢失。仅有脂肪分解增加而无脂肪酸氧化率的同步增加时,由脂肪分解而来的脂肪酸再酯化为三酰甘油,表现为三酰甘油—脂肪酸循环增强,该循环过程需消耗能量。脂肪分解增加所致的高脂血症仅见于少数肿瘤患者,可能与肿瘤类型有关。促使血三酰甘油升高的原因之一可能是脂蛋白脂酶(LPL)活性下降,其下降程度与体重丢失程度相关。如肺癌患者体重丢失较明显,脂蛋白脂酶活性下降;而乳房癌体重丢失最不明显,其脂蛋白脂酶水平基本正常。若将有明显体重丢失的肿瘤(胃癌和结、直肠癌)患者与无体重丢失的肿瘤患者或良性疾病患者相比,前者的脂肪氧化率较高,而碳水化合物的氧化率较低。由于脂肪酸是荷瘤状态下宿主利用的主要能量物质,即使给予外源性葡萄糖,也不能抑制体内脂肪的持续分解和氧化。
从另一角度推测,宿主脂肪组织的动员可能成为肿瘤生长的重要因素。以往的研究曾证明卵巢癌或子宫内膜癌患者皮下脂肪组织中的亚油酸含量低于无癌个体,提示脂肪动员的过程可能作为向肿瘤提供脂类的一种方式。进一步支持该假设的是一些体外和体内研究,发现亚油酸可成为刺激肿瘤生长的因素,其作用可能通过脂肪氧化酶旁路产生的前列腺素所介导,脂肪氧化酶旁路可释放抗凋亡因子,从而促进肿瘤生长。肿瘤患者三大营养物质代谢异常见表25-1。
表25-1 肿瘤患者碳水化合物、脂肪和蛋白质代谢异常

5.水、电解质变化 浸润性肿瘤患者中常发生水和电解质代谢失衡,如低钠血症、低蛋白血症及高钙血症等。有严重水、电解质代谢紊乱的患者可出现恶心、呕吐、腹泻等不适,更加重紊乱的程度。高钙血症可能是肿瘤患者最常见的内分泌方面的并发症,过度骨吸收是高钙血症的重要原因,晚期肿瘤患者约10%可发生此并发症,另外,肺癌、乳腺癌、多发性骨髓瘤并发此症者多见。病情轻者症状不明显,仅在血液生化检查时发现,病情严重者可有厌食、恶心、呕吐、便秘、腹胀、口渴、多尿、心律失常甚至嗜睡、昏迷,也可有抑郁与其他精神症状。对本症患者如不采取有效药物治疗可导致患者死亡,需用降钙素皮下注射或肌内注射,肾上腺皮质激素与二膦酸盐亦有效。
(三)细胞因子作用
厌食、体重下降、组织消耗、体力状况下降,最终死亡,这是癌性恶病质的特点。癌性恶病质是一类严重的蛋白质-能量型营养不良,不仅导致明显消瘦,也导致内脏和躯体蛋白消耗,从而损害了机体组织结构和功能,损害了酶的生成及免疫功能,增加了宿主的易感性。晚期消化道肿瘤患者约有80%的恶病质,肺癌患者约有60%的发生率。恶病质在老年及儿童患者中更为常见,且随着病情的发展更为突出。近年来,许多研究提示内源性细胞因子在肿瘤厌食、恶病质中起着十分重要的作用。有资料证明,肿瘤坏死因子α(TNF-α),白细胞介素-1、6,(IL-1、IL-6),干扰素γ(IFN-γ)和白细胞抑制因子(LIF)在肿瘤恶病质中起重要作用。除上述细胞因子外,有些研究还发现肿瘤产生的某些代谢因子可直接作用于骨骼肌和脂肪组织等靶器官,导致机体代谢异常。
TNF-α首次是在锥虫感染的兔子身上发现,它是引起恶病质的介质。动物和人类研究显示,摄入TNF-α可引起体重下降,肿瘤患者快速摄入TNF-α所引起的表现与恶病质相似,甘油转化增加80%,脂肪酸转化增加60%,蛋白质转化率增加,机体氨基酸流量增加。动物摄入TNF-α可导致高三酰甘油血症,其原因被认为是抑制了脂蛋白酯酶活性以及肝脏极低密度脂蛋白合成分泌增加。在动物上转移人类TNF-α基因,可引起大鼠产生恶病质,进行性消瘦、厌食、过早死亡。骨骼肌消耗是由于TNF-α所致的氧化应激和一氧化氮(NO)合成,从而导致肌凝蛋白肌酸磷酸激酶活性下降。大鼠体重下降、肌肉消耗、细胞异常可通过给予抗氧化剂或NO抑制剂而得以预防,大鼠接种肿瘤后其TNF-α水平明显增高。但是,在实验的恶病质动物或临床患者中却很难测得TNF-α明显增高,应用TNF-α抗体不能阻止动物产生恶病质。在人类,TNF-α抗体可部分阻止体重下降,但不能使体重保持正常。这些现象均提示除TNF-α外,还有其他因素参与恶病质的形成。
IL-1是一种恶病质因子,直接作用于下丘脑饱食中枢和外周部位。下丘脑食物调节中枢有IL-1和TNF-α受体,IL-1和TNF-α可直接作用于下丘脑产生厌食。IL-1引起大鼠进食改变与肿瘤恶病质早期表现相似,开始是进食种类减少,然后是数量减少。实验还发现中枢神经系统内IL-1浓度与动物进食呈负相关,因此认为IL-1作用于下丘脑腹侧核而引起厌食。同时还发现,在大鼠下丘脑腹侧注射IL-1受体拮抗剂,动物厌食现象明显改善。动物实验表明,IL-1的厌食作用与5-羟色胺密切相关。肿瘤生长刺激宿主免疫系统,产生IL-1及其他一些细胞因子,影响机体物质代谢,血浆色氨酸浓度增加并通过血-脑屏障,大脑中色氨酸水平增高,使5-羟色胺合成、释放增加,引起厌食。除影响进食外,IL-1还可引起机体组成改变,IL-1导致肝脏蛋白质合成,急性相反应蛋白和ACTH释放,抑制脂蛋白酯酶活性。应用IL-1抗体或IL-1受体拮抗剂可减慢肿瘤生长,改善饮食,保存体脂,从而进一步证实了IL-1在恶性肿瘤患者恶病质发生中的作用。尽管如此,只有少数研究发现荷瘤动物或恶性肿瘤患者中IL-1产生增加,这一现象的可能解释是IL-1和TNF-α一样,是一种自身分泌或旁分泌介质而并不是激素样信使。
IL-6是另一个与肿瘤恶病质有关的细胞因子,恶病质的大鼠血中IL-6水平明显增高,当大鼠切除肿瘤后,体重恢复,IL-6水平下降。此外,IL-6抗体可减轻体重丢失和其他恶病质症状。与IL-1和TNF-α不同,IL-6能从肿瘤动物血中测出,其浓度与肿瘤负荷相关。IL-6这一特征可能与肿瘤部位的其他细胞因子有关,事实上,IL-6的产生有赖于IL-1,中枢神经系统中,IL-1可导致IL-6的产生,后者反过来作用于下丘脑而影响进食。同样,浸润的炎性细胞作用于肿瘤边缘使之产生IL-1,IL-1刺激肿瘤细胞产生IL-6,该作用可被应用IL-6单克隆抗体所中和缓解。
动物实验证明IFN-γ与肿瘤恶病质有关,这可能与TNF作用有关。由于其与TNF有协同作用,IFN-γ常与TNF一起用来作为抗肿瘤制剂。最近的实验研究发现,IFN-γ还有引起恶病质的特殊作用,像TNF一样,IFN-γ减少脂肪合成,降低食物摄入,促使机体组织消耗,产生恶病质。IFN-γ抗体可减轻体重丢失症状,因而认为IFN-γ直接或间接与肿瘤恶病质有关。细胞因子和恶病质对机体代谢的影响见表25-2。
表25-2 细胞因子和恶病质对机体代谢的影响
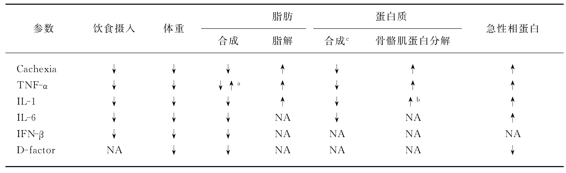
注:a.TNF增加肝脏脂肪合成,但是降低三酰甘油合成。b.IL-1与TNF相互协调导致肌肉蛋白水解增加。c.包括合成功能性肝脏蛋白和(或)骨骼肌蛋白。
细胞因子与导致癌性恶病质的关系是目前受关注的问题。已认识到荷瘤动物和人均可产生各种细胞因子,有些细胞因子是导致恶病质改变的启动因子。尽管获得了部分细胞因子在诱发癌性恶病质中的间接证据,但是各种细胞因子对恶病质的作用远未研究清楚。所能肯定的是:癌性恶病质为多因素而非单因素介导。肿瘤可产生多种活性肽或糖蛋白,刺激宿主免疫细胞诱导产生其他细胞因子。其中部分肽类具有选择性刺激肿瘤细胞生长的能力,而部分则可能是介导代谢异常引发恶病质的原因。因而企图用抑制任何一种细胞介质来显著消除所有肿瘤的癌性恶病质是不可能的。是否有可能通过某种途径阻断总体细胞因子反应,目前尚不知晓(图25-1)。
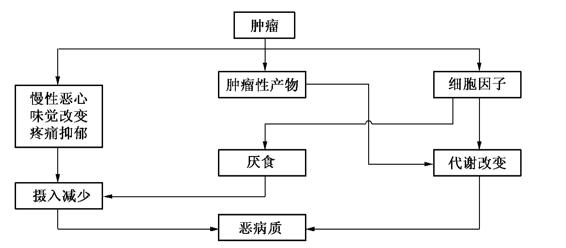
图25-1 细胞因子在诱发癌性恶病质中的作用
(四)肿瘤治疗的影响
对肿瘤患者采用手术、化疗、放疗或生物治疗等多种综合治疗方法,可收到较好疗效,但每一种疗法都会不同程度对患者的饮食和营养产生不利影响。手术治疗的术前准备如术前禁食、术后较长一段时间内无法正常进食均可影响营养物质的摄入。手术创伤造成患者的应激反应,加重患者已存在的氮丢失和机体组织消耗。手术切除肿瘤部位的脏器造成一系列功能障碍,也直接影响营养素的摄入和吸收。如口咽部肿瘤根治性切除术致咀嚼、吞咽障碍,进行鼻饲会引起患者不适。食管切除吻合术切断迷走神经引起胃储留、胃酸减少、腹泻或脂肪痢。胃切除致倾倒综合征、吸收紊乱以及胃酸和内因子缺乏。全胃切除的患者逐渐发生维生素A、维生素B12及维生素D缺乏。空肠切除致营养素吸收障碍。回肠切除致维生素B12、胆盐、水、电解质等吸收障碍和腹泻。盲袢综合征可造成细菌过度繁殖及毒素吸收。大部分小肠切除致短肠综合征,使消化、吸收严重障碍。胰腺切除致内分泌不足,造成吸收不良及糖尿病。肝切除致营养代谢障碍等。
化疗可在很大程度上改变机体的营养状态,这种影响可以是直接的(通过干扰机体细胞代谢和DNA合成和细胞复制),也可以是间接的(通过产生恶心、呕吐、味觉改变及习惯性厌食)。许多抗肿瘤药物可刺激化学感受器的触发区,导致患者恶心、呕吐。消化道黏膜细胞增殖更新快,对化疗极敏感,易发生炎症、溃疡及吸收能力下降,这些结果均可导致营养物质的摄取及吸收减少。由于化疗可使患者免疫损伤进一步加剧,营养消耗进一步恶化,营养不良的肿瘤患者常不能耐受化疗。
放疗可通过作用于胃肠道而影响患者的营养状态。放疗损伤的严重程度与放射剂量及组织被照射量有关。骨髓是另一个增殖更新快的器官,化疗和放疗对其的不良反应表现为贫血、白细胞和血小板减少,导致患者的免疫功能损害及对感染的易感性增加。有营养不良的肿瘤患者对放、化疗药物的降解和排泄功能常有障碍,更易发生伤口愈合不良、感染率增加,术后肠功能恢复延迟及住院时间延长等不良反应。表25-3总结了放疗、外科手术及药物治疗所造成的营养问题。
表25-3 肿瘤治疗不良反应形成的营养问题

(五)激素与神经递质
正常状态下,神经递质,如血清素、去甲肾上腺素与阿片制剂可影响摄食和饮食的选择,当中枢神经系统的血清素活性增高时即成为厌食的原因。动物实验发现一种称为瘦素的肽类物质,其水平高低与机体脂肪储备量直接相关,该肽可与神经肽Y受体结合,抑制该受体活性并产生饱腻感。然而近年来的研究未能证实恶病质患者存在瘦素分泌的明显失调。
与肿瘤代谢异常有关的激素包括胃泌素、血管活性肠肽、血清素、胰高糖素、胰岛素、抗利尿激素、甲状旁腺素及其类似物、生长激素、生长抑素等。
高钙血症是癌症患者最常见的代谢异常表现之一。乳癌、鳞癌、膀胱癌和肾癌、多发性骨髓瘤、淋巴瘤患者出现高钙血症者有20%~40%。常见症状为恶心、厌食、乏力、尿量过多、血压上升、嗜睡、意识模糊、木僵,甚至昏迷。导致高钙血症的主要机制为:①局部溶骨增强,与乳房癌、多发性骨髓瘤、淋巴瘤和白血病有关的破骨细胞激活因子,主要是TNF-β(淋巴毒素);其次,还可能与某些肿瘤细胞刺激生成的骨吸收细胞因子,TNF-α和IL-1及变异的生长因子有关。②骨转移的实体瘤(乳癌、肺癌、胰腺癌)引起散在的破骨性和溶骨性病变。③由非转移性乳癌、肺癌、肾癌、胰癌和淋巴瘤分泌的甲状旁腺素样肽的作用。淋巴瘤患者的高钙血症又与血循环中1,25-(OH)2-维生素D3水平升高有关。Cushing综合征与各型肺癌、类癌和腺癌产生ACTH有关;异常的抗利尿激素综合征与肺癌和结肠癌有关。胰岛细胞瘤产生胰岛素,再加上正常细胞分泌的胰岛素,可引起严重低血糖。已发现曾发生低血糖现象的各类癌症患者中,约21%为原发性肝癌,还有一部分为胃和结肠腺癌。低血糖的发生可能与由肝脏合成的促生长因子的类胰岛素作用有关。许多神经内分泌肿瘤分泌的激素含有阿片样肽,如分泌血清素的肿瘤可引起严重腹泻(类癌综合征),卓-埃综合征与胰腺肿瘤分泌的胃泌素有关,后者的大量分泌降低了肠内pH而抑制胰脂酶功能和损害肠上皮细胞,导致脂肪泻。而血管活性肠肽瘤与Verner-Morrison综合征时的钾离子和液体的丢失有关。
(六)其他因素
肿瘤患者的体重下降则主要体现在脂肪和肌肉组织的丢失。研究认为这种肌肉蛋白的丢失主要源于泛素蛋白酶复合体的激活。泛素-蛋白酶体途径是体内多种细胞内蛋白降解的通路,感染、创伤以及某些慢性消耗性疾病状态下肌肉蛋白丢失与此途径的激活有关。目前认为此途径可能受到包括炎性细胞因子(TNF-α、IL-1、IL-6)、糖皮质激素、蛋白质降解诱导因子等多种因子的激活。在癌性恶病质模型中,小鼠肌肉蛋白质降解增加,泛素-蛋白酶体途径组分的mRNA的表达上调,同时伴有血液循环中炎性细胞因子TNF-α和IL-6水平升高。此外,还发现吲哚镁锌等可降低恶病质小鼠外周血中TNF-α和IL-6浓度,抑制泛素-蛋白酶体途径的激活和肌肉蛋白的降解。在胃癌患者的肌肉中泛素的mRNA的表达较正常机体高,且蛋白酶体水平与肿瘤分期、营养状态、年龄相关。
实验研究发现大鼠接种人类黑素瘤细胞后可产生大量LIF,出现严重的恶病质征象。进一步研究还发现,LIFmRNA仅能从恶病质的大鼠中分离出来,因而认为LIF与恶病质产生有关。目前已发现LIF能抑制脂肪细胞脂蛋白酯酶活性,尽管此作用不如TNF-α,但却是IL-6作用的100倍以上。此外,LIF还可增加脂肪酸的合成。迄今尚无LIF对骨骼肌作用的报道。
有研究发现肿瘤产物可引起脂肪组织中脂肪分解,并能分离出这些物质,称为脂肪代谢因子(LMF)。LMF是一类热稳定能抵御蛋白分解酶的肽类物质,这类物质可通过激活三酰甘油酶活性而引起脂肪分解。动物实验显示,LMF可导致体重下降,脂肪垫重量下降85%,血浆中三酰甘油浓度增高43%,因而其与体脂的动员有关。该类物质呈酸性,它可在不影响进食的情况下使体重明显下降。体外研究发现,鱼油中的多不饱和脂肪酸可抑制肿瘤LMF的产生。
最近研究发现,恶病质大鼠中可分离出一种分子量为24 000的糖蛋白,称为蛋白质代谢因子(PIF)。研究发现PMF与动物恶病质明显相关,动物体重丢失可被应用PMF抗体所抑制。临床上恶病质明显患者尿中可以检测出这种分子量为24kDa的糖蛋白,而无恶病质患者却测不出。此外,在其他原因如烧伤、多发性创伤、手术、感染等体重丢失患者尿中也没有测出该物质。因此,PIF被认为是恶性肿瘤恶病质的一个特殊因子。
二、营养不良的危害
早在1932年,Warren就发现恶性肿瘤患者主要致死原因是营养不良。肿瘤恶病质可导致患者内脏和躯体蛋白质消耗,损害机体组织结构和器官功能,减弱机体免疫力,增加宿主易感性。营养不良时机体能量储备不足,免疫功能下降。在外科患者中,营养不良可增加手术危险性、手术后并发症发生率及手术死亡率。经大组肿瘤病例分析,发现营养状况良好的肿瘤患者的生存率明显优于营养不良患者,伴有营养不良和免疫功能减退时,术后并发症发生率和死亡率均上升。因此,对多数需手术治疗而又伴有营养不良的肿瘤患者而言,围手术期营养支持显得尤为必要。而对于应用化学药物或放射作为治疗手段的、伴营养不良或不能正常摄食的肿瘤患者,营养支持同样必要。Muller等证实胃肠道癌患者术前应用7~10dTPN,术后并发症发生率(11%)和手术死亡率(3%)均低于对照组(分别为19%和11%)。Klein等综合分析了近20年来报道的14项前瞻性的随机性临床研究,证实营养不良的胃肠道癌肿患者,手术后并发症的发生率及手术死亡率明显高于营养状况正常的患者。Eneroth M等将64名接受截肢手术的患者按照营养状况分为营养不良组和对照组,前者给予营养支持,结果发现营养支持组93%的患者伤口愈合,对照组则只有41%达到伤口愈合。James等将145名营养不良患者随机分成接受营养治疗的研究组和不接受营养支持的对照组,这项前瞻性研究表明,对照组中有39%的患者术后发生各类并发症,而研究组只有18%的患者出现并发症。此外,该研究还发现两组的死亡率差异有显著意义,对照组的死亡率高达28%,而研究组则为4%。Beattie等将101名急性病期老年患者随机分为营养支持组和常规治疗组,观察短期及远期效果。研究发现3个月后营养支持组死亡率为12%,常规治疗组为27%,6个月后分别为16%和29%,12个月后分别为28%和34%,两者差异有显著性,而且营养支持组生活质量明显提高。Francesco Landi调查了意大利小城Rovereto 214名患者后发现,低BMI(<22kg/m2)患者的1年存活率明显低于高BMI(>27kg/m2)患者。总之,合理、有效地提供营养支持,可改善大部分营养不良肿瘤患者的营养状况,提高患者对治疗的耐受性,减少并发症发生,改善预后。
三、营养支持的作用
营养支持的目的是提供机体适当的营养底物,维持机体的组成、生理及免疫功能,帮助患者安全度过治疗阶段,减少或避免由于治疗引起的不良反应,维持良好的生活质量。因此,对多数需手术治疗而又伴有营养不良的肿瘤患者而言,围手术期营养支持显得尤为必要。而对于接受化疗和放疗并伴营养不良或不能正常摄食的肿瘤患者,营养支持同样必要。对肿瘤患者而言,荷瘤状态与去瘤状态下的营养支持效果截然不同。评价营养支持是否有效主要涉及宿主营养状况、生活质量的改善和对预后的影响。
(一)改善宿主营养状况
临床经验提示,若在抗肿瘤治疗合并营养支持后,凡体重获得增加者,预后均较理想。对于肿瘤患者而言,营养支持能否使体重增加并得以长期维持,结论不一。由于皮下脂肪的积聚和维持需较长一段时期才能明显表现,以致营养支持前后皮下脂肪厚度改变的差异常难以明确反映和测得。因此,到目前为止,对于短期营养支持有效改善人体测量指标的报道极少。Bozzetti等对一组伴严重恶病质的进展期肿瘤患者应用长达20d的TPN后,方观察到患者体重、三头肌皮褶厚度有所增加,而上臂肌肉周径和总体肌群则未见明显改变。
实验室指标主要包括蛋白质代谢和免疫系统功能的改变。曾有报道,提供已存在营养不良的胃癌患者2周TPN,并测定TPN对骨骼肌肌肉中高能磷酸化合物、肌肉内水、电解质和游离氨基酸水平的影响。TPN前,这些患者的肌肉内总腺嘌呤核苷酸池、磷酸肌酸、肌酸和糖原减少;TPN支持后,除肌糖原恢复正常外,其余指标无明显变化。究其原因,可能是机体对能量或蛋白质亏空产生适应性变化引起的酶代谢异常所致;其次,是TPN支持时间太短。但Bozzetti等的实验结果提示:即使应用长达20d的TPN,有些指标仍不能恢复正常,尤其血浆蛋白类。该作者发现半衰期很短的胆碱酯酶(12h)和总结合前清蛋白(48h)的水平在TPN前均低于正常值或处于临界状态,在应用了远较它们半衰期长的TPN后,仍未见上升。因而推测,血浆蛋白质对营养支持的反应似乎不是单纯与蛋白质分子的半衰期有关,或不能简单地用其血浆中的水平高低来评价。从整体蛋白质代谢角度分析,TPN具有促进其更新作用。有研究发现,进展期上消化道癌肿患者在TPN后,虽未达到净蛋白质合成状态,但至少可减少部分蛋白质的分解流失,甚至于接近正氮平衡,这主要得益于机体蛋白质分解代谢减少和合成增加的综合作用。
(二)改善机体免疫功能
中、晚期肿瘤患者除营养不良外,还同时伴有明显的免疫功能低下。如NK细胞活性和Th细胞水平低下,而Ts水平高于正常人。这种免疫功能低下系由某些抑制因子所为。对于肿瘤患者于围手术期或荷瘤状态下的营养支持对免疫功能的改善程度较难作出确切的评价。主要原因是与肿瘤有关的免疫抑制并非经营养支持就能轻易消除;其次,较大的手术创伤亦可下调机体的免疫功能,由于这些因素的影响和干扰,往往很难分得清营养支持所起的作用。尽管如此,国内外还是有不少报道指出:术前或术后1周左右的TPN能增强自然杀伤细胞活性、提高Th和Th/Ts细胞比例,虽然未能达到正常值范围,部分细胞免疫功能已得到改善。但术后Ts细胞比例并未表现出下降趋势,说明TPN虽能提高Th细胞比例,却不能在短期内消除肿瘤或手术所致的免疫抑制作用。
由于TPN中缺乏免疫增强物质及TPN的潜在问题,如与深静脉导管有关的感染性并发症和与TPN有关的胃肠道黏膜屏障功能受损所致的肠源性感染等,促使临床医生考虑采用更符合生理的肠内营养支持。业已证实,术后早期肠内营养支持能维持胃肠道黏膜结构的完整性和屏障功能,调节肠道菌群,有助于防止肠道细菌移位和肠源性感染。近年,更有人尝试在标准肠内营养的基础上,增加精氨酸、ω-3脂肪酸和核糖核酸,以期改善癌性恶病质,增强肿瘤患者的免疫功能,提高抗侵袭性治疗的能力。这些优点已在部分术后早期接受肠内营养支持的胃肠道肿瘤患者的应用中得到证实。
(三)降低并发症改善预后
自20世纪60年代后期起,营养支持虽已作为改善肿瘤患者营养不良的一种手段,但仍不主张常规应用,理由是并非每个患者都能从中获益。对营养支持效果持肯定态度者认为,虽然外源性营养物质不足以完全抑制内源性葡萄糖的生成,但不能否定其部分节氮作用。一旦机体获得足够热氮量,即可改善营养状况和提高免疫功能,术后感染性并发症显著减少。Muller等从临床角度证实胃肠道癌患者术前应用7~10dTPN,术后并发症发生率(11%)和手术死亡率(3%)均低于对照组(分别为19%和11%)。相比之下,少于1周的TPN者则未能获益。Klein等综合分析了近20年来报道的14项PRCTs,这些研究包括1 250例,多数为胃肠道癌肿患者,根据其体重下降程度、血浆蛋白水平、预后性指数等,至少被评判为“中等程度营养不良”,其中有9项报道证实手术前接受7~10dTPN者的术后并发症少于对照组;5项研究结果有统计学意义。该14项研究总的结果倾向:TPN使术后并发症的发生率自40%降至30%,使并发症的危险性下降了10%。除此以外,其他众多作者也相继报道了围手术期TPN对于肿瘤患者的临床意义。(https://www.xing528.com)
综合营养支持对改善营养状况、免疫功能、减少并发症发生率和死亡率的效果,各执一词。分析导致这些研究结果大相径庭的原因,关键在于一些PRCTs存在诸多设计缺陷,包括:①患者来源不均一,如不同肿瘤类型和分期,掩盖了某个营养支持方案在某些病例中可得到的较满意的疗效。②许多研究排除了严重营养不良的患者,而这部分患者恰恰是可能从营养支持获得最大利益的那部分;反之,术前营养状况正常者不可能自营养支持获益。③各研究间,对特殊类型的肿瘤基本治疗方案不一致,可比性差。④营养支持的配方组成、开始支持的时间和持续时间不合适,如某些研究中的过量葡萄糖和脂肪乳剂可能影响免疫功能和增加感染的危险性。⑤不适合地将并发症和病死率作为独立的评价预后的指标,而这些指标较之重要的临床终点指标(如瘦体群的增加、儿童生长、功能状态和生活质量等)更不易受营养治疗的影响。⑥多数研究涉及TPN的应用,但TPN本身较肠内途径的营养支持更易出现感染性并发症。⑦样本太小。正是由于这些设计上的不足,得出的结论就显得过于笼统和含糊,以致局限了各项PRCTs研究结论的代表性和营养支持在临床的合理应用。
一些研究将生存率作为评价营养支持有效与否的重要标准,这是极其不合理的。试想需要营养支持的肿瘤患者多为晚期、伴恶病质和转移,已知这些患者对任何的抗肿瘤治疗均无有效反应,又有什么理由寄希望于营养支持必能延长生存或者明显改善生活质量呢?事实是,对于大多数处于进展期和体重持续下降的肿瘤患者而言,逆转营养不良的努力往往是徒劳的,除非在肿瘤被切除或根治的基础上,方有可能达到营养支持的预期目标。因此,营养支持效果的体现,关键在于识别能自营养支持获益的患者,并及时、合理应用。
四、营养支持的实施
目前,在我国临床肿瘤的治疗中,尚未重视营养支持的重要性,许多大型的肿瘤专科医院还很少有专门的营养支持小组,很多肿瘤患者是在饥饿及营养不良的情况下,反复多次地进行化疗、放疗或手术治疗。由于营养不良,血浆蛋白水平降低,机体对化疗药物的吸收、分布、代谢及排泄均产生障碍,明显影响化疗药物的药动学,导致化疗药物的毒性作用增加,机体耐受性下降,抗肿瘤治疗效果也有明显影响。营养不良也同样使放疗患者的耐受性下降。已有大量的研究表明,恶性肿瘤患者营养不良的发生率高达40%~80%。在诊断时约有一半的肿瘤患者已有体重下降。其中以食管癌、肺癌、胃癌及胰腺癌等肿瘤患者的营养不良发生率最高。营养不良不但导致抗肿瘤治疗耐受性下降,而且由于营养物质的缺乏,导致免疫功能下降,感染发生率增加。因此不难发现,营养不良的肿瘤患者在各种治疗中,并发症及病死率均有显著升高。同时,由于营养不良导致消瘦、体弱等原因,严重地影响患者的体力,导致生活质量下降。早在20世纪30年代就有研究报道,约有20%以上的肿瘤患者直接死亡原因是因为营养不良。另外,在值得注意的一项研究中发现,体重下降的化疗患者与体重没有下降的化疗患者相比,前者的生存时间明显缩短。由此可见,营养不良直接影响了肿瘤患者的预后及生活质量。因此,在肿瘤患者的治疗过程中,重视营养支持,改善营养状况是非常必要的。
(一)营养物质需要量
肿瘤患者的营养需求应依据疾病发展的程度、肿瘤类型、肿瘤部位及患者全身情况逐一考虑。
1.能量 无明显消耗的患者给予104~145kJ(25~45kcal)/(kg·d),已有明显消耗的患者可达210~250kJ(50~60kcal)/(kg·d)。无明显消耗或肿瘤局限的患者按REE的110%~130%供能。非蛋白热量中脂肪占30%~50%,输入葡萄糖的量和速率使血糖不超过11.1mmol/L为宜。
2.蛋白质 一般可按1~1.5g/(kg·d)给予。严重营养消耗者可按1.5~2.0/(kg·d)给予。
3.水、电解质 水一般按30~50ml/(kg·d)或1 400ml/d给予。最主要的仍然是参照血生化指标及出入量记录,按“量出为入”和“按缺补入”两个原则,使每日尿量维持在1 000~1 500ml,血清电解质维持在正常范围。老年人,有心、肺、肾等脏器功能衰竭的患者特别注意防止液体过多。
肿瘤患者营养支持的特殊规律一直受到关注,并对其进行了广泛的研究。近年来也有很大的进展,但有很多理论尚处于假设、动物试验和临床验证阶段,实际临床应用于肿瘤患者的特异营养支持措施、基质和调节因子尚不多。1993年美国肠外和肠内营养协会(ASPEN)经过各方面专家长期讨论,制订了肿瘤患者营养支持原则,在目前是较合理的。肿瘤患者营养支持指导原则:①肿瘤患者若有严重营养不良或因胃肠道障碍和其他代谢、药物、放疗等毒性因素预期患者饮食不足1周者,应给予肠内或肠外营养支持,并尽可能进行抗癌治疗。②营养良好或仅有轻度营养不良,并预期自然饮食足够的肿瘤患者在手术、化疗或放疗时无须特殊营养支持。③完全肠外营养支持无益于对化疗或放疗无效的进展期肿瘤患者。
(二)营养支持途径
肿瘤患者的营养支持途径与其他疾病一样,应按患者的具体情况而定。临床上营养支持的方式分为肠内或肠外营养支持。目前认为,只要患者胃肠道功能完整或具有部分胃肠道功能,能源物质供给的最佳途径是胃肠道。肠内营养是一种简便、安全、有效的营养支持方法,与肠外营养相比,它比较符合生理状态,能维持肠道结构和功能的完整,费用低,使用和监护简便,并发症较少,在摄入相同热卡和氮量情况下节氮作用更明显,因此在临床营养支持中占有越来越重要的地位。若存在消化道高位梗阻(如胃癌伴幽门梗阻)、高位或高排量肠瘘、消化道严重出血、广泛黏膜炎症、严重肠功能紊乱、治疗限制不能利用胃肠道或患者不能耐受经肠营养时,则选择肠外营养支持。
当肿瘤患者摄食量不足以满足需要时,只要患者胃肠道功能基本正常并且能耐受肠内营养制剂,就可选择肠内营养。经肠途径应视患者消化和吸收功能情况按步进行。首先在有可能时鼓励患者口服,口服不足或不能时用管饲补充肠内营养液,经鼻胃管途径时应选择管径细、质地软但不易折曲、对黏膜刺激少的饲入管,尽可能使用带有导丝的,或管头带有钢珠等重力引导的特制营养管,使管端通过幽门进入十二指肠远端,甚至达到空肠近端,尽可能用输液泵匀速输入。手术患者,预期手术后需较长时间营养支持者,尽可能术中经空肠造瘘置入营养管,需进行较长时间营养支持,如无腹部手术机会,则尽可能采用借助于内镜经皮经胃置入营养管于十二指肠或空肠内,以利于实施肠内营养。
肠外营养是临床营养支持的重要组成部分,经过几十年的临床应用,肠外营养在理论、技术和制剂各方面均日趋成熟并得到很大发展,在临床治疗工作中发挥了重大作用,挽救了许多肠衰竭患者的生命。肿瘤患者的肠外营养支持原则上与其他疾病时相同。
值得注意的是,没有一种途径适合所有患者,某个患者在整个治疗过程中其营养支持途径也不是一成不变的,应视患者具体情况采用最适合的途径给予。
(三)特殊营养物质的应用
肿瘤患者营养支持涉及诸多因素,既要防治或纠正营养不良,又要避免促进肿瘤生长。为了避免营养支持促进肿瘤生长的危险性,不少学者努力探索适合于肿瘤患者的营养支持方案。近年来,有些学者根据肿瘤细胞的代谢特点,提出通过添加某些特殊营养物质,利用其药理作用改变体内代谢障碍的环境,达到既有利于改善营养不良而又有碍于肿瘤细胞扩增的作用。目前研究较多的营养物质有谷氨酰胺(glutamine,Gln)、精氨酸(arginine,Arg)和ω-3脂肪酸。
Gln是体内含量最丰富的氨基酸,是合成核酸、类脂和其他氨基酸的前体,是将氮从骨骼肌转运至内脏器官的主要载体,也是快速生长的肿瘤细胞的必须物质。尽管Gln属非必须氨基酸,但对快速增生的肿瘤细胞来说,则是“必需”氨基酸。实验研究表明,肿瘤进行性生长,干扰了器官内Gln循环,消耗大量Gln,导致宿主细胞Gln和谷胱甘肽的缺失,引起恶病质。临床上忧虑的是:Gln既然是快速增长的恶性肿瘤细胞的重要燃料,提供合成DNA结构的前体,那么外源性增强的Gln是否会促进恶性肿瘤的生长呢?研究表明,肿瘤生长不受外源性提供Gln的刺激,因而即使不提供Gln,肿瘤细胞作为体内Gln捕捉器,它也要摄取足够内源性Gln,肿瘤合成DNA或肿瘤Gln酶活性是由肿瘤本身特性所决定。大量的在体实验证据提示,补充Gln并不导致肿瘤生长,相反,事实上Gln可通过刺激机体免疫系统,以减慢肿瘤生长。此外,Gln能降低肿瘤细胞内的谷胱甘肽浓度,从而增强肿瘤细胞对放疗及化疗的敏感性,有效增强放疗及化疗的治疗效果。同时,补充外源性Gln能够使正常宿主细胞降低的谷胱甘肽水平恢复正常,从而改善宿主的整体情况,使与肿瘤及其治疗相关的并发症发生率及死亡率降低。
精氨酸属半必需氨基酸。它是生长激素、胰岛素和催乳素的促分泌素,所有这些激素对机体的免疫反应都具有正性作用。此外,Arg对肿瘤生长也起一定调节作用。从细胞水平看,Arg被用于所有组织的细胞质和核蛋白合成。经Arg酶的作用,Arg可转化为鸟氨酸(ornithine,Orn),后者对免疫系统起影响。大量的动物实验和临床研究结果表明,Arg并不直接作用于肿瘤,而是通过其非特异性免疫调控作用达到改善宿主免疫力和抑制肿瘤生长的效果。精氨酸的抗肿瘤机制为:①抑制肿瘤的多胺合成,肿瘤组织多胺代谢活跃,多胺与肿瘤的增殖密切相关,精氨酸可抑制多胺的生物合成,进而抑制肿瘤的核酸和蛋白质的合成。②免疫作用,精氨酸可诱导胸腺和脾T细胞产生,加强LAK和NK细胞活性,促进IL-2生成及受体表达,激活巨噬细胞的细胞毒作用。③精氨酸是NO前体,NO可直接抑制肿瘤细胞线粒体呼吸、三羧酸循环和核酸合成,导致肿瘤细胞产生细胞内酸中毒而死亡。另有研究表明,精氨酸对免疫原性或肿瘤相关抗原阳性肿瘤具有抑制作用,而对弱免疫原性肿瘤具有刺激生长作用。大剂量精氨酸具有抑制肿瘤作用,小剂量具有刺激作用。
除以上两种氨基酸外,人们还试图去除食物中的赖氨酸、苯丙氨酸、酪氨酸、亮氨酸、异亮氨酸等,认为其可抑制肿瘤生长,但还需要进一步研究证实。
ω-3多不饱和脂肪酸对肿瘤生长的抑制作用是近年来研究的热点,现今已有的研究从肠外和肠内两种营养支持途径探索了ω-3脂肪酸的这种特殊作用,均发现其有延缓或抑制肿瘤生长的作用。有关ω-3脂肪酸对肿瘤生长的抑制作用至少有3种解释:①增强宿主抗肿瘤细胞的防御机制。②改变肿瘤细胞膜结构而促进肿瘤细胞对宿主防御系统的易感性。③通过影响免疫细胞群(脾细胞、胸腺细胞和淋巴细胞)的磷脂部分,减少前列腺素E2的生成,从而影响几种生物活性分子,如IL-1、TNF、干扰素和其他生长因子的功能。
需要强调的是,特殊营养物质对肿瘤细胞的增殖或抑制作用需以细胞间复杂配合的调节过程为前提。迄今,对有关营养物质影响肿瘤细胞增殖的机制了解还较表浅。推测这种影响可能存在于G0期细胞的活动水平,某些营养物质通过改变肿瘤细胞合成新的蛋白质的能力,限制G1期细胞群的充实。同样,促使肿瘤细胞内蛋白质降解也可达到限制肿瘤细胞合成DNA的能力的目的。此外,特殊营养物质还可能通过影响信息或信号的传递,以改变肿瘤细胞内蛋白质的代谢过程,最终表现为抑制肿瘤细胞的增殖。
(四)肿瘤恶病质的药物治疗
(1)抑制细胞因子产生的制剂 皮质类固醇抑制TNF的释放;甲基黄嘌呤通过抑制TNF基因转录而抑制TNF产生;大麻素能抑制IL-21分泌可明显改善患者食欲、情绪和恶心症状,体重增加;ω-3不饱和脂肪酸抑制细胞因子的合成和活性,也能改善机体免疫状态和糖代谢过程。
(2)抑制细胞因子作用于靶器官的药物 抗细胞因子单克隆抗体或细胞因子特殊受体拮抗剂。
(3)作用于细胞因子产生代谢异常的药物 同化激素固醇类同化激素可促进氮积累和维持体内蛋白质储存;生长激素促进体内正氮平衡,增加机体瘦组织群,增加脂肪合成和脂肪酸氧化;胰岛素样生长因子-1刺激氨基酸摄取和蛋白质的合成,同时抑制脂肪分解;硫化肼抑制糖异生,从而改善体内代谢,降低成糖氨基酸量,保护体内瘦组织群;支链氨基酸增强肿瘤患者的食欲有利蛋白合成而无刺激肿瘤生长;谷氨酰胺机体免疫功能、胃肠道黏膜完整性和机体蛋白质代谢;精氨酸提高荷瘤机体的特异及非特异免疫功能;核苷酸可提高机体的迟发性超敏反应能力,增强机体抗感染能力,增加IL-22的产生。
(4)促孕激素 甲地孕酮、安宫黄体酮刺激神经肽Y和调节下丘脑中部的钙离子通道并阻止细胞因子TNF、IL-1、IL-6的作用,从而增强食欲、改善患者营养状态,其效应为剂量依赖性,但随着剂量加大其不良反应亦增加。
(5)其他 赛庚啶;酞胺哌啶酮(镇静剂);退黑激素;β2-肾上腺受体拮抗剂;己酮可可碱;甲氧氯普胺(胃复安)能够刺激胃的运动以治疗慢性恶性和过饱胀感,增加食欲,60~120mg/d,分4~6次口服给予。目前有12h控释片有更好的效果。
总之,合理、有效地提供营养支持,可改善大部分营养不良肿瘤患者的营养状况,提高患者对治疗的耐受性,改善预后。肿瘤专用型肠内营养制剂将是临床上肿瘤患者肠内营养支持时的理想选择。
临床病例分析讨论
【病史摘要】
季×,男性,63岁。因进行性吞咽困难、心窝部疼痛不适4个月来院就诊。患者自4个月前出现心窝部隐痛、不适,同时出现进食哽噎感,开始在进固体普食时出现,随后进食半流质时也出现哽噎感,目前仅能进流质饮食。4个月来患者体重下降8kg。患者既往有多年的高血压病史,长期吸烟史。体格检查:体温36.6℃,脉搏66次/min,呼吸16次/min,血压180/100mmHg,身高176cm,体重为64kg,心、肺无殊,腹平坦,未见胃、肠型,全腹未触及肿块,无压痛,无肌紧张,肠鸣音正常,四肢、关节正常。辅助检查:红细胞4.08×1012/L,血红蛋白110g/L,血细胞比容39.3%,血小板214×109/L,白细胞5.9×109/L,清蛋白29g/L,前清蛋白0.12g/L,尿素5.0mmol/L,肌酐64μmol/L,葡萄糖6.3mmol/L,三酰甘油2.7mmol/L,总胆固醇6.9mmol/L,钠146mmol/L,钾3.7mmol/L。食管吞钡摄片提示胃底贲门部巨大充盈缺损,胸腹部CT检查提示贲门部癌侵犯周围组织,临床分期为Ⅲ(T3,N1,M0)。胃镜检查发现食管下段贲门部明显狭窄,病理证实是贲门腺癌。
入院诊断:贲门癌。
治疗经过:患者入院后决定进行综合治疗,贲门部行放疗以缩小局部病灶,增加手术切除可能性,同时接受化疗,以减少转移发生率。
问题一:该患者是否需要营养支持,具体营养物质的需要量如何?
讨论:该患者病程较长,发病以来体重下降>10%,存在明显的低蛋白血症。目前该患者无法正常进食或通过口服摄入足量的营养物质,同时该患者需要接受大剂量放、化疗,不可避免会产生各种不良反应,影响患者的营养状况。因此,该患者符合人工营养支持指征。
一般说来,要维持肿瘤患者的营养状况和增加患者的体重,推荐的热量为125.52~142.26kJ/kg(30~35kcal/kg),蛋白质需要量为1.5~2.5g/kg,体液量为1 500ml/m2,同时按照正常推荐量提供矿物质、维生素和微量元素。因此,该患者所需的热量约为8 368kJ/d(2 000kcal/d),蛋白质约为110g,液体量约为2 500ml/d。营养科按照上述营养素的需要量进行配餐,但患者通过口服仅能摄入约50%能量、30%蛋白质和60%液体量。鉴于此,我们嘱患者通过分次口服高能量密度6.276kJ/ml(1.5kcal/ml)的整蛋白型肠内营养制剂以补充不足部分的营养素。同时,患者开始接受为期5周的放疗,在治疗初期,患者无明显不良反应,营养物质的摄入量无明显影响,患者体重增加1.5kg。但是,在放疗2周后患者出现乏力、虚弱、食管反流、纳差,进食量明显下降,再次出现体重下降。
问题二:此时,应采用何种方式维持患者的营养状况,如何实施?
讨论:该患者消化道功能基本正常,因此首选的营养支持方式应为肠内途径。由于需要接受放疗,且有明显食管下段贲门部狭窄,不宜放置鼻/肠胃管。此外,由于该患者需要较长时间的营养支持,今后可能会接受手术,且患者有明显的食管反流现象,存在潜在的反流、吸入性肺炎的危险。因此,我们认为该患者理想的肠内营养途径是内镜下经皮空肠造瘘术(PEJ)。该患者在成功实施PEJ后给予标准能量密度4.184kJ/ml(1.0kcal/ml)的整蛋白型肠内营养制剂,EN从低容量、低浓度开始,循序渐进,逐渐提高输注速度和营养液浓度,逐渐增至全量(2 000ml/d),但当EN容量增至1 500ml左右时患者出现腹胀、腹泻等消化道症状,我们在减慢输注速度后上述症状消失,恢复肠内营养。放疗结束后,该患者接受4个疗程的化疗。化疗期间患者出现明显的恶心、呕吐、腹泻症状,严重影响患者的进食和EN的实施。
问题三:放、化疗期间如何实施营养支持,该患者此时如何调整营养支持的策略?
讨论:放、化疗在杀灭肿瘤细胞的同时,也损伤正常的组织细胞,特别是快速增殖细胞。除了对骨髓的抑制外,消化道黏膜上皮也是容易受累的组织,化疗药物可阻止胃肠道黏膜上皮细胞DNA的合成,导致胃肠道黏膜上皮细胞的代谢障碍,形成溃疡,加重肝细胞损害,造成口炎、咽喉炎、胃肠道黏膜炎症和肝功能障碍。临床上患者常表现恶心、呕吐、厌食和腹泻等症状,有时甚至出现便血,严重影响患者的摄食和吸收,加重营养不良的发生。此外,放、化疗可损害机体的免疫功能,增加感染性并发症的发生。许多严重营养不良的患者往往难以承受大剂量的放、化疗。因此,对肿瘤患者放、化疗同时进行营养支持是十分必要的,特别对存在摄入、吸收障碍的患者进行营养支持,以确保放、化疗方案的完成。
肠内营养可加速放、化疗损伤的胃肠道黏膜的修复,有助于维护肠黏膜屏障、防止肠道细菌易位。因此,临床上应首先考虑和选择肠内营养支持。如果患者存在严重的胃肠道功能障碍或明显消化道症状,则应选择肠外营养支持。该患者在化疗期间出现明显的恶心、呕吐、腹泻症状,严重影响患者的进食和EN的实施,此时可选择肠外营养支持。
放、化疗结束后,复查CT发现患者贲门部病灶明显缩小,决定行胃底贲门部肿瘤根治性手术。手术后患者出现麻痹性肠梗阻,改用肠外营养支持。术后第7天,患者胃肠道功能恢复,再通过PEJ进行肠内喂养,输注速度从25ml/h开始,每日递增25ml/h,逐渐增加至全量,患者胃肠道耐受性良好,术后20d康复出院,嘱出院后通过PEJ造瘘管进行家庭肠内喂养,以进一步改善患者的营养状况。
问题四:该患者长时间荷瘤,接受营养支持是否会加速肿瘤细胞生长、繁殖?
讨论:肿瘤患者的营养支持治疗中,外源性营养物质的摄入是否会促进肿瘤生长,一直是临床医生担心并且争议较大的一个问题。不少学者在动物试验中用肿瘤体积、重量、有丝分裂活动度、DNA和RNA浓度、蛋白质合成率作为指标,证明接受营养支持后肿瘤生长明显快于宿主正常机体组织。有些学者认为,营养支持有可能促进肿瘤生长,饥饿、减少能量摄入、无蛋白饮食可减慢肿瘤生长。对肿瘤患者进行营养支持,人们往往担心营养支持可能会潜在性刺激肿瘤生长。但这些研究是在动物身上进行,而关于营养支持与人体肿瘤生长间关系的严格的对照研究报道并不多。事实上,人体肿瘤于动物实验的肿瘤存在很大差别。动物实验的移植性肿瘤倍增时间短、增长迅速、死亡快,肿瘤占总体的比例高,这些特点可能是实验性肿瘤对营养缺乏较为敏感的原因。而人体肿瘤增长速度相对较慢,实体瘤的平均倍增时间超过100d。此外,人体肿瘤所占体积一般不超过5%。因此,短时间的营养支持不可能对肿瘤的增长产生明显影响。
在肿瘤患者,问题的关键是即使外源性营养物质供给缺乏或严重不足,肿瘤仍能从宿主不断获取所需要的营养物质,以满足肿瘤不断增长的需要,致使宿主产生恶病质。另一方面,即使提供充足的营养支持,人体肿瘤仍按其本来的生物学特征进行增殖。所以,此时如限制营养物质的摄入,对宿主机体产生的危害要远远超过抑制肿瘤生长的益处。因此,目前有关营养支持在肿瘤患者中的正性作用已成为人们的共识,迄今为止尚无营养支持增加肿瘤复发率或转移率、降低生存率的报道。此外,近年来的一些研究还证明,使用免疫营养物质,非但不会促进肿瘤细胞的生长,反而抑制其生长,取得了一定的抗肿瘤治疗的效果。可能的解释是营养促进了肿瘤细胞的分裂,S期的细胞增多,有利于化、放疗的作用。另外,此类营养物在协同抗肿瘤治疗作用时,可减少化疗药物引起的严重毒副作用,这也是激发人们越来越多地关注营养支持在肿瘤治疗中应用的重要原因。有学者提出,对于肿瘤患者的营养支持应根据肿瘤的不同病理类型及不同的分级和分期,遵循个体化的原则。在接受手术、化疗、放疗的肿瘤患者中,使用营养支持的目的主要是帮助他们完成抗肿瘤的治疗方案,改善营养,促进机体的康复及愈合,减少并发症及不良反应,保持良好的体力及功能状态。对于不能接受进一步抗肿瘤治疗,处于姑息支持治疗阶段的患者,营养支持的主要目的是改善生活质量。
问题五:该患者放、化疗期间或后肠内营养时是否需要应用肿瘤专用型肠内营养制剂?
讨论:临床上应用的肠内营养制剂的种类较多,可根据其组成分为要素型肠内营养制剂和非要素型肠内营养制剂。一般来说,对于胃肠道功能正常患者,可采用以整蛋白或分离蛋白为氮源的非要素型肠内营养制剂。如患者消化或吸收功能受损,则选用要素型肠内营养制剂。最近,德国Fresenius-Kabi推出了根据肿瘤患者代谢特征设计的肿瘤患者专用型肠内营养制剂——Supportan,并已在国内上市。Supportan是一种高能量、高脂肪、低碳水化合物的整蛋白纤维型肠内营养制剂,另富含免疫增强物质核苷酸、ω-3不饱和脂肪酸及抗氧化剂维生素A、维生素C和维生素E,可改善肿瘤患者的免疫状况,提高机体的抗氧化能力。临床研究表明,与普通肠内营养制剂相比,Supportan具有良好胃肠道耐受性,可促进机体内脏蛋白合成,改善肿瘤患者的营养状况,增强肿瘤患者免疫功能,抑制手术后急性炎性反应。进一步的研究证实,Supportan对肿瘤患者免疫和炎性反应调节的机制与其所含的特殊营养素有关。其中ω-3不饱和脂肪酸具有免疫增强作用,可抑制肿瘤生长,对肿瘤恶病质具有治疗作用。同时,ω-3不饱和脂肪酸还具有较强的抗炎作用,可抑制炎性介质和PGE2等免疫抑制物质的产生。此外,核苷酸具有免疫增强作用,可以提高肿瘤患者的免疫功能。维生素A、维生素C和维生素E可提高机体的抗氧化能力,清除体内自由基,对手术创伤引起的缺血再灌注损伤具有防治作用。另一方面,由于Supportan蛋白质含量高,脂肪占总能量的50%,更符合肿瘤患者的代谢特点。研究表明,与普通肠内营养制剂相比,Supportan可明显缓解肿瘤患者的体重丢失,提高患者的BMI,改善患者的营养状况,增强机体免疫功能,抑制手术后肿瘤坏死因子(TNF-α)等炎性因子的释放。我们的研究和临床实践发现,术后早期应用Supportan经肠喂养,能增强宿主防御能力,降低感染性并发症的发生,缩短住院时间并改善预后。
(吴国豪)
参考文献
1.Sakurai Y,Klein S.Metabolic alteration in patients with cancer:nutritional implications.Surg Today,1998,28(3):247~257
2.Younes RN,Noguchi Y.Pathophysiology of cancer cachexia.Rev Hosp Clin Fac Med Sao Paulo,2000 Sep-Oct,55(5):181~193
3.Argiles JM,Busquets S,Lopez-Soriano FJ.Cytokines in the pathogenesis of cancer cachexia.Curr Opin Clin Nutr Metab Care,2003Jul,6(4):401~406
4.Inui A.Cancer anorexia-cachexia syndrome:current issues in research and management.CA Cancer J Clin,2002Mar-Apr,52(2):72~91
5.Brown JK,Byers T,Doyle C,et al:Nutrition and physical activity during and after cancer treatment:an American Cancer Society guide for informed choices.CA Cancer J Clin,2003,53(5):268~291
6.Palesty JA,Dudrick SJ.What we have learned about cachexia in gastrointestinal cancer.Dig Dis,2003,21(3):198~213
7.Tijerina AJ.The biochemical basis of metabolism in cancer cachexia.Dimens Crit Care Nurs,2004,23(6):237~243
8.Moskovitz DN,Kim YI.Does perioperative immunonutrition reduce postoperative complications in patients with gastrointestinal cancer undergoing operations?Nutr Rev,2004,62(11):443~447
9.Grimble RF.Immunonutrition.Curr Opin Gastroenterol,2005,21(2):216~222
10.Bozzetti F,Bozzetti V.Efficacy of enteral and parenteral nutrition in cancer patients.Nestle Nutr Workshop Ser Clin Perform Programme,2005,10:127~139
11.Colasanto JM,Prasad P,Nash MA,et al.Nutritional support of patients undergoing radiation therapy for head and neck cancer.Oncology,2005,19(3):371~379
12.Huhmann MB,Cunningham RS.Importance of nutritional screening in treatment of cancer-related weight loss.Lancet Oncol,2005,6(5):334~343
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




