第三节 肝母细胞瘤和肝细胞癌
一、概述
儿童期原发性肝脏恶性肿瘤(primary liver malignant tumors,PLMTs)在美国约占儿童肿瘤的0.5%,在欧洲约占儿童恶性肿瘤的2%,而在日本、中国、东南亚和非洲撒哈拉沙漠以南等地发病率更高。对于该病,如果肿瘤能完全切除预后较好,而辅助性放疗和化疗对手术治愈起着支持作用。另外,在儿童还有几种良性肝脏肿瘤,对这些良性肝脏肿瘤可采取手术切除或观察随访,偶尔也可进行放疗。
二、临床表现、分期和检查
(一)常见的症状和体征
表现为腹块或全腹膨胀,有的患儿主诉右上腹疼痛。发热、食欲不振、体重减轻或恶心、呕吐等也有发生。有时,首发症状为急腹症表现,此乃肿瘤破裂和腹腔积血引起。原发性肝脏恶性肿瘤有时也会引起癌旁综合征,以贫血和血小板增多常见。这可能是由于肿瘤性肝母细胞分泌白细胞介素-1B,后者刺激纤维母细胞分泌白细胞介素-6所致。
肝母细胞瘤(hepatoblastoma,HBL)是最常见的儿童期肝脏原发性恶性肿瘤,通常发生在20岁以前,占所有恶性儿童肿瘤的1%,儿童肝脏恶性肿瘤的50%~60%。诊断时中位年龄为1~2岁,绝大多数病例确诊时<3岁,男孩多见。肝母细胞瘤有时可与Beckwith-Wiedeman综合征、Wilm瘤、肾上腺皮质肿瘤和胎儿酒精中毒综合征、家族性腺瘤息肉病、早产、低出生体重,绒毛膜促性腺素的分泌异常引起的性早熟和血小板增多症等病症同时存在。
肝母细胞瘤根据其组织学特性分成两大类型:传统型(conventional)或分化差型(anaplastic)。传统型肝母细胞瘤包括胎儿型肝母细胞瘤、胚胎型肝母细胞瘤,或这两种细胞瘤的混合型。胎儿型肝母细胞与正常胎儿肝脏的细胞结构相似,由柱状细胞整齐排列成单层或双层,这两类细胞都能分泌甲胎蛋白AFP,能形成肝血窦,没有肝内胆管。胎儿型肝母细胞瘤细胞比正常肝细胞略小,核/浆比较小。而胚胎型肝母细胞瘤细胞核/浆比较大,胞质成分少,呈致密的嗜碱性胞质,光镜下细胞密度较高。分化差的肝母细胞瘤其组织结构呈层状或巢状分布,细胞形态较原始,分化不完全或完全未分化。胞质缺乏,核分裂象多见。而混合型肝母细胞瘤则可发现上皮来源和中胚层来源的肝母细胞混合存在。长期存活的肝母细胞瘤患儿中,最常见的传统型以胎儿细胞型为主。传统型肝母细胞瘤占肝母细胞瘤的60%左右,但却占全部可被切除肝细胞肿瘤的85%。几乎没有分化差型肝母细胞瘤患儿能长期存活。国外有学者报道显示胎儿型肝母细胞瘤与其他类型肝母细胞瘤的Ⅰ期患者预后明显不同(3年生存率79%∶59%,P=0.011)。但不是所有的报告都支持分型对预后的判断作用,例如2002年日本儿童肝肿瘤治疗组的结果就否定了分型的预后价值。
肝细胞癌(hepatocallular carcinoma,HCC)是儿童期肝脏第二位常见的原发性恶性肿瘤,约占儿童期肝脏恶性肿瘤的1/4~1/3。儿童期肝细胞癌出现的中位年龄为10~12岁,年龄在5岁以内的儿童发生肝细胞癌的机会较小,大约25%的肝细胞癌患儿伴有肝硬化。肝硬化的原因可能有:胆道梗阻,家族性胆汁淤积性肝硬化,Fanconi贫血,人血清中α1-抗胰蛋白酶缺乏和遗传性高酪氨酸血症。肝细胞癌的发生也可能与半身肥大、腹部静脉回流系统异常和口服避孕药有关,与乙肝病毒感染也有密切关系。另外,原发性肝癌中还有一类比较特殊的类型,该类肿瘤细胞呈多边形,形体较大,肿瘤细胞外周有胶原纤维形成的囊所包绕,故此型被称为纤维层型(fibrolamellar,FL)。该种病理类型与肝硬化关系不大,多见于年长儿中。通常认为这类肝癌较易切除,预后相对较好。
肝母细胞瘤和肝细胞癌约占儿童期原发性肝脏恶性肿瘤的75%~90%。恶性间皮瘤、未分化胚胎肉瘤、平滑肌肉瘤、血管肉瘤、胆管系统横纹肌肉瘤、肝窦状瘤激发的神经母细胞瘤、类癌和原发性肝和肝脾非霍奇金淋巴瘤也均有儿童期发病的报道。
肝脏良性肿瘤约占儿童期肝脏肿瘤的1/3左右,良性肿瘤可根据它们的起源细胞分型:中胚层来源(血管瘤、血管内皮瘤和血肿hematoma)或上皮来源(囊肿、局限性结节状增生、腺瘤)。
若肝脏或胆管肿瘤压迫或侵犯胆管系统产生堵塞,可引起血清肝酶或胆红素的升高。在影像学检查时,静脉肾盂造影能帮助鉴别肾源性肿瘤与腹腔内肿瘤。超声波检查有助于明确肝脏肿瘤的存在,并可了解病灶的性质(实质性或囊性),还可了解肾上腺和肾脏的情况,帮助排除来自这些器官的原发灶转移到肝脏的可能性,并可了解有无上腔静脉癌栓存在。多普勒B超可以帮助分析瘤周血管与肿瘤的关系。99mTc胶态硫扫描在了解肿瘤在肝内的部位和明确它的边界方面有一定价值。这是一种比较敏感的试验,但特异性不高。
CT、MRI可提供比较精确的肿瘤形态和有无多发灶的证据。在未增强的CT图像中,上皮型肝母细胞瘤呈低密度均质团块影。混合型肝母细胞瘤则呈密度不均一的块影。有时可存在瘤内钙化。注射造影剂后肿瘤边缘或中间隔可获增强。在磁共振图像上,上皮型肝母细胞瘤在T1加权像为均质低信号,T2加权为高信号。混合型则如CT表现一样,呈异质块影。如瘤内有出血灶,T1、T2加权均为高信号。肝细胞癌在CT中表现为单一或多发结节性病灶,有时可见钙化灶。肿瘤边缘可被造影剂强化。在磁共振图像中,T1加权为等信号或高信号,T2加权常可观察到多种信号混杂的“马赛克”表现,多由肿瘤坏死、出血、纤维间隔形成、脂肪化引起。
外科医生需要血管造影,以便了解左右肝动脉的起源和分布。常规的胸部X线片和胸部CT可明确是否有肺部转移。有10%~20%的肝母细胞瘤,30%的肝细胞癌患儿初诊时已有肺转移。
血清甲胎球蛋白(AFP)的测定能帮助诊断原发性肝脏恶性肿瘤。AFP可由胎肝合成,故孕妇血清中AFP也可升高。正常新生儿血清中AFP水平较高,出生后1个月恢复正常。2岁后正常儿童血清已测不出AFP。大约2/3的肝母细胞瘤和肝细胞癌患儿的AFP水平异常。但临床医生应该谨慎评价AFP值的临床意义,因为有时肝母细胞瘤或肝细胞癌患儿AFP可以正常,而有些良性肝血管瘤AFP也可能轻度升高。AFP没有升高的肝母细胞瘤预后往往较差,其组织学类型常为未分化型,对治疗不敏感。而对于AFP升高的肝母细胞瘤,治疗后AFP水平的监测有助于治疗后的随访。当肝母细胞瘤或肝细胞癌完全切除,大约在术后2个月AFP恢复至正常水平。手术后如AFP没有降低者提示可能存在肿瘤残留,但也可能是正常肝脏再生的反应。故单用AFP指标不能确诊复发,需结合影像学资料加以证实。在随访期间,AFP的升高通常预示局部肿瘤的复发或转移。
(二)分期
目前,常用的原发肝脏恶性肿瘤的分期有CCSG分期法(表22-12)与TNM分期系统,这两种分期方法都是根据肿瘤是否能被切除来划分的。不论使用哪种分期系统,临床医生都须注意:①分期系统是用于初诊,故诱导化疗后原先的分期就失去指导意义了;②外科医生对能否切除的判断具有很大的主观性,不同医师间差异较大。胆管癌的分期目前尚不一致。
表22-12 原发性肝恶性肿瘤的CCSG分期法
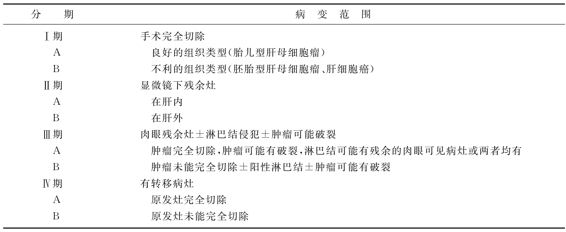
德国肝母细胞癌协作组HB 89-94报告总结了该病的六大预后因素:
(1)存在转移灶。
(2)肝外或肝内的血管侵犯。
(3)TNM分期(肿瘤、淋巴结、转移)。
(4)初始AFP水平>1×106 ng/ml。
(5)肝内多灶性病变的同时侵犯肝左右叶。
(6)细胞分化较差。
三、治疗的选择
(一)外科治疗
局限性的肝母细胞瘤或肝细胞癌如能完全切除,则有可能得到治愈。即使手术不能获得完全切除,术后辅助合理化疗,也可使残余部分得到肃清,达到痊愈。将近1/2或1/3的肝母细胞瘤,初诊时病程尚允许进行手术切除。经新辅助化疗后约90%可手术。30%的肝细胞癌在确诊时,已有多个病灶或有巨大肿块而不能完全切除,仅30%~50%的肝细胞癌确诊时可以手术,而很多病例由于多灶性肿块或巨块性肿瘤而失去了根治性手术的可能。
许多病例手术前都须进行辅助化疗。这需要先解决一个如何确诊的问题,即是在化疗前行病理活检明确诊断,还是仅根据临床表现和影像学资料、AFP水平以及血小板增生等证据直接实施治疗?如果采取后者,将有4%的误诊率,其鉴别诊断主要是血管内皮瘤、血管肉瘤、神经母细胞瘤、生殖细胞瘤。大多数的临床医师倾向于根据活检结果指导治疗。经典的活检是开腹肝脏楔形活检,也有推荐CT或B超引导下穿刺活检。但由于肝源性肿瘤质脆、易出血,该方法受到了不少质疑。
肝母细胞瘤的外科治疗目前存在两个治疗策略。美国国内协作组(American Intergroup Studies)倾向于先手术后辅助化疗,除非病例明显没有手术指征。而国际儿童肿瘤协会(International Society of Pediatric Oncology,SIOP)则主张遵循活检→术前化疗→手术的次序。术前辅助化疗能使绝大部分的肝母细胞瘤、很大部分的肝细胞癌病例有效地缩小肿瘤负荷。许多不能手术的病例化疗后都降低了分期,成功接受了手术。很多外科医生也相信化疗后肿瘤会形成不易破裂的包膜,使手术更容易实施。对于那些化疗疗效不佳的病例,继以放疗有时能进一步减少肿瘤负荷,增加肿瘤的切除率。
为了良好地暴露视野,手术常采取大切口。单纯肿瘤切除很少能够实现,通常要进行肝叶切除或扩大的肝叶切除,围手术期死亡率以往报道为18%~33%,目前在一些治疗中心已降至5%~10%。手术并发症包括大出血、胆瘘、胸腔积液、下腔静脉破裂、心脏骤停、癫大发作、膈下脓肿等。外科手术技术的改进如血管再建、超声波吸引、在血管排空情况下行肝叶切除以及麻醉的改进、血制品的代用和重症监护等已使得手术和围手术期的死亡率明显降低。
对于临床Ⅳ期存在肺转移灶的病例,如果术前化疗有效,肝部肿瘤可切除,则肺部的转移灶根据情况也可尝试以根治性手术切除。而对于初诊时没有转移,治疗后出现单个肺转移结节的,手术切除转移灶已能提高生存率。Feusner等报道了6例出现肺转移的Ⅰ期肝母细胞瘤患者,3例同时出现脑、骨或腹部转移者都死于转移。其余3例仅有肺部转移的病例,在转移灶切除加化疗后获得了长期生存(少于5年)。
对某些难以切除的原发性肝脏恶性肿瘤,有些研究单位尝试应用全肝切除加肝移植术。总的来说,对于肝母细胞瘤,肝移植可获得相对较好的治疗结果,而肝细胞癌的疗效差些。
肝内多灶性的病变,处理起来比较棘手。如果经化疗后肿瘤反应佳,则病灶消退。外科医生常常面临两难选择:是认为肿瘤已经杀灭而行部分肝切除,或者是假定仍有亚临床病灶存活而行全肝切除+肝移植?目前对这个问题还没有现成的答案。
(二)放疗
作为治疗肝母细胞瘤和肝细胞癌手段之一的放疗可用于术前或术后。术前放疗的目的是试图使肿瘤缩小,增加切除的可能性。但目前,大部分情况下术前辅助治疗手段首选化疗。如化疗后肿瘤退缩不理想,可以考虑辅助放疗。POG 8697试验报道了5例术前化疗后补充术前放疗的,结果有3例得以手术。
对肝脏肿瘤切除后有残留或切缘阳性的患儿,进行术后放疗能提高局控率。CCSG和POG报道了177例肝母细胞瘤和肝细胞癌的患儿,对有镜下残留的患儿(Ⅱ期)接受术后化疗和对肝脏肿瘤床45Gy术后放疗。在术前化疗后未能接受完全切除的患儿,在术后接受30Gy全肝照射。Ⅱ期患儿3年生存率为60%,Ⅲ期患儿的3年生存率为22%。Gustave-Roussy研究所给予肝肿瘤患儿术前化疗、手术切除,如果患儿有镜下残留或肉眼残留的,则再加术后放疗和术后化疗。对肝残留病灶给予25~45Gy的照射。9例患儿中的7例经随访22~98个月仍存活。2例死亡,1例死于局部复发,另1例死于局部复发和全身转移。目前还没有对于切缘镜下阳性的患者进行单纯采用术后放疗或术后化疗的疗效比较,但毫无疑问术后放疗是此类患者的可选治疗方案。
随着放疗技术的发展,新的放疗技术也可用于儿童肝肿瘤治疗,如适形放疗与调强放疗技术。详情可参见胰腺癌治疗章节。
(三)化疗
新辅助化疗的目的在于改善肝母细胞瘤和肝细胞癌的切除率,术后化疗可用于术后切缘阳性的病例。当存在转移灶时,化疗的目的是延长患儿的生存期。有作者报道24例肝母细胞瘤手术切除肿瘤后,接受辅助化疗(VCR、ADR、CTX、5-Fu),获得83%的无复发生存率。未接受术后化疗的患儿比接受术后辅助化疗的患儿更易发生远处转移。在27例有术后残留病灶的患儿,化疗的有效率达44%。
ADR和CDDP是公认对肝母细胞瘤最有效的药物,文献报道ADR和CDDP对原发性肝母细胞瘤的有效率达70%~90%。卡铂和表柔比星目前常用来代替ADR和CDDP。CCSG首用连续灌注ADR和CDDP来治疗不能切除的肝母细胞瘤,化疗后26例中有25例肿瘤化疗敏感的肝脏肿瘤被切除了。CCSG-POG研究组给予术后Ⅰ、Ⅱ期的肝母细胞瘤和肝细胞癌患儿化疗,药物为长春新碱、环磷酰胺、多柔比星(阿霉素)和氟尿嘧啶,对Ⅲ、Ⅳ期患儿另加博来霉素和顺铂。
国内华东医院王国民等曾进行肝动脉灌注药物和栓塞加全肝移动条放射相结合治疗肝细胞癌也得到较好的疗效。不过大部分为成人病例,但也可作为一种方法推荐给同道。
四、放疗的实施
如果放疗作为剖腹探查术前或术后残余灶的治疗时,肝脏肿瘤体积的大小始终是非常重要的。同时,放疗计划需考虑尽量保护正常肝组织。为此,放疗医生必须十分细心地研究影像诊断资料(CT、MRI、肝血管造影片)和任何有用的手术记录、病理报告。根据影像学资料确定肿瘤体积(GTV)后,在各个方向上应增加1~2cm的边界(CTV)。考虑到呼吸运动对肝脏位置的影响,上下方向应再增加0.5~2.5cm的边界(PTV)。呼吸门控系统可以减少这种运动带来的误差,从而可以相应减少PTV的范围。如条件允许,尽量使用适形或调强放疗技术改善剂量分布,具体的定位、固定以及设野、治疗计划的设计等可参考有关专著。大部分病例,平行的前后野照射是可行的。有时也可使用平行的左前斜野和(或)右后斜野,并与化疗合用,作术前综合治疗。如果肝脏的相当部分被保护的话,给予50~60Gy肿瘤量也是可能的。术后辅助放疗的剂量,对于光镜下残存的肿瘤细胞,可给予45Gy,残存可见肿瘤的则以50~60Gy为宜,但必须注意正常肝脏的耐受量。如果是术后残余病灶,25~45Gy给予局部治疗是可行的;如果残余病灶较大,则给35~45Gy。全肝放疗通常采取前后两野放疗,剂量计算是以肝的中心平面为标准,剂量不能超过肝脏放射的耐受量,对于进展期肝母细胞瘤和肝细胞癌的姑息治疗,剂量通常是20~25Gy/2~2.5周。肝母细胞瘤或肝细胞癌转移灶的治疗,通常根据需要和周围要害器官的情况给予姑息剂量。
目前,对肝脏恶性肿瘤的放疗已有了不少新方法与新技术,例如:术中放疗、局部加热疗法配合动脉内90Ir微珠照射、131I抗铁蛋白与化疗同时进行。腔内192Ir单独或与微波加热疗法同时进行来治疗胆管阻塞也有人在试用。(https://www.xing528.com)
五、放疗的并发症
放射性肝病(radiation-induced liver disease,RILD)以前也称为放射性肝炎,该并发症可在肝脏接受一定放射剂量后数周或数月内发生。其病理学特征是肝小叶中央充血、肝窦充血、肝萎缩和局灶性坏死。患儿放疗前接受过肝脏手术、有慢性肝炎病毒感染史、肝硬化等为其诱发因素。实验室改变主要表现为碱性磷酸酶、转氨酶升高。
放射性肝病的发生与放疗剂量和受照肝体积相关。Cheng等分析了成人肝细胞癌放射治疗的DVH数据,发生放射性肝病的病例平均肝脏受照剂量高于没有发生不良反应的病例(25.0∶19.7Gy,P=0.02),且接受剂量超过30Gy的肝体积百分比也较高(42%∶33%,P=0.05)。对束流调强放疗的剂量分布研究显示该技术与常规三维适形放疗相比,减少了脊髓、肾脏、胃的受照剂量。但由于为实现理想的剂量分布,调强放疗需使用更多的照射野,结果肝脏的受量和受照体积反而较经典适形放疗要大(29.2∶25.0Gy,P=0.009)。这种剂量分布的改变对临床结果的影响目前还不甚确切。
六、结果
早期(Ⅰ~Ⅱ期)肝母细胞瘤目前长期生存率达到了70%~100%,进展期(Ⅲ~Ⅳ期)生存率为20%~60%。在CCG-8881临床报告中,早期能完全切除的肝母细胞瘤,接受联合化疗后,长期生存率达到了70%。治疗后复发的肿瘤患者,仅29%存活超过3年。至于肝细胞癌,目前早期可获得近50%的长期生存率,晚期生存率为10%~20%。
(王国民)
参考文献
1.陈建雯,周曙光.儿童神经母细胞瘤的治疗与预后.山东医药,2005,45:31~32
2.李凯.神经母细胞瘤的治疗进展.中华小儿外科杂志,2002,23:169
3.高解春,周菊玲,陈莲.神经母细胞瘤组织分型的生物特征与临床意义.中华小儿外科杂志,2002,23:9~10
4.王国民主编.儿童肿瘤放射治疗学.上海:上海医科大学出版社,2000,110~190
5.高解春,王耀平主编.现代小儿肿瘤学.上海:上海医科大学出版社,2003,508~537
6.Maris JM,Matthay KK.Melecular biology of neuroblastoma.J Clin Oncol,1999,17:2264~2279
7.Attiyeh EF,London WB,Mosse YP,et al.Chromosome 1p and 11q deletions and outcome in neuroblastoma.N Engl J Med,2005,353(21):2215~2217
8.Plantz D,Mohapatra G,Matthay K,et al.Gain of the chromosome 17is the most frequent abnormality detected in neuroblastoma by CGH.Am J Pathol,1997,150:1
9.Shimada H,Ambros IM,Dehner LP,et al.Terminology and morphologic criteria of neuroblastic tumors:recommendations by the International Neuroblastoma Pathology Committee.Cancer,1999,86(2):349~363
10.Shimada H,Ambros IM,Dehner LP,et al.The international neuroblastoma pathology classification(the Shimada System).Cancer,1999,86(2):364~372
11.Abe K,Sasaki M,Kuwabara Y.Extraosseous accumulation of 99mTc-MDP to radiation nephropathy,mimicking recurrent neuroblastoma.Ann Nucl Med,2005,19(1):35~40
12.Woods WG,Tuchman MG,Robinson LL,et al.Apoputation based study of the usefulness of screening for neuroblastoma.Lancet,1996,348:1682~1687
13.Balwierz W.Management strategy in neuroblastoma Przegl Lek.2004,61Suppl 2:3~8
14.Matthay KK,Atkinson JB,Sttam DO,et al.Pattern of relapse after autologous purged bone marrow transplantation for neuroblastoma:A Children’s Cancer Group pilot study.J Clin Uncol,1993,11:2226~2233
15.McCluskey AG,Boyd M,Gaze MN,et al.131I-MIBG and topotecan:a rationale for combination therapy for neuroblastoma.Cancer Lett,2005,228(1-2):221~227
16.Fuss M,Salter BJ,Cavanaugh SX.Daily ultrasound-based image-guided targeting for radiotherapy of upper abdominal malignancies.Int J Radiat Oncol Biol Phys,2004,59(4):1245~1256
17.Grundy P,Coppes M.An overview of the clinical and molecular genetics of Wilm’s tumor.Med Petiatr Oncol,1996,27:394~397
18.Grundy PE,Breslow NE,Li S,et al.Loss of heterozygosity for chromosomes 1p and 16q is an adverse prognostic factor in favorable-histology Wilm’s tumor:a report from the National Wilm’s Tumor Study Group.J Clin Oncol,2005,23(29):7312~7321
19.Beckwith JB.New developments in the pathology of Wilm’s tumor.Cancer Invest,1997,15:153~162
20.Kalapurakal JA,Dome JS,Perlman EJ,et al.Management of Wilm’s tumor:current practice and future goals.Lancet Oncol,2004,5:37~46
21.Blakely ML,Ritchey ML.Controversies in the management of Wilm’s tumor.Semin Pediatr Surg,2001,10:127~131
22.Kalapurakal JA,Li SM,Breslow NE,et al.Influence of radiation therapy delay on abdominal tumor recurrence in patients with favorable histology Wilm’s tumor treated on NWTS-3and NWTS-4:a report from the National Wilm’s Tumor Study Group.Int J Radiat Oncol Biol Phys,2003,57(2):495~499
23.Meisel JA,Guthrie KA,Breslow NE,et al.Significance and management of computed tomography detected pulmonary nodules:areportfrom the National Wilms Tumor Study Group.Int J Radiat Oncol Biol Phys,1999,44:579~585
24.Kalapurakal JA,Peterson S,Peabody EM,et al.Pregnancy outcomes after abdominal irradiation that included or excluded the pelvis in childhood Wilm’s tumor survivors:a report from the National Wilm’s Tumor Study.Int J Radiat Oncol Biol Phys,2004,58(5):1364~1368
25.Spreafico F,Bellani FF.Wilm’s tumor:past,present and(possibly)future.Expert Rev Anticancer Ther,2006,6:249~258
26.Reinhard H,Semler O,Burger D,et al.Results of the SIOP 93-01/GPOH trial and study for the treatment of patients with unilateral nonmetastatic Wilm’s tumor.Clin Padiatr,2004,216(3):132~140
27.Santana VM,Zamboni WC,Kirstein MN,et al.A pilot study of protracted topotecan dosing using a pharmacokinetically guided dosing approach in children with solid tumors.Clin Cancer Res,2003,9:633~640
28.Frischer JS,Huang J,Serur A,et al.Effects of potent VEGF blockade on experimental Wilm’s tumor and its persisting vasculature.Int J Oncol,2004,25:549~553
29.Ablin a,Kraila M,Hass J,et al.Hematoblastoma and hematocellular carcinoma in Children:a report from the Children’s cancer Study Group(CCG)and the Pediatric Oncology Group(POG).Med Pediatr Oncol,1988,16:417~420
30.Coughlin CT,Wang TZ,Ryan TP,et al.Interstitial microwave-inducted hyperthermia and Iridium brachytherapy for the treatment of obstructing billiary carcinoma.Int J Hyperthermia,1992,8:157~171
31.Gauthier F,Valarer J,Thai BL,et al.Hepatoblastoma and hepatocarcinoma in children:analysis of a series of 29cases.J Pediatr Suyg,1986,21:424~429
32.Greenberg M,Filler RM,Hepatic tumor.In:Pizzo PA,Poplack DG,eds.Principles and practice of
pediatric Oncology.2th ed.Philadephia:JB Lipincott,1993,697~711
33.Habrand J-L,Nehme D,Kalifa C,et al.Is there a place for radiation therapy in management of hepatoblastoma and hepatocellular in children.Int J radiat Oncol Biol Phys,1992,23:525~531
34.Herfarth KK,Debus J,Lohr F,et al.Extracranial stereotactic radiation therapy:Set-up accuracy of patients treated for liver metastases.Int J Radiat Oncol Biol Phys,2000,46:329~336
35.Wag GM,Shen WM,Song MF,et al.Results of combined treatment with transcatheter hepatic arterial chemoembolization and whole-liver irradiation with the moving strip technique in unresectable hepatocellular carcinoma.Int J Clin Oncol,2000,5:380~385
36.Chen JCH,Wu JK,Huang CM,et al.Radiation-induced liver disease after three-dimensional conformal radiotherapy for patients with hepatocellular carcinoma:dosimetric analysis and implication.Int J Radiat Oncol Biol Phys,2002,54:156~162
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




