第二节 Wilm瘤
一、概述
儿童肾母细胞瘤(Wilm’s tumor)来源于后肾胚基。1828年Ebenezer Gairdner首先描述了1例3岁死于左肾肿瘤的女孩,该肿瘤瘤体有5 000g。后来Max Wilm(1867~1918年)在他的一本有关混合肿瘤的专著Die Mischgeschwuelste中详细描述了几例此种肿瘤案例,遂以他的名字命名此种肿瘤。Wilm瘤是最常见的儿童肿瘤。美国国家肾母细胞瘤研究组(National Wilm’s Tumor Study Group,NWTS)及SIOP两大国际组织20世纪60年代末70年代初起进行了多个肾母细胞瘤的随机分组临床研究,为其诊断、分期和治疗提出了不少重要建议,使Wilm瘤生存率由20世纪30年代的30%左右提高到目前的85%以上,治疗方法已达到相当成熟的水平。
二、流行病学
Wilm瘤是最常见的儿童肿瘤,占15岁以下小儿恶性泌尿生殖肿瘤的80%以上,约占小儿实体瘤的8%。统计国内6所儿科医院2 133例恶性实体瘤中,有Wilm瘤503例,Wilm瘤占发病总数的24%,90%病例诊断时的年龄<7岁,罕见于成人及新生儿。诊断时平均年龄是15个月,4岁时发病率最高。多为单个孤立性病灶,单肾多个病灶占12%,双肾病灶占7%,男女之比为1∶0.9。双肾病灶男女之比为1∶0.6。
三、分子生物学
在诱发Wilm瘤的各种基因变化中,研究最多的是WT1,WT1是在染色体11p13上的抑制基因发生突变。WT1与儿童WANG综合征的发生有关。对散发的Wilm瘤的患儿研究显示发生WT1基因突变占5%~10%。因此,尽管WT1已证实是Wilm瘤的抑制基因,但仅是Wilm瘤发病的一种原因。然而,伴有生殖泌尿系统畸形的Wilm瘤,80%有WT1突变。WT1突变者还可存在于Denys-Drash综合征等先天性疾病中。另一抑癌基因称为WT2也被发现。其定位于11号染色体的短臂上(15p11),该染色体突变也可引发Beckwith-Wiedemann综合征。
近年的研究显示,肾母细胞瘤的抑癌基因较多,除了有自身特有的WT1基因之外,尚有p53、Rb等基因。p16(多种肿瘤抑制基因)抑癌基因也有表达,p16阳性者预后好于阴性者。NWTS-5的研究报告显示,对FH型Wilm瘤,如果发生染色体1p或16q肿瘤特异性杂合体丢失(tumor-specific loss of heterozygosity,LOH),患儿复发和死亡的危险性显著增加。
四、病理分型
Wilm瘤大体标本为边界清晰、有包膜的实体瘤。可发生于肾的任何部位。肿瘤剖面呈鱼肉样、灰白色,常有出血及坏死,呈黄色及棕色,可有囊腔形成。肿瘤破坏并压迫肾组织使肾盂、肾盏变形。少见情况是肿瘤侵入肾盂并向输尿管发展引起血尿及梗阻。肿瘤突破包膜后,可广泛浸润周围组织及器官并可经淋巴转移至肾门及主动脉旁淋巴结,也可形成瘤栓沿肾静脉伸入下腔静脉,甚至右心房。血行转移可至全身各部位,以肺转移最为常见。
传统上认为Wilm瘤是由三类胚胎源性肿瘤细胞构成,此三类分别为胚基、上皮以及基质来源。结节性肾胚胎残余被认为是Wilm瘤的前期病变,此病表现为肾包膜下可见的小结节,内容为良性胚胎残余。肾原性残余与两侧Wilm瘤、早发性病变及单侧多灶性病变有关。总的来说,此类残余往往预后较好。
近年来大多数学者认为原来在病理学分型上属于预后不良的肾透明细胞肉瘤(clear cell sarcoma of kidney,CCSK)和横纹肌肉瘤样肾肿瘤(malignant rhabdoid tumor of kidney,MRTK)与肾母细胞瘤不同,它们不是来源于后肾胚基。另外,还发现这两类肿瘤的预后也明显差于肾母细胞瘤。因此,目前在病理学分型上不包括以上两种肿瘤。
组织病理学研究提示Wilm瘤内出现未分化细胞与其组织形态学和预后有密切相关,如果出现未分化(anaplasia)细胞意味着分期晚、对化疗抗拒、预后差和需要强烈的肿瘤治疗方案,更多发生于3岁以后的儿童。未分化Wilm瘤病理特征为:①增大的瘤细胞核,往往较邻近同源细胞核至少大3倍;②染色质增多增粗;③多级或多倍体的异常有丝分裂。未分化可分为局灶性未分化和弥漫性未分化。弥漫性未分化为肾外其他部位转移病灶出现未分化细胞,或随机活检的标本中发现未分化细胞,或未分化细胞未被肿瘤细胞包围,其预后比局灶性未分化更差。根据组织形态分为预后良好型(favorable history,FH)和预后不良型(unfavorable history,UH)。预后不良型指仅存在未分化细胞的肾母细胞瘤,包括局灶性未分化和弥漫性未分化。预后良好型是指胚芽型、间叶型、上皮型、混合型。
五、临床表现
Wilm瘤的临床表现主要为腹块(83%)、发热(23%)、血尿(21%)。肿瘤局部浸润、自发性内出血或瘤体破裂可引起腹痛(37%)。临床有腹痛症状者5年生存率较差。腹部肿块是最常见的症状,约76%患儿均以腹部肿块或腹胀就诊。由于肿块在较小的时候不影响患儿营养及健康情况,也无其他症状,故多由家长在给小儿沐浴或更衣时偶然发现,但又不被家长重视而延误治疗。肿块位于上腹季肋部一侧,表面平滑,中等硬度,无压痛,早期可稍具活动性,迅速增大后,少数病例可超越中线。此时虽无远距离转移,但小儿受巨大肿瘤压迫,可有气促、食欲不振、消瘦、烦躁不安现象。肉眼血尿少见,但镜下血尿可高达21%。高血压可见于25%~63%的患儿,一般在肿瘤切除后,血压恢复正常。食欲不振、体重下降、恶心、呕吐是疾病晚期的信号。肿瘤也可产生红细胞生长素导致红细胞增多症。极少数Wilm瘤自发破溃,临床上与急腹症表现相似。文献报道有腹痛症状者预后较差。不常见的症状和体征有高血压、精索静脉曲张、疝气、睾丸肿大、充血性心力衰竭、低血糖、库兴综合征、脑积水、胸膜积液、急腹症等。
六、诊断与分期
(一)诊断
腹痛的类型、治疗史、家族史均是需了解的重要内容。体格检查是确定腹部情况和了解有无相关先天性疾患的重要手段。
了解病情累及程度的常用检查方法是静脉肾盂造影(IVP)。IVP常显示患侧肾不显影,如肾内肿瘤则表现为患侧肾盂肾盏被挤压、移位、拉长变形或破坏。目前IVP已基本由腹部超声检查所代替。超声检查可测量肿物大小,分辨囊、实性,了解有无腹膜后肿大淋巴结,还可检出肾静脉、下腔静脉瘤栓及确定瘤栓范围以及对侧肾脏的状态。超声检查对区分肾内、外肿物亦有帮助。
腹部CT扫描已作为常规的检查手段,其用于评价:①肿瘤体积、肾功能状况及肾盂输尿管积水情况;②了解肿瘤边缘与肾脏、周围邻近组织的关系;③区域淋巴结及后腹膜淋巴结是否受累,了解肝脏是否有转移;④鉴别诊断,排除其他腹部占位性病变,如神经母细胞瘤、畸胎瘤或错构瘤等。
肺是Wilm瘤最好发的转移部位,应常规行胸部X线检查。目前多数治疗中心建议行胸部CT检查。放射性核素骨扫描可以了解有否骨转移,必要时可行脑部CT检查,以了解有否脑转移。
化验检查须做血、尿常规,血尿素氮及肌酐、肝脏酶的测定。如疑为神经母细胞瘤,应查尿儿茶酚胺代谢产物和骨髓穿刺涂片。如患儿有高血压则肾素水平可能上升,也有报道有红细胞增多者。如Wilm瘤并发先天性畸形,则应查染色体。
(二)分期
Wilm瘤最早的分期系统始于1973年,由Cassady根据Garcia等的综合分析而形成的各种预后因素。目前使用最广泛的NWTS-5分级系统脱胎于旧的NWTS分级系统,其详细分期见表22-7。
表22-7 NWTS-5分期

七、治疗
(一)治疗原则
诊断明确后尽早手术。有90%~95%的病例可行手术治疗,不能手术的病例主要是由于肿瘤直接侵犯肝脏和(或)后腹膜组织。经腹腔手术时应检查对侧肾脏和肝脏,如有可疑肿瘤,须取活体组织检查。有血供障碍的瘤组织较软而脆性大,易于破溃,操作应轻柔,以免肿瘤被挤破(术中肿瘤破溃,局部复发机会较未破溃多1倍)。NWTS提出切除肾蒂或主动脉、腔静脉旁淋巴结,但并不改变预后,而仔细检查及选取淋巴结活检对肿瘤分期有用。如肾静脉内有瘤栓,须切开取出瘤栓,再结扎肾蒂,这并不意味着预后恶劣。在处理巨大肿瘤的肾蒂时须格外小心,以免误伤重要血管,如肿瘤侵及肠系膜根部、十二指肠、胰头部部位等。若完整切除肿瘤,将冒极大危险,否则应在可疑肿瘤残存部位放置银夹标记,以便将来术后放疗。根据手术确定的病期和组织病理学再确定是否需应用放疗和化疗方案。NWTS-Ⅴ推荐的Wilm瘤治疗方案如表22-8。
表22-8 NWTS-Ⅴ推荐的Wilm瘤的治疗方案(不包含CCSK和MRTK)

注:VCR:长春新碱;ADR:放射菌线D;ADM:多柔比星(阿霉素);Vp-16:依托泊苷(足叶乙苷)。
(二)放疗技术
1.放疗与手术间隔时间 对Wilm瘤术后需放疗的患者,手术与术后放疗所间隔的时间是影响预后的重要因素。术后何时给予放射较合适?NWTS-Ⅰ资料显示此类患儿应于手术后10d之内进行放疗,超过10d,局部复发和对侧肾转移的概率增大,尤其对于预后不良型的患儿。其报道29例放疗晚于术后10d的病例,3例(10%)发生局部复发(P<0.01)。然而NWTS-Ⅰ研究的病例数较少,根据NWTS-Ⅲ及NWTS-Ⅳ的治疗方案入组的1 226个病例分析,放疗晚于术后10d,无显著影响腹部肿瘤的复发率。
放疗的重要性突出体现在有效地提高了肿瘤的局控率,减少了局部复发。而目前对于局部复发的病例,治疗效果相对较差。一般复发后采取积极治疗者,第2次无病生存率为0%~15%。相对来说,经过合适的术后放疗,预后良好的Wilm瘤腹部复发率能控制在0%~4%。
2.放射布野 照射野应以包括整个“瘤床”为目的,这包括术前的整个瘤范围和同侧肾脏。故确定临床肿瘤体积需要有完整的术前影像资料,如CT、B超、MRI等,当然,还需有尽量详细的手术资料。一般的,如果肿瘤位于肾下极,临床肿瘤体积上界应置于肾上极,下界包括肿瘤下极。肿瘤位于右肾时部分肝脏可能包括在照射野内。照射野内界一般过中线包括整个脊柱和整个主动脉旁淋巴结,但需注意保护对侧肾脏,勿使其包括在照射野内。内界如此设置是为了防止椎体受照不均匀而导致生长畸形,其二也为防止淋巴结的转移。照射野外界要求到达患侧腹壁边缘。
对于在术前或术中发生肿瘤破裂、腹膜种植、巨大腹块的患者,需行全腹腔照射。照射野上至膈肌下至闭孔下端,应注意屏蔽髋臼和股骨头。但需注意如果为减少放射范围而遮挡对侧盆腔所导致的腹部复发率上升。进行全肺照射需仔细设计照射野,确保两侧肺上极和下叶后基底段均包括在照射野中。一般此野上界可达锁骨上,下界可达L1。两侧肩关节加挡铅保护,同时还需注意保护对侧肾脏。胸部X线上发现有肺转移结节的进行全肺照射8次,总剂量12Gy,4年无复发生存和总生存在70%以上。
有时临床上可能需要同时进行全肺照射和腹部照射,例如未分化型Wilm瘤同时伴肺转移的病例。这些病例有的可用一个大野包括这两个部分,待剂量达12Gy后缩野照腹腔。但多数病例须分野照射,此时须注意合理设置两野的间隙,以减少肝组织的受量。
3.放射剂量 NWTS-Ⅲ将Ⅲ期术后患者随机分成两组,接受10Gy和20Gy的照射,这其中也包括一部分有局部残留病灶增加10Gy照射的病例。结果显示两组的生存率和复发率都没有差别。故推荐放射剂量为10Gy。目前,NWTS-Ⅳ推荐对于残留病灶>3cm者将剂量由10.8Gy增加至21.6Gy(局部应增加放疗10Gy)。但SIOP研究显示由于低剂量照射出现的野内复发概率较高,考虑到小儿正常组织的耐受性,提出治疗剂量随年龄递增模型:<12个月,12~18Gy;13~18个月,18~24Gy;19~30个月,24~30Gy;31~40个月,30~35Gy;≥41个月,35~40Gy。表22-9、表22-10列出的两个儿童Wilm瘤的研究组NWTS和SIOP(International Society of Pediatric Oncology)具体的放疗原则。
根据笔者的经验如果是进行局部野照射的,可采用三维适形或调强放疗,设野可根据CT定位,以及参照术中留下的银夹定位,也可以在大野或全腹照射后作为缩野加量照射。
放疗与化疗药物多柔比星(ADM)、长春新碱(VCR)、放线菌D(ADR)、环磷酰胺(CTX)的联合使用显著降低了腹部复发率,在治疗剂量范围内此型肿瘤未显示出明确的剂量效应。
表22-9 NWTS-Ⅴ推荐的Wilm瘤的放疗剂量(总量/分次)

表22-10 SIOP 2001推荐的Wilm瘤的放疗方针
 (https://www.xing528.com)
(https://www.xing528.com)
(三)化疗
化疗是Wilm瘤重要的治疗手段,应用化疗后,其无瘤生存率显著提高。1966年Farber报道应用手术和放疗联合ADM化疗方案治疗本病生存率为70%,远高于手术加放疗组的40%~50%。以后的报道如NWTS-Ⅰ提示ADM可减少Wilm’s瘤单个肺转移灶的发生率,进而提高总生存率。常用的化疗药物有VCR、ADM和ADR,疗效方案各家不一。
VCR:每周1.5mg/m2,以1mg溶于20ml生理盐水,静脉注射,共10周,以后每2周静脉注射1次,作为维持量。1岁以下除第1次药量外,其后减为半量。
ADM:每日15μg/kg,5d或每日12μg/kg,7d。将ADM 200μg于20ml生理盐水中,静脉注射。第1疗程与第2疗程间隔6周,以后每3个月1个疗程。
ADR:40~60mg/m2,分为2~3d静脉注射,间隔4周,可重复给药。<5岁小儿总量应低于300mg/m2,5~10岁总量可达400mg/m2,<2岁小儿须慎用。ADR对透明细胞肉瘤疗效显著。
(四)双侧Wilm瘤的治疗
双侧Wilm瘤发病率在4%~8%,2、5、10年生存率为83%、73%、70%。双侧Wilm瘤诊断时年龄较单侧者小,合并畸形及细胞基因缺陷机遇较单侧大10倍。应用现代影像技术及第1次手术时探查对侧肾脏可早期发现对侧肿瘤。
双侧Wilm瘤的治疗目的是最大限度地保留肾组织,保证肾功能正常,故治疗策略是手术和化疗交替。首次手术目的是明确双肾的肿瘤范围及性质,然后化疗,两次探查目的是了解化疗的疗效,有时还需第3次手术。如化疗加2次手术后肿瘤仍然有残留,可考虑行放疗,剂量12~16Gy。应用影像检查监测以选择适宜时间,再次手术探查。NWTS-Ⅲ建议经腹探查,如是预后好的组织结构(预后差的组织结构仅占12%),做双侧活检,包括淋巴结活检。如能保留患肾在2/3以上,也可做肿瘤切除活检而不是全肾切除。必须做双侧全肾切除及肾移植时,须在化疗药应用2年以后,以免肿瘤复发。Penn报道15例双侧Wilm瘤在停药1年以内做肾移植,7例肿瘤复发,另5例在化疗2年后做肾移植无1例出现肿瘤复发。经上述诊断及治疗手段,在NWTS中同期诊断的存活率可达87%,不同期诊断的则降为40%。由于双侧Wilm瘤组织性质多不一样,故须双侧分别送病理检查。
过去,对于CT检查阳性而胸片正常的病例,治疗原则还存在争议。NWTS-Ⅲ报道了组织学有利类型、CT阳性而胸部平片正常的18例患儿,接受全肺照射后,4年无病生存率为88%;另9例相同情况而没有接受全肺照射的患儿,无病生存率也为88%,但病例数太少。目前美国国家Wilm瘤研究组(NWTS)对于此类CT阳性而胸片阴性的患者,只有在化疗无效后才使用全肺照射,或仅需密切随访。
八、治疗结果
Wilm瘤的4年生存率,预后良好组Ⅰ期为97%,Ⅱ期为92%,Ⅲ期为76%,Ⅳ期为82%,预后不良组,Ⅰ~Ⅲ期为68%,Ⅳ期为55%。预后除了与肿瘤组织学类型相关外,其他相关因素还有年龄、淋巴结转移以及腹部原发病灶的生长程度。
初治后复发病例多于确诊后1年内发生,约占75%。确诊2年后复发的病例不到3%。局部复发的部位和时间会影响疗效,独立性肺转移的缓解率要高于肝或其他血行性转移。有部分脑转移或肝转移患儿长期生存的报道。复发的时间对预后的影响也很重要,12个月后复发病例的缓解率要明显好于12个月前快速复发的病例。
一个有意思的现象是第2次治疗的有效率与第1次治疗强度成反比。NWTS的实验数据显示对于高危组治疗方案更积极,与此同时此组复发再治疗的控制率相对较低。对复发再治疗的无瘤生存率,NWTS-Ⅰ组为51%,NWTS-Ⅱ组为51%,NWTS-Ⅲ组为34%。
九、治疗的并发症
常见的治疗反应有急性血液系统、呼吸系统、心脏及肝脏的毒性反应,但只有极少部分发生致死性反应。NWTS-Ⅲ报道显示根据不同的给药方案,给予患儿6周治疗,严重骨髓反应的发生率为6%~64%。NWTS组中约有15%的死亡患儿,死因是治疗的毒性反应或感染,由此治疗相应死亡率为1%。放疗并发症在NWTS-Ⅰ组为7.2%,NWTS-Ⅱ组为7.6%,这包括肝毒性(肝功能异常、血小板下降、出血倾向、肝衰竭),放疗对健侧肾的损伤而导致的有:肾毒性(血BUN上升、血压升高),呼吸系统(间质性肺炎)及心脏毒性(心包炎、心电图改变)。放疗患儿中有13%发生肺炎,可能与水痘病毒、卡氏肺孢子菌或其他未知因素有关。当治疗范围包括右腹部或全腹,肝脏毒性的发生率要高于左侧。放疗与ADM或ADR联合可诱发心脏毒性反应。
化疗所致毒性反应多发生于1岁以内的婴儿,可有严重的骨髓抑制、肺毒性及肝毒性。NWTS后期降低了治疗剂量,有效地减少了此类反应的发生,同时没有影响疗效。在未接受放疗的NWTS-Ⅳ期严重肝功能损伤的发生率与ADM剂量有关:标准分割剂量下15μg/kg组,肝毒性反应发生率为2.8%,脉冲式给药45μg/kg组发生率为3.7%,60μg/kg组发生率为14.3%。
在Wilm瘤长期生存的患儿中,接受放疗的患儿脊柱侧突和肌肉骨系统异常率常高于未经放疗的患儿。腹部照射也常导致生长障碍,患儿治疗时年龄越小,反应越明显。接受ADR治疗的患儿也发生晚期心血管反应,而接受盆腔放疗的女性患儿成年后的生育功能肯定受影响。NWTS资料显示,114例曾行腹盆腔放疗的长期存活者,4例被记录怀孕,3例患者流产或死胎。10年累计第二原发瘤发生率为1%。
十、临床试验总结
SIOP和NWTS对改进Wilm瘤治疗方案,提高患儿疗效做出了巨大的贡献,使Wilm瘤生存率由30%左右提高到目前的85%以上,这是多学科合作、综合治疗的典范。简述如下。
SIOP最初的试验目的是了解手术前进行放疗和化疗的意义,以后治疗也扩展到术中发现有广泛侵犯的病例。采用这种治疗方法的优点是术前的治疗可以减少发生肿瘤破裂、种植和(或)不能切除的发生率,但同时也可能因误诊导致误治。另外,淋巴结的侵犯情况和组织病理学亚型也可能因术前的治疗而发生改变,而这些改变有可能导致对预后判断及后继治疗方案的偏差。
为了获得更准确、更充分的预后信息,NWTS治疗组没有采取术前治疗方案,这样就可以在不受治疗因素干扰的情况下评价原发肿瘤大小、未分化程度、淋巴结的侵犯情况。NWTS的优点是可以得到大量的治疗信息,并且避免了误诊、误治,而且能更好地设计治疗方案。
SIOP-Ⅰ期实验(1971~1974年)共442例,195例可供评价,且进行随机分组,203例未进行随机分组,但有随访资料。44例属误诊(10%,绝大多数为神经母细胞瘤和囊肿),62例年龄<1岁,54例有转移。对于随机组,实验目的主要是了解:①术前+术后原发肿瘤部位放疗是否优于单纯术后放疗?②术后单疗程ADM疗效是否等同于多疗程ADM?对于第一个问题,患儿被随机分成术前放疗+手术组和术后放疗组。根据SIOP分期,术前放疗组中的Ⅰ期患儿不接受放疗,Ⅱ、Ⅲ期接受15Gy的术前放疗。术后放疗组中Ⅰ期患儿接受剂量20Gy,Ⅱ、Ⅲ期的30Gy,个别巨块型Ⅳ期肿瘤还接受了加量治疗。72例接受术前放疗患儿中有3例(4%)发生术中肿瘤破裂,而未接受术前放疗的60例中有20例发生破裂(33%,P=0.001)。肿瘤未破裂者5年无复发生存率为51%,破裂者则为27%(P=0.01)。两者总生存率无差别(66%∶61%)。接受1个疗程ADM(每日15μg/kg,5d)和接受7个疗程的两个随机组,生存率没有差别。
SIOP-Ⅱ期实验(1974~1976年)为非随机实验,其中86例术前接受了20Gy的放疗和5d的AMD化疗,同期52例只接受手术治疗。结果术前治疗组肿瘤破裂率为5%,单纯手术组为20%,两者有显著差异(P<0.002 5)。单纯手术组的主要指征为较早的肿瘤。
SIOP-Ⅲ期实验(1977~1979年)目的主要是了解术前应用ADM、VCR联合化疗组与术前放疗+ADM组是否有相同疗效。联合化疗组术后放疗剂量为30Gy,术前放疗+ADM组术后放疗剂量为15Gy,所有患儿均接受术后VCR和ADM维持治疗。结果显示两组在肿瘤破裂率、3年无复发生存率方面没有显著性差异。
SIOP 93-01/GPOH实验讨论的是术前化疗1个疗程与3个疗程的疗效是否相当。结果显示Ⅰ期无远处转移的Wilm瘤有极好预后,2组的5年生存率分别为90%、91%。局灶性未分化癌较弥漫性未分化癌有较好的预后,可将此类型患者归类到中危组中。
NWTS-Ⅰ(1969~1974年)的研究目的主要是:①了解Ⅰ期患儿是否需要术后放疗?②对于Ⅱ期和Ⅲ期患儿,单独应用VCR或ADM是否能得到两药联合使用相同的疗效?③术前给予Ⅳ期患儿VCR是否有效?实验方案如图22-1,结果见表22-11。实验结果显示Ⅰ期患儿无须放疗,对于Ⅱ期、Ⅲ期患儿联合化疗疗效优于单药化疗,而术前VCR对Ⅳ期患儿未观察到治疗增益。
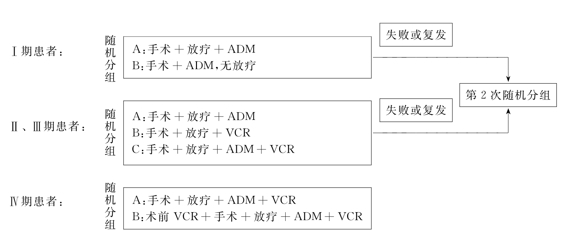
图22-1 NWTS-Ⅰ实验方案
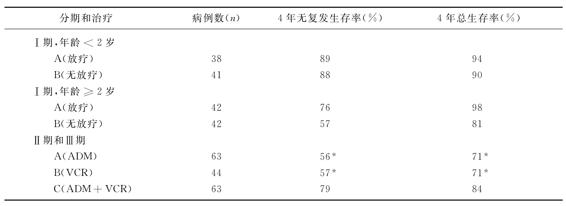
NWTS-Ⅰ同时也提供了另外一些重要的治疗信息,显示了预后不良组与预后良好组的区别:2年无复发生存率分别为29%、89%。肿瘤体积较大,淋巴结侵犯,年龄>2岁者,预后较差。在治疗年龄段中,10~40Gy治疗剂量之间没有观察到剂量-疗效相关效应。对于肿瘤细胞播散到腹腔,或细胞类型较差者也无须进行全腹腔放疗(WAI),此类患儿局限放疗即可。
NWTS-Ⅱ的主要研究目的是:①对于Ⅰ期患者中年龄较大者,能否用VCR和ADM代替放疗?②对于Ⅱ期和Ⅲ期患儿,在ADM+VCR方案中加入ADR是否有治疗价值?该实验中2年生存率预后不良组为54%,预后良好组为90%,淋巴结阳性组为54%,阴性组为85%。其中无须放疗也能得到满意的生存率,而Ⅱ、Ⅲ期预后良好组,加入ADR有明显的治疗增益,对Ⅱ、Ⅲ期预后不良和Ⅳ期预后良好组,也有一定效益。2年无复发生存率,Ⅰ期为88%,Ⅱ期为78%,Ⅲ期为70%,Ⅳ期为49%。
表22-11 NWTS-Ⅰ结果
(续表)

注:*P≤0.02;#2年生存率。
NWTS-Ⅲ的主要研究目的是:①对于Ⅰ期预后良好组患儿,化疗时程能否缩短?②对于Ⅴ期预后良好组患儿能否不进行放疗?③对于Ⅲ期预后良好组,放疗的最小有效剂量是多少?④对于预后良好的Ⅱ、Ⅲ期患儿使用有心脏毒性的ADR是否有益?⑤对于预后不良的Ⅰ~Ⅲ期和预后良好的Ⅳ期患儿增加使用CMP方案是否提高了生存率?治疗结果显示对于Ⅰ期预后良好的患儿,短疗程化疗疗效与长疗程化疗疗效相仿;而对于Ⅲ期预后良好的10Gy剂量组疗效与20Gy剂量组疗效相同;对于Ⅱ、Ⅲ期预后良好组,增加ADR并无益处,同样对于Ⅳ期预后良好组使用CMP方案并未观察到治疗增益。而对于有局部未分化型的病例,CMP方案似乎有益。
NWTS-Ⅳ(1986~1994)的实验目的主要是:①比较对于Ⅰ、Ⅱ期预后良好组和Ⅰ期未分化型患儿使用常规ADM+VCR与使用脉冲式高强度化疗的疗效差别。②对于Ⅲ~Ⅳ期预后良好组和Ⅰ~ⅣCCSK组常规ADM+VCR+ADR+放疗与使用脉冲式高强度ADM+VCR+ADR的疗效差别。对NWTS-4的资料进行回顾性分析,发现在诊断时年龄<24个月,肿瘤<550g的Ⅰ期FH患者,无治疗失败,故NWTS-V(1995)将治疗计划更加细化,以减少化疗、放疗的累积量和缩短疗程。其最终目的是达到小儿治疗的个体化,最大限度地减少正常组织损伤。治疗方案见表22-8。具体化疗用药如下:
(1)18周化疗方案 VCR 0.05mg P(kg/周)连续10周,然后第12、15、18周0.067mg P(kg/周),共3次,ACTD术后1周内及以后每3周1个疗程,共7个疗程,总量45μg/kg。
(2)24周化疗方案 VCR 0.05mg P(kg/周)连续10次,然后0.067mg P(kg/周),共5次。ACTD与ADR术后1周内开始,每3周用1种药,2种药交替,先用ACTD,45μg/(kg·次),静注,共5个疗程或5次。ADR共4个疗程,前2个疗程为1.5mg/kg,后2个疗程为1mg/kg。
(3)弥漫型方案 VCR+ACTD+ADR+CTX+VP-16化疗24周。
十一、展望
尽管Wilm瘤复发后再治疗的生存率得到了改善,至少40%的患儿带瘤生存。因此还需不断地努力来改变这部分患者的生存状态。目前研究的拓扑异构酶(topotecan)是一较有前景的治疗Wilm’s瘤的化疗药。临床Ⅰ期试验显示有显著的抗肿瘤活性。与其他化疗药联合也显示较好的疗效。另一较有希望的研究是基因治疗,包括分子靶向的药物,如血管内皮生长抑制剂(VEGF)。这方面也在进行着临床一期试验。总之,对高危组、复发患儿的治疗,还需不断地探索,寻求更好的治疗方案。
(王国民)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




