第一节 神经母细胞瘤
一、概述
神经母细胞瘤(neuroblastoma,NB)是交感神经系统的胚胎性肿瘤。来源于胚胎期肾上腺神经嵴组织的神经母细胞或肾上腺髓质、椎旁交感神经节和副交感神经节,它是儿童期最常见的恶性肿瘤之一,占儿童肿瘤死亡率中的15%。Wright医生在1910年首次描述了NB的病理形态。其后,许多临床医生对其病理来源、临床生物行为和发病机制及分子学特征进行了长期观察和研究。NB的细胞形态、生物行为变化极大,有的肿瘤可自然消退或转化为良性肿瘤,有的患儿病情发展迅速,任何治疗手段都难以控制肿瘤的发展。多数患儿尿中可查到肿瘤生物物质代谢物。
二、流行病学
NB占儿童肿瘤的7%~10%,是儿童最常见的恶性肿瘤之一,继儿童白血病、脑肿瘤、淋巴瘤排在第四位。在18个月内,NB的发病率占第一位。NB的发病有其年龄特点:4岁之内的患儿占总的NB发病率的79%,10岁以后患儿罕见。复旦大学附属儿科医院收治的149例NB患儿发病年龄构成比最高为3~5岁。NB的发病部位多数与胚胎期肾上腺神经嵴组织分布的部位一致。
三、病因学和分子生物学
NB来源于胚胎期肾上腺神经嵴组织的神经母细胞。在由于其他疾病而死亡的年龄为3个月以内的婴儿尸检中发现1/220肾上腺含有NB原位癌,故推测NB发生于胎儿期或婴儿期。这也解释了为什么NB在婴幼期发病率最高。这些原位NB可自发性地消退或转化为良性肿瘤,但有部分患儿在细胞转化过程中接受了不合适的信号而转向不断增殖成为真性恶性肿瘤。
一些作者的研究还显示部分NB患儿具有家族遗传性,有些病儿显示有常染色体遗传的显性类型。Knudson和Strong的研究显示2%~25%的NB患儿与家族性视网膜母细胞瘤有相同的发病机制,即肿瘤发生于前合子胚芽突变。家族性的双侧或多灶性的NB病例也在临床上被发现,有先天性胎儿乙内酰脲综合征、Beckwith Wiedemann综合征、先天性巨结肠等疾患的患儿其NB的发病率高于正常儿童。这些患儿发病的中位年龄为9个月,而其他非家族遗传性的患儿在22个月。
尽管上述的内容部分解释了NB的发病机制,但是它的病因仍不明确。对NB的细胞遗传学的分析,提供了新的方法来研究它的生物学特性和自然发病史。细胞核研究发现染色体-1(1p)的短臂缺如或再排列为最常见,同时可能存在肿瘤抑制基因的缺乏。17q23染色体的基因易位可在50%的神经母细胞瘤患儿中检测到。最近研究发现染色体-1(1p)与染色体-11(11q)可同时发生异常,均质染色区(HSRs)和双微染色体(均质染色区的碎片)是一种基因扩增的表达,它们来源于含有前癌基因N-myc的染色体-2的远端臂,这样的扩增可在30%的进展NB中发现,且仅能在5%~10%的早期患儿中发现,而良性神经节瘤中却不能发现。这表明它是一种特殊的NB遗传的生物特性,在肿瘤内有N-myc扩增的患儿对常规治疗方法是不敏感的。在染色体1p缺如和N-myc扩增之间的相互关系是存在的。NB的细胞染色体数目由DNA指数来反应,也可能是多变的;具有超二倍体DNA含量的肿瘤(DI≥1,DI即DNA指数)常常是分期低的,对化疗药物(CTX,ADR)比仅含二倍体DNA成分(DI<1)的肿瘤要敏感。
四、病理和分期
(一)病理
NB是小的蓝色的圆形细胞肿瘤之一,属该类肿瘤范围的还有非霍奇金淋巴瘤、尤文肉瘤、未分化软组织肉瘤包括横纹肌瘤和原始神经外胚层瘤,诊断时需做鉴别。1999年,国际神经母细胞瘤协会(International Neuroblastoma Pathology Committee,INPC)对神经母细胞肿瘤(nuroblastomic tumor,NT)规定了病理专用术语和分类标准。以Shimada分类为基础,将NT分成4种类型:①NB(Schwannian stroma-poor型);②神经节母细胞瘤(ganglioneuroblastoma,GNB;Schwannian stroma-rich型);③神经节细胞瘤(ganglioneuroma,GN;Schwannian stroma-dominant型);④神经节母细胞瘤,结节型ganglioneuroblastoma,nodular(composite Schwannian stroma-rich/stroma-dominant and strmoma-poor)。NB细胞是小而规则的、带有密度的含染色质多的核和胞质稀少的细胞。细胞可能密度不一,并由细丝分隔,破坏和钙化也可出现。NB又根据有丝分裂和核断裂的指数(MKI,低<100、中100~200、高>200),核分裂率(低、高)和钙化存在状态(是,否)可有3种亚型:①未分化型;②分化差型;③分化型。这种分类方法再结合年龄,可预示临床的预后,详见下述。在大多数病例中,神经炎的过程也能发现,假玫瑰花样变也能在15%~50%病例中发现。临床上,常常要应用各种免疫组化技术和电子显微镜来帮助诊断。单克隆抗体对鉴别本病也具有十分重要的作用。电子显微镜可显示在瘤体内具有神经丝、神经小管和含有儿茶酚胺的神经分沁腺。
INPC从病理角度结合年龄将NB分成预后良好型(favorable)和预后不佳型(un favorable),见表22-1。
表22-1 国际神经母细胞瘤协会的病理预后分型

(二)分期
现将国外常用的3种分期法列表对比,见表22-2。
表22-2 神经母细胞瘤分期

注:(1)如为多灶原发肿瘤(加双侧肾上腺原发瘤)分期应根据最大病灶计算,根据上述分期后加M(例如3M期);(2)中线即以脊椎中线为准。
五、诊断
由第二届国际神经母细胞瘤分期会议推荐NB诊断标准为:①肿瘤组织经光学显微镜明确了病理诊断;②骨髓吸取或活检中含有明确的NB细胞;③尿或血液中的儿茶酚胺升高。
NB的诊断除临床表现外,还包括影像学和能决定疾病程度与预后的实验检查及细胞遗传学检测,以及疾病活动程度的鉴别标记物的测定。NB的诊断如仅依靠X线影像学的发现和尿内儿茶酚胺代谢物的升高是不够的,因为这有可能与神经节瘤或嗜铬细胞瘤,或与其他的实体瘤如原发性神经外胚层瘤(PNET)和横纹肌肉瘤混淆,它们均可以产生尿检查的假阳性。
(一)临床表现
NB的临床表现取决于原发肿瘤发生在交感神节的哪个部位,以及发生转移的疾病表现。腹部为最常见的原发灶部位(50%~80%病例)。腹腔内的原发肿瘤发生在肾上腺或脊椎两旁,脊椎旁肿瘤可能呈哑铃状;腹腔外的原发肿瘤包括颈部交感神经节、后纵隔和骨盆。
NB的早期症状是可触及的腹部肿块,常常是大而硬、不规则而超越中线的,单侧的颈部肿瘤常常可引起Horner综合征、脊髓压迫、呼吸急促或肠道和膀胱功能障碍。因过多的儿茶酚胺产物而发生的症状有潮红、出汗、苍白、头痛和高血压,有时腹泻也可出现,这是因为血管活性肽(VIP)的作用。大约60%的NB患儿在出现临床症状时已有转移,或者是经淋巴或者是经血道。表22-3是在诊断时,病灶扩散方式与年龄的关系。症状包括发热、无力、体重减轻或生长延缓,有些患儿的症状可能与继发的转移灶有关,如顽固的腹泻(肠血管VIP的影响)。骨转移可以表现为骨痛、不愿行走,颅骨肿瘤则由于眼眶淤血引起眼球的突出。在新生儿患儿,皮肤转移很常见,通常可以有一蓝色斑纹区(蓝色草莓松饼症),痉挛症发生(眼球快速的、多向性的运动),称之为肌阵挛——躯干共济失调综合征。这种肿瘤旁综合征常在NB早期出现并持续存在。NB可以侵犯骨髓引起全血细胞减少并可因此而发生感染、出血、面色苍白和嗜睡等并发症。颅内转移常常发生在脑膜,在婴幼儿可引起颅骨骨缝裂开。
表22-3 病灶扩散与年龄的关系
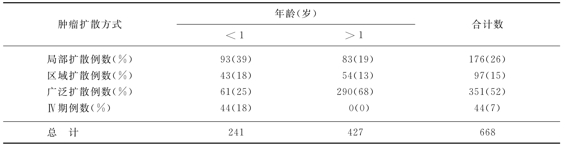
注:%为该年龄患儿扩散占合计数的比例。
(二)影像学检查
原发肿瘤可以用X线片、CT和MRI来进行影像学检查诊断。典型的肾上腺NB的X线片的特征是在肾上腺软组织里有钙化灶发现,静脉肾盂造影(IVP)可以显示出无肾盂肾盏破裂的肾脏移位。在胸部病灶时,胸部平片将能发现后纵隔有肿瘤。如在胸腹部有病灶时,进行CT和MRI检查可有助于发现淋巴转移和脊髓内扩散的存在,血管造影对选择手术方法是有益的。磷-31检查和MRI检查已显示出在诊断NB时的优越性,并能监测治疗反应。
为了发现远处转移(例如骨)常常应用放射性核素骨扫描和X线片等检查。骨扫描比常规X线片更敏感,但在1岁以内的婴儿身上,有时不易解释。99mTc-二膦酸扫描也可应用,对骨转移的敏感性可达90%,但特异性低。间碘苯胍闪烁图是既敏感又有特异性,因为此药是由儿茶酚胺细胞吸收的,并可做预后判断的指标。如果可能,此方法是值得推荐的。肝脏转移可以由CT、超声波或放射性核素肝扫描等方法来检查证实,而对年幼儿这些方法可能不易发现病灶,因为在婴儿肝转移是弥散性的。因此,如婴幼儿NB高度怀疑有肝转移,肝穿刺有时还是要进行的。在儿童NB,肺实质的转移可能极为少见。
(三)骨髓穿刺
对儿童NB,有时在外周血象无任何变化时,就已广泛侵及骨髓,故骨髓穿刺和活检是极需要的。当NB细胞很少时,常常不能与血液成分细胞鉴别。近来,免疫细胞学(例如用单克隆抗体免疫过氧化物酶染色)已经应用,比常规分析要敏感得多。
(四)生物标记物
85%~90%的NB常有过多的儿茶酚胺或它的代谢产物产生,患儿尿中可测出儿茶酚胺代谢产物;例如香草扁桃酸(VMA)和高香草酸(HVA),而VMA和HVA升高对NB的诊断有重要意义,患儿的饮食也可影响HVA的水平,如进食香蕉后检测患儿的24h尿液,可测出较高的HVA值。搜集患儿24h尿液检测VMA和HVA水平是最精确的,通过对一次性尿液中儿茶酚胺和肌酐含量的测定,其比值也有诊断意义,且该方法方便易行。去甲肾上腺素、多巴胺等能在血清中或尿中被检出。VIP等可通过放射免疫法从NB细胞中定量测定。
(五)神经母细胞瘤的普查
对婴幼儿测定尿中VMA的水平,以早期发现NB的研究工作曾在日本进行。通过筛选,有N-myc扩增的约占NB患儿的80%,其中大部分死亡于进展性的病程。普查使日本婴儿神经母细胞瘤的发病率增高2倍,但是却没能使晚期神经母细胞瘤的发病减少。估计普查只是发现了那些可能自然治愈的病例,因此日本小儿外科学会于2004年4月决定,结束从1985年开始的已经进行了近20年的全国范围的神经母细胞瘤筛查。
六、治疗的选择
对大多数局限性病期的患儿,单独外科切除常常是有助的。手术对NB既有诊断又有治疗作用。假如通过骨髓穿刺、生化检查或皮肤活检仍不能确定诊断,进行手术是必要的,可以明确诊断。有时,对一个非手术能明确诊断的患儿,为了进行细胞学分析,获取组织标本也是重要的。然而,有些处于局限性病期的,除手术外,还需要增加其他治疗,如化疗和放疗。化疗和放疗对NB均有一定效果,有弥散型的NB患儿对化疗可能是有效的,但长期的疾病控制往往是不可能的。近年来,由于采用强烈的治疗方案,如骨髓移植(BMT)等,使得进展期患儿得到的治愈机会增加了。因此,决定一个适宜的治疗方法,首先应获取病理,明确诊断,同时还需充分考虑每个NB患儿的年龄、分期和生物学特征。
治疗原则:
1.低危组 这组患儿包括所有的Ⅰ期患儿(INSS分期,以下同),病理类型为预后良好型N-myc无扩增、异倍体的4S期以及肿瘤能完全切除的淋巴结阴性的Ⅱ~Ⅲ期患儿。这组患儿原发肿瘤完全切除,无须进一步治疗。N-myc扩增或DNA低倍指数者,可考虑行化疗。手术不能完整切除者可行诱导化疗+/-放疗,再择期手术。
2.中危组 Ⅱ~Ⅲ期,有淋巴结转移,但病理类型为预后良好型及N-myc无扩增者,或病理类型为预后不佳型及N-myc扩增,但年龄<1岁者。这组患者先给予化疗,年龄>1岁者还可以考虑局部放疗。POG的临床研究示应用放、化疗加手术的治疗方案,患儿无瘤生存率(58%)显著高于手术加化疗者(31%)。但也有作者对采用局部放疗提出异议,因放疗在提高一些生存率的同时伴有放疗后期的损伤。
3.高危组 这组患者包括Ⅱ~Ⅲ期的年龄较大的患儿,病理为预后不佳型和(或)N-myc扩增者及所有的Ⅳ期患者。这组患者目前建议采用大剂量的化疗并同时自身或同体骨髓干细胞移植(BMT)。另外,还需全身放射(TBI)。经上述的全身治疗后失败的原因多为原有病灶的局部复发。故有学者建议在积极的全身治疗下,给予局部肿瘤的手术切除或放疗。应用甲基碘苯胍腚(131I-MIBG)放射性核素行全身内放疗同化疗的结合,取得了令人鼓舞的结果。
总之,20%~40%的NB患儿是局限性疾病,对一个没有远处转移的患儿,应该力争手术切除,对局限性的原发肿瘤完全手术切除可以有很高的治愈率。年龄<2岁和ED分期为Ⅰ期的患儿,治愈率可达90%,那些肿瘤是局限性的,但由于它与大血管密切粘连或其他问题而不能切除,它的预后就没有切除的好了。术前化疗或放疗有时能有一定作用。
在POG报道的一组病例中,POG分期为B期的患儿,62%在化疗后达到了完全的临床治愈,对化疗有残余肿瘤的,再进行手术切除,有时也可达到完全切除的效果。那些局限性的NB,经化疗后也转变为完全切除,并得到相当好的预后。进展型的患儿(N-myc基因扩增,Ⅱ期、Ⅲ期和部分Ⅳ期)进行术前化疗,可争取60%~65%的患儿肿瘤完全切除。
意大利神经母细胞瘤协作组(ICGN)报道145例局限性不能切除的NB和切除后肿瘤残余>2cm的患儿,其中94例(65%)对化疗有效,94例中的75例接着又被完全切除,仅有14例再进行放疗。
POG报道提出有腹股沟淋巴结转移的婴幼儿NB(C期),经过手术和术后化疗后,得到的POG分期的B期婴幼儿有同样的效果。值得提出的是,在腹部NB手术切除时,如有残留可能或希望进行术后放疗的,留下银夹标记在可疑病灶周围,以便在以后的放疗设野时用作参考。(https://www.xing528.com)
哑铃状肿瘤须通过二期手术进行。第一次手术时,切除脊髓外部分。肿瘤的脊髓内和髓内部分第二次手术时切除,如果有脊髓压迫证据的,椎板切除术应首先执行。
一些原发肿瘤小但已有肝转移的婴幼儿(Ⅳ-S期)需要进行特殊的手术处理。肿大的肝脏可使横膈上抬,造成压迫下腔静脉和肾静脉引起腹水、少尿等症状。对这类患儿可进行化疗或放疗,以期转移性肿块缩小再行原发灶切除。如放、化疗均无效,可行Silastic手术,在腹壁上造成一个能让肿大肝脏扩张的部位,以求减少对重要器官的压迫。
七、放疗
由于放疗影响长期生存的患儿的生长,对放疗一直采取谨慎的态度。近年放疗新技术的开展,如三维适形放疗、调强放疗,使影响正常组织生长的后期放疗损伤得到改善。
(一)放疗原则
1.对化疗无反应或耐药的局限性肿瘤。
2.不能承受外科手术的患儿。
3.对手术有残留病灶者,也可考虑行局部放射。
4.对已全身转移患者,尤其是在骨髓移植前需要行TBI。
5.不能切除的或已有转移病例的姑息疗法。NB发生转移以姑息治疗为主的。放疗对骨和软组织转移的缓解症状是有效的。有作者报道40例骨转移患儿的放疗后,大约有65%的患儿骨转移性疼痛症状得到缓解,对软组织转移的止痛作用也达到67%。
(二)放疗实施
1.照射野 局限性NB的照射野可以通过CT或MRI的肿瘤区的测量来决定,如果已进行手术的可根据外科医生的手术记录的描述来决定。如果淋巴结的侵犯被怀疑或已被证实的话,那么照射野的设计应该是一个大野,它要包括原发肿瘤区和淋巴引流区。如果照射野必须包括部分椎体时,那设野时就应该把整个椎体包括进去,这将减少以后发生严重的脊柱侧凸的后遗症。对下一站的淋巴结是否要照射是有争论的(例如上腹部的肿瘤、是否要照射纵隔淋巴结),未被照射的下一站淋巴结的复发是可能发生的,虽然通常与局部或远处失败有关。Duke报道33例分期为A-C的,21例经过放疗的患儿有1例(5%)照射野内复发,12例没有经放疗的有7例发生复发(58%)。下一站淋巴结的照射通常是不作常规照射的。当肿瘤是哑铃状时,设野应十分注意脊髓内和椎体外的肿瘤应该均能被包括在内。
大多数的腹部和盆腔部位以前后野照射为最常用。但应尽可能采用多野照射技术,这样可避开正常组织。后纵隔野用一对后野加楔形滤片的成角照射。
对Ⅳ-S期伴有肝肿大的患儿可以进行放疗,通常不进行全肝照射。放疗医师可应用部分保护的方法来避免肾脏以及卵巢受照。通常建议应用两个侧野,平行相对照射,或稍成角照射来治疗肝脏,又可保护肾脏,只要将侧野的后界放在椎体的前方即可。当照射野的下界置于或在髂嵴以上时,卵巢通常就能避开。Ⅳ-S期的患儿可能有比较长的生存期,婴儿肾脏对放射线要比年长儿更敏感,故对Ⅳ-S期伴有肝肿大的患儿给予的照射剂量通常是低的,即4.5~6Gy,分2~4次给予。Ⅳ期伴有肝肿大的NB患儿,为了姑息的目的,有时可行全肝照射,这时可应用前后野对照。
2.放疗剂量 虽然NB细胞在实验室表现对射线是敏感的,在临床上发现NB对放疗的疗效并不一致,并有照射野内复发的情况。可能原因是:①实验室的资料并不能代表临床NB的情况,细胞培养技术可能选择了相对放射敏感的细胞。②NB可能确实有一个疾病范围,N-myc基因的扩增与分期和预后有关,提示N-myc基因在确定人类NB进展上是有作用的。可能NB放射敏感性临床上表现不一是反映癌基因的基因扩增的变化。国外学者Perez等报道分析了27例接受放疗的有2年生存率的NB患儿,其中有5例患儿接受10Gy或以下照射的,仅1人生存满2年(20%),10例接受10~20Gy的患儿有3例生存满2年(30%),另有12例患儿接受>20Gy治疗的有7例生存满2年(58%)。另外,Florida大学的一组回顾性分析20例接受术后放疗的Ⅱ期或Ⅲ期患儿,照射剂量9~12Gy的与30~40Gy的疗效相似。在Duke,放疗医生分析了7例Ⅱ期患儿以14.8~26.5Gy的照射剂量得到控制;11例Ⅲ期患儿给予12~48.4Gy,有7人得到局部控制。
据文献报道,<1岁的婴幼儿给予11.2Gy的照射剂量,没有发现有局部失败。在1~2岁的儿童给予14.4Gy,也未发现局部失败。超过3岁的患儿在给予25Gy、30Gy、39.6Gy和45Gy时均有局部失败出现。
笔者推荐以下剂量:如患儿年龄<18个月,有显微镜下阳性病灶的,给予局部野15Gy,然后缩野加量5~10Gy;年长儿,或有部分残留病灶者,给予原发灶区15~20Gy,再缩野加量5~10Gy:对病灶较大的,给予小剂量照射的方法是不可取的;对有骨和软组织转移的NB的放疗,推荐每日用2~5Gy,总量为4~32Gy,一般的原则是剂量必须能控制症状,但又不能高到产生严重并发症。分次要取决于照射野的大小,小野可以给予16~20Gy,分4~5次给予,而大野则常常每次2~3Gy,总量到20~30Gy,对那些剧烈疼痛患儿的照射可一次给予6~8Gy,共1~2次来达到快速止痛。
Ⅳ-S期伴有肝肿大的患儿通常给总量4.5~6Gy,分2~4次给予,肝脏可能在治疗后会慢慢缩小。如果可能的话,可在休息2~3周后再给一次治疗。总剂量达到12~14Gy,在放疗中应采取保护肾脏的措施。分次的TBI也为国外学者用来治疗Ⅳ期NB患儿。Kun等报道了应用环磷酰胺(CTX)、放线菌素D(ADR)、长春新碱(VCR)、顺铂(DDP)、依托泊苷(VP-16)和单克隆抗体的强烈化疗方法治疗22例Ⅳ期患儿。治疗次序为先手术切除原发灶,接着是强烈化疗,然后再对原发灶部件进行巩固性放疗,每次1.5Gy,1日2次,总剂量为21Gy。中位随访期为18个月,22例中有15例得到缓解。
对已全身转移患儿,尤其是在骨髓移植前需要行TBI。总剂量在7.5~12Gy。通常可分1~6次给予,在1~5d内实行,有时还可给局部追加剂量,局部加量后合适的总剂量为20~30Gy。
3.放疗并发症 在长期存活者中,脊柱畸形的发生率是很高的,最常见的可能是术前或术后放射引起的脊柱后凸或后侧凸,它们的发病率在5年生存者中可达76%。引起脊柱畸形的原因可有以下几点:①在非常年幼时接受了放疗;②高能量射线的照射;③脊柱的不对称照射;④肿瘤的硬膜外扩散;⑤椎板切除术的施行。许多年幼儿,椎板切除可引起生长畸形、驼背和脊柱的不稳定。年幼儿的哑铃状病灶是发生脊柱畸形最危险的因素。
应用高能射线进行不对称的脊柱照射引起脊柱畸形的病例也时有报道。放射线作用于脊柱旁肌肉也可引起脊柱变形。一个成功的NB患儿的治疗,必须要密切随访,及时发现可能发生的脊柱畸形。早期的与合适的给予支架处理可能是有效的。
在NB治疗时,常给予肾脏部位照射,成人肾脏对放射线的耐受量为20~25Gy,已经为临床医生了解,而儿童肾脏对放射线的耐受量要比成人低。在临床上,已经发现Ⅳ-S期患儿接受一侧肾区或双侧肾区11.25~14Gy时,发生肌酐廓清率的异常。因此要特别小心对待婴幼儿Ⅳ-S期患儿肾区的照射剂量。
八、治疗结果及预后因素
低危组的患儿几乎都能存活。生存率达85%~90%。Ⅱ期和Ⅳ-S期约有80%的长期存活率,Ⅲ期患儿50%~70%的长期存活。年龄>1岁的Ⅳ期患儿不到20%的能有长期存活,但如果加用强烈化疗并辅以骨髓移植,可使生存率有改善。中危组的患儿如能肿瘤完全切除,也可达到70%以上的存活(POG临床试验)。高危组患儿年龄>1岁者,3年生存率不到10%~30%。近年采用高剂量化疗+BMT及局部放疗等综合治疗,3年无瘤生存率提高到34%。
对于Ⅳ期高危组患儿采用自体骨髓移植疗效(ABMT)见表22-4。
表22-4 年龄>1岁的已有转移的Ⅳ期NB采用ABMT疗效

NB的一些临床生化特点与预后有关,不同的作者进行不同的组合,进行不同配对的研究,例如以分期、年龄、乳酸脱氢酶(LDH)水平为一组;LDH水平、肿瘤的可切除性、病理分型和白细胞减少作为另一组来进行对患者预后好坏的研究。同时,来自各个不同研究组的不同的建议,得出的结果也会不同。另外,细胞基因资料正在快速积累,反映临床行为的NB的基因亚型也在被不断地发现,这些都将会影响预后(表22-5、表22-6)。
表22-5 神经母细胞瘤的临床特征和基因亚型表

表22-6 以临床和生物学特征为基础的预后分级

注:*NA指尚未应用。
疾病的分期是明显影响预后的因素,POG分期法的A和B期患儿,与年龄<1岁的C期患儿85%生存。相反,年龄>1岁的C期患儿有60%的生存率,C期年长儿10%~30%生存。
诊断时的年龄也是决定预后的主要因素,如果确诊时的年龄<1~1.5岁比同样分期的年长儿的预后要好。表22-1示病灶播散与年龄的关系。大部分年幼时诊断为NB患儿的生存期要比年长儿长,尤其在新生儿3个月内自然消失率很高。
在NB的生存率方面,男女性别之间无明显的差别,但是与肿瘤发生的部位有关系,原发部位为胸部的要比原发部位在腹部的要好,其原因是胸部肿瘤的体征与症状易于发现,能较早诊断和治疗。另外,也发现胸部NB的患儿通常年龄更为偏小,恶性程度也较低。
在生物学方面,被检测到的VMA和HVA值的多少对预后无意义,而VMA∶HVA比值升高提示预后较好。
铁蛋白(ferritin)是由NB细胞产生的,这可以反映肿瘤瘤体的生成,也可能是NB细胞生长所必需的物质。大约有50%的进展期的NB患儿的铁蛋白水平升高(>142μg/ml),而在局限性肿瘤的患儿中极少有升高现象。
神经元特异烯醇化酶(neuron-specific-enolase)是含有神经元细胞的细胞质蛋白,如果它升高(>100μg/ml),则预示生存期极短,它可以用作治疗后的监测。
乳酸脱氢酶可以反映肿瘤细胞的负荷性与活性,血浆浓度升高(>1 500IU/ml)可预示有极差的预后。
某些神经肽(肠血管活性肽等)可以反映NB细胞分化程度和良好预后分期之间的关系。
P-糖蛋白可作为一种ATP依赖性药物溢出泵的作用,它在治疗前的表达可预测治疗的疗效。它也意味着逆转间接P-糖蛋白的多药耐药性的能力可用在NB上。
DNA指数、N-myc扩增、染色体1P和染色体11q缺陷对预后均有影响。N-myc扩增、1p和11q存在者有较差的预后,且是相互独立因素,而超二倍体heTrK A过表达则有较好的预后。
Ha-ras p21基因的高度表达与诊断时的肿瘤低临床分期和患者生存率的升高有关系,与N-ras有相反的表达。
神经节苷脂(GD)是NB膜上的神经节苷脂,在血循环内水平的升高,表示为疾病活性和对治疗反应的又一个标志物。脱落的GD可以促进肿瘤的发展,抗GD2抗体也可能对治疗NB是有效的。
(王国民)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




