第二节 肝外胆管癌
一、肝外胆管的应用解剖
(一)构成(图9-2)
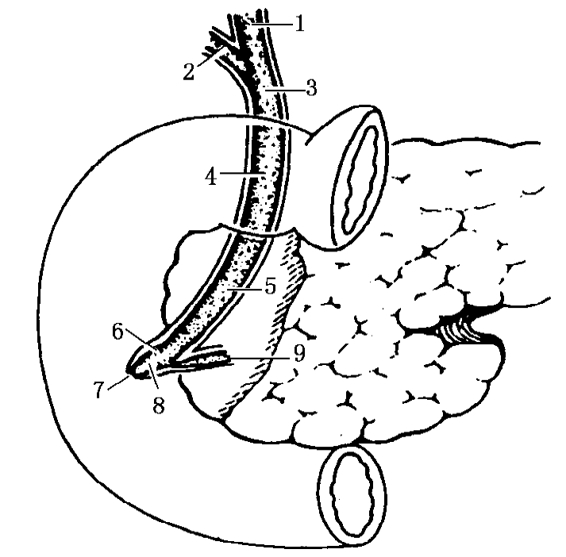
图9-2 胆总管的行径和分段
1.肝总管;2.胆囊管;3.胆总管十二指肠上段;4.十二指肠后段;5.胰腺段;6.十二指肠壁段;7.十二指肠大乳头;8.胆胰管壶腹;9.胰管
1.肝总管肝内左右肝管出肝后,约80%以上在肝门平面以下汇合形成肝总管,肝总管在肝十二指肠韧带内向下右方走行一段后,与胆囊管汇合,汇合位置的高低决定了肝总管的长度,成年人通常长度为3~4cm,管径为0.5cm。
2.胆囊管位置较深,续于胆囊颈,向左后下方延伸,下端与肝总管呈锐角汇成胆总管,长约3~4cm,直径为0.3cm。
3.胆总管位于肝十二指肠韧带内的右侧缘内,肝固有动脉的右侧和门静脉的右前方。下行于十二指肠上部的后方,经胃十二指肠动脉的右侧斜向右下,在胰头后面的上外侧继续弯向右下,在下腔静脉前方进入胰头和十二指肠降部之间的胆总管沟内,最后在十二指肠降部中1/3(或下1/3)的后内侧与胰管相遇,两管平行或先汇合后斜穿十二指肠降部的后内侧壁而开口于大乳头。成年人胆总管长度为7~9cm;管径为0.6~0.8cm,一般不超过1cm。胆总管分为下述4部分:
(1)十二指肠上段 即胆囊管与肝总管汇合处下行至十二指肠球部上缘部分,长约2~3cm,位于十二指肠韧带内。
(2)十二指肠后段 在十二指肠球的后方,下腔静脉前方和门静脉右侧下行,长约1~2cm。
(3)十二指肠下段(又称胰腺段) 在十二指肠降部和胰头之间,长约3cm。
(4)十二指肠内段 在十二指肠降部的后内侧壁内,长为1.5~2.0cm。其远端膨大部分称肝胰(Vater)壶腹,出口处有肝胰壶腹(Oddi)括约肌。
(二)淋巴引流
与胆囊癌的淋巴结转移途径基本相仿。
(三)胆管血运
1.动脉肝总管和胆总管的上部均由胆囊动脉的分支供血,胆总管的下部由胰十二指肠后上动脉供血,胆总管的中部由肝固有动脉右支供血。
2.静脉胆总管周围的静脉丛流入门静脉。
二、流行病学
胆管癌的发病率近年呈逐年上升趋势。美国每年发病率为1/10万~2/10万;日本的发病率较高,约为5.5/10万。上海1994年统计的胆管癌总发病率为0.324‰,男、女性的胆管癌发病率分别比20年前增加了119%、124%。
胆管癌的平均好发年龄约为60岁,在80岁时达到峰值。
以往国内外文献报道,胆管癌的男女发病比例为2~3∶1,而近年来则趋于1~1.5∶1,说明女性胆管癌的发病率在上升。
胆管癌的世界高发地区以东南亚热带国家(泰国等)为首,与饮食习性(好食生鱼、酸菜)及地区性肝吸虫疫情有关。高发地区还包括以色列、拉美地区、日本和德国等;非洲和印度为低发地区。我国不属于高发区,但近年发病率呈逐年增长的趋势,其中上海地区是全国胆管癌发病率上升速度最快的。
不少疾病和环境因素与胆管癌相关,包括原发性硬化性胆管炎、胆总管囊性扩张、胆汁淤积和感染以及肝内胆管结石症等。已被确认的其他危险因素还有肝吸虫、胶质二氧化钍、亚硝胺饮食和暴露于二英环境等。
三、胆管癌的浸润与转移特性
(一)直接浸润蔓延
1.胆管癌可沿胆管黏膜或黏膜下层上下浸润,其向肝侧胆管浸润范围明显大于十二指肠方向,横向解剖缘的浸润发生率多于纵向上下切断的浸润。有时在肿瘤早期,癌细胞浸润周围结缔组织之前,已向肝内胆管扩散,形成多个卫星灶。
2.胆管壁内含有丰富的神经纤维,由于神经周围间隙中组织抵抗力相对较小,有利于肿瘤浸润和生长,故胆管癌常常侵犯胆管和十二指肠韧带中神经周围组织及神经鞘(75%~90%)。神经浸润和残留往往是局部复发和患者中上腹痛的主要原因之一。
3.由于缺乏浆膜层的包裹,胆管癌易侵犯胆管周围组织。上段肝外胆管癌除直接侵犯肝脏外,常可累及门静脉和肝右动脉;中下段胆管癌可扩散至胰腺、十二指肠、胃、结肠或网膜,较少侵犯周围血管,淋巴结转移相对多见。
(二)淋巴道转移
胆管癌在诊断时已有1/3~1/2的患者发生淋巴结转移。最早出现淋巴转移的是中段胆管癌,上、下段胆管癌次之。中段胆管癌的淋巴转移主要包括:①由肝十二指肠韧带向胰腺后、上淋巴结转移;②肝动脉淋巴结向腹腔干淋巴结转移。上段胆管癌(肝门部胆管癌)从胆囊管淋巴结向下向后转移至胰头、门静脉及肝总动脉淋巴结。下段胆管癌以局部淋巴结向远处转移为主。腹主动脉淋巴结是腹部淋巴转移的最后一站。有资料表明,约1/4的PT2和PT3期胆管癌患者在手术时有此淋巴结转移,也有越过肝总管和胰十二指肠后淋巴结而“跳跃性”转移者,这已成为胆管癌根治手术时腹主动脉旁淋巴结清扫的理论依据。
(三)血行转移
由于胆管不仅静脉回流至门静脉,还可直接侵犯门静脉形成癌栓,因此肝脏的转移最为多见,其次为肺和腹膜转移,其他远处或腹外转移很少见。
四、临床表现
胆管癌早期缺乏特异性临床表现,仅出现中上腹胀、隐痛、不适、乏力、纳差和消瘦等症状。由于胆管仅剩针尖样通道也不会出现黄疸,当出现黄疸时胆道已近乎完全阻塞,而90%以上胆管癌患者就诊时已有黄疸症状,说明大多数患者确诊时已属中晚期。
由于炎症、损伤、畸形、结石、结核、硬化性胆管炎、毗邻器官癌肿累及胆管等病变都可产生与胆管癌相似的临床表现,因此误诊率达19.1%。所以,当患者有中上腹腹胀不适且B超、彩超、ERCP、MRCP或CT检查发现胆管有局限性狭窄征象时,或患者出现尿色深、黄疸,肝功能检查呈现胆汁淤积为重而肝细胞损害为轻的酶谱表现时,一定要查明胆管狭窄和黄疸的原因,以免延误胆管癌诊断。
五、诊断方法
由于早期胆管癌缺乏明显特异的临床表现,又无敏感性强和特异性高的肿瘤标记物,诊断主要依赖于影像学检查。对于胆管癌疑者的诊断顺序一般可先用彩超、CT筛选出有无明显的恶性梗阻性病因,并初步判断梗阻的性质和部位,然后进一步做ERCP、PTC、MRCP或细胞学检查,以准确判断肿瘤的性质、水平部位和范围,有利于治疗方案的选择。血清CA19-9、胆汁CEA等肿瘤标记物是有益的参考。
ERCP和PTC作为侵入性诊疗手段,现在一般限用于手术前1~2d或治疗性诊断——胆汁引流。ERCP不能显示梗阻以上的胆管,PTC则对梗阻下端和肿瘤远侧的胆管情况无能为力,两者均有一定的出血和感染等并发症的概率。MRCP是一种无创检查,是目前最理想的影像学检查方法,能较清晰地显示胆管阻塞的范围与程度,对梗阻原因的诊断准确性为83%~95.8%。若MRCP再加上常规MR横断和MR血管造影检查,可在一次无损伤检查中得到胆管肿瘤和周围组织完整的图像资料,足以为手术及综合治疗决策提供必要的病灶定位、定性和分期的信息。但体内有金属物者不能行此项检查。
CA19-9是诊断胆管癌和监测该病治疗反应的有效肿瘤标志物,有研究发现血清CA19-9在肝外胆管癌诊断中的阳性率高于超声、CT和CEA。在无胆管炎的情况下,胆管良性病变者CA19-9值极少高于200kU/L,若测定值大于正常值6倍(即222kU/L),则为阳性。
对高度怀疑的胆管癌(ERCP、MRCP和细胞学检查等阴性)及尚未明确的远处转移,PET也许有帮助。
六、分期
《AJCC癌症分期手册》第6版中肝外胆管癌的TNM分期标准如下:
原发肿瘤(T)
Tx 原发肿瘤不能估计。
T0 无原发肿瘤。
Tis 原位癌。
T1 组织学上肿瘤局限于胆管。
T2 肿瘤侵犯超出胆管壁。
T3 肿瘤侵犯肝脏、胆囊、胰腺和(或)门静脉或肝动脉的一侧分支(左或右)。
T4 肿瘤侵犯下列任何结构:门静脉主干或其双侧分支,肝总动脉或其他的邻近结构,如结肠、胃、十二指肠或腹壁。
区域淋巴结(N)
NX 区域淋巴结无法评估。
N0 无区域淋巴结转移。
N1 有区域淋巴结转移。
注:区域淋巴结包括以下几组:肝门淋巴结(胆总管、肝动脉、门静脉和胆囊管的淋巴结),腹腔动脉淋巴结,十二指肠周围和胰头周围淋巴结以及肠系膜上动脉淋巴结。
远处转移(M)
MX 远处转移无法评估。
M0 无远处转移。
M1 有远处转移。
分期

组织学分级(G)
GX 组织学分级无法评估。
G1 高分化。
G2 中分化。
G3 低分化。
G4 未分化。
七、病理
(一)分段
1.上段胆管癌 或称高位胆管癌、肝门胆管癌,肿瘤位于肝总管、左右肝管及其汇合部,位于后者部位的癌肿又称Klatskin瘤。最多见,占肝外胆管癌总数的50%~70%。
2.中段胆管癌 占10%~25%,肿瘤位于胆囊管水平以下、十二指肠上缘以上的胆总管。
3.下段胆管癌 占10%~20%,肿瘤位于十二指肠上缘以下、Vater壶腹以上的胆总管。
尚有少数肿瘤发现时已跨段且原发部位不清,称联合部位胆管癌。有资料表明其转移率高达46.6%。
(二)大体形态
1.乳头型 呈菜花样向腔内生长,扩张的胆管壁薄,隔着胆管壁能扪及质软肿瘤,稍能推动。
2.结节型 肿瘤呈结节状突向胆管腔,管腔不规则狭窄,胆管壁稍增厚。
3.硬化型 最常见,呈一生姜样质硬肿块,剖面灰白色或淡黄色,胆管壁极度增厚,中央仅见纤细腔道,甚至完全闭锁,于正常胆管交界处呈漏斗样缩窄。
4.弥漫型 胆管壁广泛增厚,呈一条索状管道结构,向胆总管延伸。
(三)镜下形态
肝外胆管癌几乎都是来源于胆管立方上皮的腺癌(95%),罕见的组织来源包括鳞癌或腺鳞癌,为上皮鳞状化生癌变而成。镜检时,胆管癌大部分是分化良好的有黏液分泌的腺癌,甚至在其转移灶中有时也很难找到腺体及细胞的异形。癌细胞呈腺泡状、小腺腔、腺管状或条索状排列。癌细胞为柱形,核长卵形,浅或深染,异形性不大。同一腺腔中细胞异质性,核质比例升高,核仁明显,间质和周围神经浸润;腺腔周围的间质富于细胞,并呈同心圆排列。这些都是胆管癌的重要特征。其中,正常的腺上皮和那些核大、核仁明显的腺上皮存在于同一腺腔中最具诊断价值。硬化型胆管癌伴有明显纤维化。部分胆管癌伴有神经内分泌分化,预后较差。
八、预后因素
胆管癌早期即可沿胆管周围淋巴管、血管、神经周围间隙及疏松纤维结缔组织等发生多途径浸润转移,发现时多已晚期,故预后欠佳。手术切除的胆管癌患者总的中位生存期约为2年,5年生存率为20%~40%。肝外胆管癌的预后基于原发肿瘤的病理特点,包括组织类型、组织学分级和血管、淋巴结、神经周围侵犯。手术切除程度也是个重要的预后因素。
乳头状癌分化最好,疗效好于其他型肿瘤;弥漫型癌恶性程度最高,常有肝内外的广泛侵犯,预后不良。
组织学分级提示肿瘤恶性程度的高低,分化差的患者术后复发乃至死亡的病例数是高分化胆管癌的6~7倍。对于已根治切除的胆管癌,高、中、低分化的腺癌患者平均生存期分别为58个月、11个月和9个月。
淋巴结转移对胆管癌术后患者的预后影响也较大,淋巴结转移阳性和阴性相比,患者死亡的风险为6.124倍。Kim等经多因素分析发现淋巴结转移也是肝外胆管癌患者术后放疗的唯一有显著意义的预后因子,N0和N1N2两组的5年生存率分别为37%和19%。
黄志强等发现有神经侵犯者往往生存率较低,3、5年生存率为34%和21%。
手术切除的程度(R0,完全切除,镜下切缘阴性;R1,切缘肉眼阴性而镜下阳性;R2,肉眼残留)不属于TNM分期系统,但在预后上有重要意义。据统计,胆管癌根治术R0率仅为83%,局部切除时R1,甚至R2率可高达50%,故行扩大根治术的边缘无瘤率明显高于局部切除者。上段胆管癌由于肝门周围解剖关系复杂,常导致勉强切除,故切缘阳性率高,术后总的5年生存率仅10%~20%,而获彻底切除镜下切缘阴性的患者5年生存率可高达33%~46%。中下段胆管癌手术切除率高,可切除者中位生存期为32~38个月,5年生存率为28%~45%,而胆管癌姑息性手术者生存期往往不足1年。
近年来有关胆管肿瘤分子机制的研究表明,控制肿瘤的癌基因的表达情况与胆管癌的病理分级分型、肿瘤大小及转移情况有关,癌基因表达的强弱和阳性率可作为胆管癌预后好坏的判断标准。经研究发现,与胆管癌有关的基因包括,癌基因(ras、cerbB-2、c-myc)、抑癌基因(p15、p16和p53)和凋亡相关基因(bcl-2、bax)等,但理想的具有高敏感性及高特异性的用于胆管癌早期诊断和预后评估的标志物目前尚未发现。
九、治疗(https://www.xing528.com)
(一)手术治疗
1.手术方式
1)根治性手术 彻底切除肿瘤可能是胆管癌患者唯一可能根治的治疗手段,手术方式取决于肿瘤部位和范围。累及肝管分叉或肝总管近端的肝门周围型胆管癌根治性骨骼化切除术,将包括肿瘤在内的肝、胆总管、胆囊、部分左右肝管以及肝十二指肠韧带内除血管以外的所有软组织整块切除,将肝内胆管与空肠做Roux-en-Y吻合;若术前检查发现右或左肝管累及,则应对无明显禁忌证的患者行扩大根治术,即在骨骼化切除的同时,一并施行左半肝或右半肝切除,由于40%~50%的肝门部胆管癌有尾叶胆管侵犯,为获阴性切缘常需切除尾状叶;若侵犯血管,尚须行血管切除及重建术。对于中下段胆管癌患者,胰十二指肠切除术是最佳根治手术方式。
2)姑息性手术 胆管癌患者术中探查时有半数以上被发现已有腹膜或肝脏转移或局部晚期无法切除,此时姑息性减黄引流术可有效缓解症状、改善一般状况,为放、化疗创造条件。肝管汇合处和肝总管病变时常采用肝内(Ⅲ、Ⅴ段)胆管空肠吻合;远端胆管癌若因包绕血管而无法切除则行胆囊切除术加肿瘤近端的Roux-en-Y肝总管空肠吻合术;有时为防止胃出口梗阻,尚需行胃空肠吻合术。
2.外科治疗的不足
1)因胆管癌早期诊断较困难,发现时多数已达中晚期,只有不足1/3的胆管癌患者能够获得根治性切除,多数Ⅲ、Ⅳ期患者仅可行姑息性手术,但必须辅以其他治疗。
2)由于肿瘤可为多中心性,胆管癌可沿多途径向胆管周围淋巴血管和神经侵犯,向肝和肝十二指肠韧带外扩散和蔓延。尽管手术根治是胆管癌的有效措施,但根据其生物学行为和解剖的特点,完全切除几乎只是理想化,因为肝胆管残端、肝十二指肠韧带内及其他转移灶内仍可能有癌细胞残留,不当的操作也会造成医源性播散,这些将成为术后肿瘤转移和局部复发的主要原因。
3)胆管癌手术创伤大、难度高,有一定的并发症发生率和手术死亡率,尤其是已有黄疸和明显消瘦恶病质趋势的患者,出血、感染及肝衰竭等术后并发症更高发(可达40%)。
(二)非手术治疗
1.化疗 主要用于:①术后复发者;②有高危转移因素的术后患者;③有广泛或远处转移者。胆管癌是消化道肿瘤中化疗效果较差的,标准的化疗方案FAM的有效率偏低不足20%,新的化疗方案和药物还在摸索之中,在某些Ⅱ、Ⅲ期临床试验中,部分化疗药物[如紫杉醇、依托泊苷(足叶乙苷)等]有一定敏感率,但至今仍无公认有效的一线化疗方案用于胆管癌的临床治疗。根据肿瘤药物敏感试验选择化疗药物进行个体化的治疗可能是目前提高化疗效果的最佳方法,同时也要注意两种敏感的方案交替使用,以减少耐药株的出现。
2.介入治疗 动脉栓塞及灌注化疗由于总体疗效不明显,还有待进一步研究,故目前临床应用较少。而介入性胆道引流术则是胆管癌非手术姑息性治疗的重要手段,可通过内镜或经皮途径进行。经皮胆道引流术在肝门周围型胆管癌患者优于内镜处理,而远端型胆管癌患者则首选内镜经十二指肠乳头胆道引流术。目前国内外最常用的姑息性内引流方法是经皮肝或经十二指肠乳头置入镍钛形状记忆合金胆道内支架以缓解梗阻性黄疸(图9-3,见插页)。当然该方法也有以下的局限性:①金属支架也会被胆泥堵塞(一般可用1年左右);②植入胆道后不能再取出;③植入下段胆管后可发生反流性胆管炎、十二指肠不全性梗阻和穿孔;④肿瘤亦可经网眼长入管腔。因此需严格掌握指征,尤其是远端胆管癌,必须明确病理并确认无法手术。
3.放疗 胆管癌的病理类型以腺癌为主,有体外实验结果显示胆道肿瘤细胞系大多呈相对放射抗拒,因此迄今为止放疗对其的治疗价值并未得到普遍认同,但从近期不少研究报道来看,放疗还显示出一定的价值,值得进一步研究。
1)适应证 ①不适于手术治疗的Ⅲ、Ⅳ期胆管癌患者可作姑息性放疗以缓解症状,并可适当地延长生存期,这些病例也适于联合腔内放疗,可增加局部剂量,从而使局控率和生存率都得到提高;②非根治切除病例或术后残留病例可行腔内放疗或术中放疗并联合外放疗;③已行根治切除手术,但术后病理提示有高危复发因素(分化差、周围血管、神经侵犯、区域淋巴结转移、手术切缘距肿瘤浸润边缘<3mm)的患者,可行术后预防性放疗;④肝门部胆管癌并导致梗阻性黄疸的患者,若肝内胆管扩张不足,较难穿刺行PTCD治疗,则外放疗是一种有效的姑息性治疗手段;⑤有研究显示术前行ERCP胆汁引流的患者,在术后1年中约20%出现了种植转移,而结合术前低剂量放疗的胆管肿瘤切除者种植转移危险性下降;⑥胆管内支架置入术后,体外或腔内放疗可延长支架开放时间,减少梗阻复发。
2)禁忌证 与胆囊癌的放疗禁忌证相同。
4.其他治疗 此外,尚有生物免疫治疗、基因治疗和光动力治疗等方法,均有一定的发展前景,但目前这些治疗有的疗效还相当有限,有的尚在实验研究阶段,还有的在临床实施技术上存在一定困难较难普及,因此还有一段很长的发展道路要走,但毕竟给胆管癌患者带来了希望。
十、放疗技术
(一)照射范围
照射范围与胆囊癌原则上基本相同,最初大范围治疗主要包括瘤床或未切除的肿瘤、肝门区、胰头周围淋巴结和腹腔中轴线上的淋巴结(腹腔动脉淋巴结、肠系膜根部淋巴结);若已植入内支架,则必须完全包括在照射野内;肝门部胆管癌因肿瘤易向肝内浸润,肝内的放射边缘至少距肿瘤3cm。如果可能,尽量用挡块保护正常的胃、小肠、右肾和肝。缩野追加剂量主要针对原发病灶,可用外照射,也可采用腔内近距离治疗。
对于已行根治性切除,镜下切缘阴性且距肿瘤>5mm者,术后预防性放疗的范围以区域淋巴结引流区为主;姑息性放疗则以引起梗阻性黄疸和腹痛的瘤床为主。
具体照射范围可参考定位片(图9-4,见插页)。
(二)照射剂量
放射源一般采用直线加速器(6~15MV X线)或钴60机(γ线);照射野可以是两野(AP-PA)、三野(前野和双侧野)或盒式四野(前后野和双侧野)。
包括瘤床和淋巴引流区的大范围治疗不宜用低分割,建议常规分割1.7~1.8Gy/次,每日1次,1周5次;一般当照射剂量达40~45Gy时,需考虑缩野,两野照射时必须注意脊髓和肾脏的剂量;若野内肝脏体积较大,则宜在30~36Gy时就重新定位缩小射野;若为预防性照射,则总量应控制在45~50Gy;切缘阳性或残留灶以及术后局部复发灶针对瘤床小野加量的上限水平为55~70Gy/6.5~8周以上。
若外照射与术中放疗或近距离后装治疗相结合,则外放疗总剂量控制在40~50Gy。术中放疗一般根据肿瘤的深度选择6~12MeV的电子束,一次给予20~30Gy的剂量。如射野内有肠管存在时,照射剂量应减少至18Gy以下,或将射野缩小到肉眼可见到的病灶范围内,术后2周可加外放疗。近距离腔内照射目前多采用高剂量率192Ir源后装机,1cm半径内总剂量20~30Gy,6~7Gy/次,一般分4次进行,每两次之间间隔5~7d。
不少文献确实报道了胆管癌的放疗疗效存在剂量效应关系,如Kraybill等通过队列研究发现放疗剂量是胆管癌患者生存率的独立预后因子;Alden和Mohiuddin报道了总剂量>55Gy(包括外照射和腔内放疗)的患者与较低剂量者相比2年生存率(48%比0%,P=0.003)和中位生存时间(24个月比6个月)均有明显改善。上述研究包括了已行切除术的患者,Gonzalez等报道了一组不能切除的肝外胆管癌患者接受剂量>40Gy者的中位生存期几乎是<40Gy者的2倍。然而剂量的提高也会导致不良反应发生率增加。目前胆管癌的照射剂量和次数尚无统一标准,还需进一步研究。
随着介入技术的发展,胆管金属内支架的应用越来越广泛,这种植入物一般呈薄型金属网状结构,与胆管内壁上皮组织紧密接触,在射野中必然会对放疗剂量分布产生影响。但是目前在放射物理学领域不同研究者的结果存在差异,且对各自结果的解释也不尽相同。在综合分析了国内外近年有关金属内支架对射线影响的文献后,张建英等认为金属支架由于厚度很薄,且金属丝很细(远小于丝间间隙),对射线的衰减作用极小,很容易被周围组织的模体散射掩盖,大多数临床条件下可以不用考虑,但由于其紧贴上皮组织,所造成的散射和电子不平衡的影响必然使得上皮组织(尤其是0.3mm以内的部分)剂量升高,加上支架本身的弹性,当最靠近支架的组织死亡后,后面的组织将进一步靠近支架,接受到较高的剂量,这也是临床上能观察到使用食管支架放疗后不良反应增加的原因。因此散射线和次级电子不平衡的影响是金属支架置入术后患者放疗处方剂量时需主要考虑的,但若使用的是带膜金属支架(即支架外有一层一定厚度的非金属膜),则这一影响可降至相当低的水平。临床应用胆道支架的文献中,李玉等在评价31例肝门部胆管癌患者行金属支架置入联合立体定向适形放疗的疗效时未发现明显胆道反应,故认为尤其是在多野照射时,放置金属支架对射线的影响可基本忽略;Crane等的研究中52例不能切除的肝外胆管癌接受放、化疗联合治疗,其中43例放疗前置入内支架,结果仅3例发生可处理的胆管炎。
(三)调强和适形放疗
胆管癌属适合应用调强放疗(IMRT)的肿瘤之一,这是由于其周围的重要结构如脊髓、肾脏和肝脏通过IMRT技术可以得到有效的保护。放射对于小肠、肝或肾的毒性既与剂量相关,也与容积相关。应用IMRT技术,剂量和容积的限制可预先设定,由治疗计划软件来优化布野,以尽量满足所有的限制条件,获得最佳的剂量分布,提高放疗的增益比。
在胆管癌的调强放疗计划中,要注意把小肠也列入需保护的器官而事先勾画出来,对其给出容积上的限制,因为倘若只予剂量限制,IMRT计划往往会用大容积的正常组织接受低剂量的照射来换取重要结构的保护。对于小肠而言,相对较大的容积暴露于低剂量(5~15Gy)中也会导致放射损伤。小肠的勾画范围是除肝脏、肾脏、胰、脾、胃、腹主动脉及下腔静脉等血管之外的腹腔内肠管。
调强放疗剂量目标函数包括:双肾尽可能接受最小剂量(限10%~20%的左肾接受剂量>12Gy,但必须<30Gy;限25%~30%右肾接受剂量>20Gy);脊髓限制剂量为40~45Gy;1/3的肝脏体积接受剂量<50Gy;<5%的胃、小肠体积接受>50Gy的照射剂量。通常好的IMRT计划还需符合:只有<5%的靶区接受了<95%的处方剂量;仅有<1%的靶区接受了>115%的处方剂量。Milano等报道采用IMRT治疗胆管癌患者,对于未切除的肿瘤中位处方剂量为59.4Gy;已行切除术者,瘤床和区域淋巴结的中位处方剂量为50.4Gy。
由于条件的限制,国内开展更多的是适形放疗,主要用于不宜手术、病灶境界清楚的患者。经CT定位扫描后,将数据传输至三维治疗计划系统(TPS),根据勾画出的靶区,可设5~8条非共面固定射线束,并用铅模或多叶光栏使射野从入射角度与肿瘤相适形。剂量-体积直方图(DVH)是选择最佳治疗计划的重要依据,尤其要注意重要器官的受照体积和剂量。国内多篇文献均对局部晚期不能手术的胆管癌患者采用立体定向低分割放疗,单次剂量4~8Gy,间隔1~3d,总剂量为40~60Gy,80%~90%的等剂量曲线包绕PTV,得到的中位生存时间均较不放疗单纯姑息性引流治疗的患者显著延长,但从不良反应来看,放疗剂量超过50Gy的患者上消化道溃疡出血的发生率明显增加,是与低分割有关,还是和靶区的勾画或金属内支架有关,有待于进一步研究。
十一、疗效
(一)放疗联合手术
1.术前放疗 术前放疗应用较少。Gonzalez等报道了71例经手术切除的近端肝外胆管癌患者,在随访期内19例接受术前+术后放疗的患者均无手术瘢痕复发,仅接受术后放疗的51例患者手术瘢痕复发率为15%。Genhards等在研究中发现术前行胆管引流术者,20%在术后1年出现种植性转移,随后他们对19例此类患者行术前肝门区照射(3.5Gy/次,1次/d,共3次),结果发现在2~79个月的随访期内无一例发生种植性转移。
尽管从理论上及其他肿瘤应用的经验上来看,术前放疗具有降低肿瘤细胞的活性,减少术中转移及缩小肿瘤,增加手术切除机会的优点,但外科医生始终认为术前接受放疗会增加手术难度和术后并发症。由于缺乏大样本的前瞻性研究资料,此观点孰是孰非亦无定论。
2.术中放疗 由于受到周围正常组织的剂量限制,放疗失败的原因主要是肿瘤局部复发和未控。术中放疗可有效地提高靶区总放射剂量、降低危险器官受量,以减少并发症,从而在一定程度上达到降低复发率、提高局控率的目的。日本的Abe等在1980年首次报道了术中放疗局部晚期肝门胆管癌,但术中放疗的缺点是只能作单次照射,故其后发展了术中联合术后外照射,以克服单次照射量不足的缺点。Hiromasa等采用术中放疗治疗了35例肝外胆管癌患者,其中16例结合术后放疗,结果总的1、2、5年生存率分别为57%、43%、19%;术中+术后放疗的患者5年生存率(50%)明显高于单纯术中放疗者(P=0.038)。Todoroki等总结了筑波大学23年的经验,认为术中放疗对于切缘阳性的胆管癌患者有肯定的疗效,结合术后放疗则疗效更佳。
3.术后放疗 目前尚无评价肝外胆管癌患者根治术后放疗的前瞻性随机研究资料,但多数回顾性分析资料表明术后放疗对改善生存率有显著意义。1990年欧洲癌症研究与治疗组织分析了55例肝门胆管癌患者(其中52例切缘阳性),17例仅接受手术治疗与38例接受术后放疗者相比,两组的中位生存期分别为8.3个月和19个月,1、2、3年生存率分别为36%、18%、10%和85%、42%、30%(P<0.01)。近年也有不少文献提示切缘阳性的胆管癌接受术后放疗可提高生存率,而切缘阴性者则并无获益。Schoenthaler等报道的129例肝外胆管癌患者中,镜下切缘阳性的病例经术后放疗中位生存时间从单纯手术的11个月延长到21.5个月;Kim等的研究表明切缘阴性(R0)与阳性(R1)患者放疗后的5年生存率及中位生存期分别为36%、25个月和35%、24个月(P=0.78);Stein等的研究也发现接受了术后放疗的淋巴结阴性的肝门胆管癌患者,即便镜下切缘阳性也能获得和切缘阴性者相似的预后,因而得出术后放疗有益于镜下切缘阳性的根治术后患者的结论。
(二)放疗联合化疗
由于胆管系癌周围有很多对放射敏感的脏器,因此外照射剂量有一定限制,联合应用化疗旨在提高肿瘤细胞对放射的敏感性,在放疗剂量较低时亦能达到肿瘤局部的控制,从而提高疗效。Moon等报道了关于5-Fu对肿瘤细胞敏感性影响的研究。该研究就是为了评价2例确诊胆管细胞癌(M2-chA-2和SK-chA-1细胞)的患者放疗及同步5-Fu治疗的效果。正如先前所了解的那样,SK-chA-1细胞较M2-chA-2细胞具有显著的抵抗放疗和5-Fu的作用。采用克隆源性生存期作为细胞杀伤的终末指标,结果显示对于各个细胞系来说,5-Fu在LD50的剂量都能显著增强放疗引起的细胞杀伤作用,合用5-Fu患者只需普通患者放疗剂量的37%(此即为增敏率,ER)。在各个细胞系中,放疗后使用5-Fu的ER都要比放疗前使用来得高;使用5-Fu时间长者放疗杀伤作用就强;放疗抵抗的细胞系的ER比放疗敏感的细胞系要显著的高。这些发现都在胆管癌的多学科治疗中确立了放疗合用5-Fu的价值,且低剂量长时间的使用5-Fu可能对放疗的增敏最有效果。
不过在临床应用中,放、化疗同步的疗效还是存在争议。Kopelson等在1977年首次报道了放疗联合化疗可提高肝外胆管癌患者的疗效;Foo等的研究则提示同步5-Fu化疗有延长生存的趋势;Serafini等在治疗了192例胆管癌患者后发现放、化疗综合治疗可改善预后,特别是可延长远端胆管癌切除后的生存期(41±24.8个月比25±20.1个月)。Kim等分析了84例术后放疗的胆管癌患者,其中13例未行化疗,10例仅放疗时联合化疗,61例不仅同步放、化疗,放疗结束后还继续维持化疗1年,3组的5年生存率分别为9%、0%和41%,单因素分析提示同步并维持化疗可提高生存率,但多因素分析则无显著差异。Alden和Mohiuddin及Crane等的研究则未发现加用化疗对改善预后有统计学意义。
然而由于胆管癌不易早期发现,侵袭性较强,易早期转移,故只要患者一般情况可耐受,还是建议要结合化疗。同步放疗增敏以单药5-Fu为主。
(三)姑息性放疗
对于胆管癌而言,目前手术切除仍是其根治的唯一方法,但因其症状隐匿,确诊时多已晚期,往往失去根治切除的机会。肝门部胆管癌因所处位置解剖关系复杂,完整切除率仅20%~30%,近年有文献报道提高到50%;相比之下,中下端胆管癌更适于手术切除,一般切除率为50%~60%,最高可达80%以上。Jarnagin等回顾性分析了MSK癌症中心收治的225例肝门部胆管癌的患者,2/3患者术前影像学检查认为可切除,然而其中仅接近半数真正实施了根治手术,可还是有约20%的患者切缘阳性。对于丧失手术机会或仅接受姑息性切除或引流术的患者,放疗是缓解症状、提高生活质量和延长生存的有效治疗手段。单纯胆管引流的患者中位生存期仅2~4个月,而在有效的胆管引流基础上结合放疗可使生存时间延长到10~16.8个月。
多数文献倾向于胆管腔内近距离放疗作为增量手段与外照射联合应用,其疗效好于两者分别单独应用。Milella等比较了不能手术的肝外胆管癌患者接受外放疗结合腔内放疗或单纯外放疗两者间的疗效差异,中位生存期分别为14个月和11个月;Morganti等的研究也提示了外放疗与腔内放疗两者结合的优势,中位生存期分别为13个月和6个月(P=0.08)。
胆道金属内支架置入术目前已成为恶性梗阻性黄疸的首选姑息性治疗方法,腔内近距离放疗可延长支架的开放时间。复旦大学附属中山医院放射科采用前瞻性方法研究了34例放置胆道支架的恶性梗阻性黄疸患者,其中接受腔内放疗组14例,对照组20例,两组平均支架开放时间分别为12.6个月和8.3个月(P<0.05)。
十二、放疗反应及并发症
体外放疗早期最常见的不良反应多为不超过2级的消化道反应,如食欲不振、恶心呕吐、腹痛或腹泻等,对症处理即可缓解。晚期并发症主要是胃肠道的出血和狭窄,发生率往往随着照射剂量的增加而升高。
腔内放疗的晚发性损伤有十二指肠溃疡、穿孔、胆管炎、胆管出血和胆道狭窄。放射性胆管狭窄的发生率随患者生存期的延长而升高,且多由于单次剂量过高所致,因此腔内照射单次剂量以<8Gy为宜。
术中放疗由于肝实质、肠管和肝的切断端都包括在射野内,在过量放射后,可发生肝动脉狭窄或闭塞、动脉瘤形成、胆管炎、肠穿孔和肝脓肿等。
十三、问题与展望
由于胆管癌总的发病率较低,缺乏大样本前瞻性的随机分组研究,因此有许多存在争议的问题,如根治术后放疗的价值,放疗的剂量效应关系,放、化疗联合的意义及化疗药物的选择、外放疗与腔内放疗或术中放疗结合的疗效等。解决这些问题只能靠加强多中心合作以及外科、内科和放疗科等各科室之间的紧密合作。
随着放疗新技术的发展,将有可能安全地给予肿瘤靶区更高的剂量以提高局控率。此外,新型的放射增敏剂的研发,也有望进一步提高放疗的疗效。近年来成为肿瘤领域研究热点的靶向治疗也将给不能手术的胆管癌患者带来希望。
(孙 菁)
参考文献
1.王炳生,秦净,邓杰,等.上海市胆道癌诊治情况的调查和分析.中华外科杂志,2005,43(7):455~459
2.石景森,杨毅军,赵凤林,等.原发性胆囊癌44年诊治的临床回顾.外科理论与实践,2001,6(3):137~141
3.Clifford KS等编著,王淑莲等译.放射肿瘤学:治疗策略与实施.天津:天津科技翻译出版公司,2001.318~321
4.徐立宁,邹声泉.胆囊癌分子生物学研究现状及前景.实用肿瘤杂志,2005,20(1):7~9
5.徐隽,宋彬,严志汉,等.胆囊癌腹部转移淋巴结分布特征的CT、MR表现探讨.中国普外基础与临床杂志,2003,10(1):64~68
6.高汝贵,蒋世良.胆系癌.见:刘泰福主编.现代放射肿瘤学.上海:复旦大学出版社,2001:393~398
7.钱振宇,王炳生,邓杰,等.上海市区195例胆管癌临床分析.外科理论与实践,2003,8(2):107~110
8.刘小方,周先亭,邹声泉.八所医院胆管癌680例分析.中华肝胆外科杂志,2004,10(11):773~775
9.陈汝福.胆管癌.见:焦兴元,任建林主编.消化系肿瘤学:新理论、新观点、新技术.北京:人民军医出版社,2004.327~380
10.王炳生.胆管癌诊治的若干问题.外科理论与实践,2005,10(4):306~308
11.秦兴雷,王作仁,鲁敏,等.肝外胆管癌临床病理特征与预后的关系.第四军医大学学报,2005,26(5):434~437
12.张建英,曾昭冲,孙菁.体内金属植入物对放疗剂量分布的影响及物理分析.中国医学物理学杂志,2005,22(3):505~507
13.李玉,王宁,田起和,等.金属支架联合立体定向适形放疗治疗肝门部胆管癌.中华放射肿瘤学杂志,2005,14(1):39~41
14.闫英,李玉,田启和,等.局部晚期胆管癌立体定向低分割放疗的疗效分析.临床肿瘤学杂志,2003,8(3):188~192
15.吴德华,陈龙华.胆管癌三维适形放射治疗疗效观察.第一军医大学学报,2003,23(11):1217~1218
16.Tsukada K,Kurosaki I,Uchida K,et al.Lymph node spread from carcinoma of the gallbladder.Cancer,1997,80(4):661~667
17.Matsuba T,Qiu D,Kurosawa M,et al.Overview of epidemiology of bile duct and gallbladder cancer focusing on the JACC study.J Epidemiol,2005,15(Suppl 2):S150~156
18.Fong Y,Kemeny N,Lawrence T.Cancer of the liver and biliary tree.In:DeVita V,Hellman S,Rosenberg S editors.Cancer of the liver in biliary tree.6thed.Philadelphia:Lippincott,Williams and Wilkins.2001.1162~1203
19.Jarnagin WR,Ruo L,Little SA,et al.Patterns of initial disease recurrence after resection of gallbladder carcinoma and hilar cholangiocarcinoma:Implications for adjuvant therapeutic strategies.Cancer,2003,98(8):1689~1700
20.Czito BG,Hurwitz HI,Clough RW,et al.Adjuvant external-beam radiotherapy with concurrent chemotherapy after resection of primary gallbladder carcinoma:A 23-year experience.Int J Radiation Oncol Biol Phys,2005,62(4):1030~1034
21.Cho JY,Paik YH,Chang YS,et al.Capecitabine combined with gemcitabine(CapGem)as first-line treatment in patients with advanced/metastatic biliary tract carcinoma.Cancer,2005,104(12):2753~2758
22.Doval DC,Gupta SK,Awasthy BS,et al.Survival and treatment trends in gallbladder cancer-a retrospective study of 117cases of gallbladder cancer from 2centers in India.Proc Am Soc Clin Oncol,2003,22(10):1237a
23.Lindell G,Holmin T,Ewers SB,et al.Extended operation with or without intraoperative(IORT)and external(EBRT)radiotherapy for gallbladder carcinoma.Hepatogastroenterology,2003,50(50):310~314
24.Houry S,Barrier A,Huguier M.Irradiation therapy for gallbladder carcinoma:recent advances.J Hepatobiliary Pancreat Surg,2001,8(6):518~524
25.Kresl JJ,Schild SE,Henning GT,et al.Adjuvant external beam radiation therapy with concurrent chemotherapy in the management of gallbladder carcinoma.Int J Radiat Oncol Biol Phys,2002,52(1):167~175
26.Macdonald OK,Crane CH.Palliative and postoperative radiotherapy in biliary tract cancer.Surg Oncol Clin N Am,2002,11(4):941~954
27.Dvorak J,Jandik P,Melichar B,et al.Intraluminal high dose rate brachytherapy in the treatment of bile duct and gallbladder carcinomas.Hepatogastroenterology,2002,49(46):916~917
28.Qin XL,Wang ZR,Shi JS,et al.Utility of serum CA19-9in diagnosis of cholangiocarcinoma:in comparison with CEA.World J Gastroenterol,2004,10(3):427~432
29.Kim S,Kim SW,Bang YJ,et al.Role of postoperative radiotherapy in the management of extrahepatic bile duct cancer.Int J Radiat Oncol Biol Phys,2002,54(2):414~419
30.Crane CH,Macdonald KO,Vauthey JN,et al.Limitations of conventional doses of chemoradiation for unresectable biliary cancer.Int J Radiat Oncol Biol Phys,2002,53(4):969~974
31.Milano MT,Chmura SJ,Garofalo MC,et al.Intensity-modulated radiotherapy in treatment of pancreatic and bile duct malignancies:toxicity and clinical outcome.Int J Radiat Oncol Biol Phys,2004,59(2):445~453
32.Baglan KL,Frazier RC,Yan D,et al.The dose-volume relationship of acute small bowel toxicity from concurrent 5-Fu-based chemotherapy and radiation therapy for rectal cancer.Int J Radiat Oncol Biol Phys,2002,52(1):176~183
33.Stein DE,Heron DE,Rosato EL,et al.Positive microscopic margins alter outcome in lymph node-negative cholangiocarcinoma when resection is combined with adjuvant radiotherapy.Am J Clin Oncol,2005,28(1):21~23
34.Morganti AG,Trodella L,Valentini V,et al.Combined modality treatment in unresectable extrahepatic biliary carcinoma.Int J Radiat Oncol Biol Phys,2000,46(4):913~919
35.Chen Y,Wang XL,Yan ZP,et al.HDR-192Ir intraluminal brachytherapy in treatment of malignant obstructive jaundice.World J Gastroenterol,2004,10(23):3506~3510
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




