第十一节 放疗中值得注意的问题
一、放射野的布局
肝癌放疗野的设计很重要,一个原则就是要充分利用正常肝组织具有很强的再生能力。我们在设计放射野时,务必保留一部分正常肝组织不受放射,在大部分肝脏受放射损伤时,这部分正常肝能得到再生。究竟正常肝受到多少量的射线就失去分裂再增殖的能力,我们还不清楚,但我们从临床发现,多野放疗,其放射性肝炎的发生率高。我们对最近几年发表的有关肝癌放疗论文,也看到适形放疗引起的放射性肝炎高于非适形放疗(表8-7和表8-8)。为何多射野的适形放疗会导致放射性肝炎发生率高?这是因为适形放疗,把部分正常肝组织受到射线的剂量,较平均分散到所有的肝组织中,导致受辐射的肝细胞失去分裂增殖的能力。图8-27(见插页)是适形放疗多射野与平行对穿两个射野的剂量分布图,我们认为放射野的正确选择应该是A,因为需要一部分正常肝组织不在放射野内,这部分才有可能日后再增殖。图8-28(见插页)是接受放疗前与放疗后,左肝组织受到保护,半年后左肝代偿性增生,患者的肝功能一直保持在正常水平。
表8-7 常规分割、适形放疗放射性肝病(RILD)的发生率与死亡率
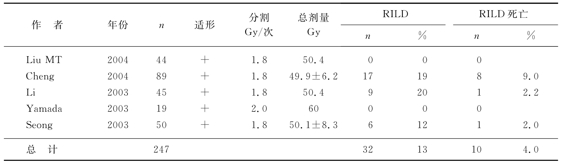
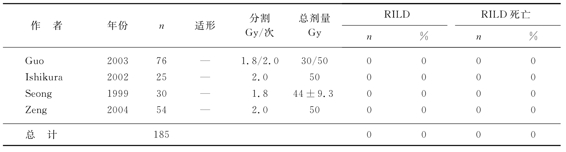
表8-8 常规分割、普通放疗放射性肝病(RILD)的发生率与死亡率
二、分割剂量
肝细胞癌的α/β值>11Gy,而正常肝细胞的α/β值为1~2Gy。肝癌的放疗究竟用低分割好,还是常规分割好?我们如果用L-Q模式BED=nd[1+d/(α/β)],将6Gy/次连续9次的低分割转化为常规分割剂量,我们即可计算出,当α/β值介于1~2Gy时(正常肝组织),其受照射的剂量相当于常规分割剂量的108~126Gy,而α/β值介于12~16Gy(相当于肝细胞癌)时,肿瘤组织受放射的量仅66~69.4Gy,也就是低分割放疗对正常肝组织的损伤重于对肿瘤的杀伤。实际上,临床观察到的也是这样的情况,表8-7为常规分割、适形放疗的患者,其放射性肝炎的发生率与死亡率分别为13%和4.0%;表8-8为常规分割、普通放疗(非适形),其放射性肝炎的发生率与死亡率均为0%;表8-9为低分割、适形放疗,其放射性肝炎的发生率与死亡率高达14%和9.0%。因此,我们不主张对肝细胞癌患者进行低分割放疗。
表8-9 低分割、适形放疗放射性肝病(RILD)的发生率与死亡率
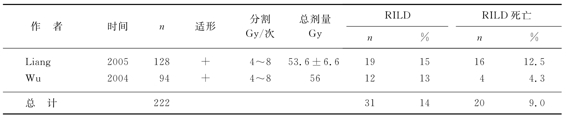
有趣的是,接受适形放疗的患者,其放射性肝炎发生率高于非适形放疗患者的发生率。这是因为适形放疗采取多放射野以求靶区剂量均匀,结果正常肝组织普遍受到剂量不等的放射,肝细胞再增生能力受影响,而普通放疗的设野简单,留有正常肝组织在放射野外,得以代偿性增生。
结论:肝细胞癌患者不适宜接受低分割放疗,放射野设计必须考虑留有正常肝组织不受到放射。
三、肝内肿瘤放疗为何需要结合TACE
TACE是建立在如下的理论基础上:①肝癌血供95%来自肝动脉;②正常肝组织血供25%~30%来自肝动脉,70%~75%来自门静脉;③肝动脉栓塞导致肝肿瘤血供减少90%,且缺血坏死;④局部药物浓度可比全身浓度高达100~400倍;⑤肝内化疗药物毒副作用降低。由此可见,肝动脉即使被栓塞,肝脏的血供仍可来自门静脉,故对不能手术切除的肝内肿瘤,只要是动脉血供丰富,又不存在门静脉完全阻塞,或是阻塞但侧支循环已形成,均需要进行肝动脉碘油栓塞化疗。可是,这种治疗对绝大部分患者而言,只是姑息性治疗,因为肝癌的血供还有来自门静脉。外放疗可以和介入治疗结合,互补优缺点。
介入治疗结合外放疗治疗肝细胞癌,有4个好处:①减少(reduction)肿瘤负荷,从而减少放疗剂量;②治疗与发现(revelation)肝内小病灶,使得放疗能局限在肝内大的肿瘤,减少正常肝组织受照射的体积;③碘油的沉积有利于在模拟机下定位和验证(re-verification);④碘油阻断动脉血供,细胞乏氧死亡或肿瘤体积缩小,原乏氧细胞得到再氧供(re-oxygenation),类似抗肿瘤血管生成的效果,可能使肿瘤细胞对射线更加敏感。我们称为肝癌放疗的4个“R”。
四、肿瘤的病理变化
凋亡是放疗引起肿瘤细胞死亡的主要形式,也有人称之为渐进性死亡,细胞需经过一次或数次分裂后才死亡。因此肿瘤细胞增殖越快,受到辐射后越容易死亡,放疗后肿瘤缩小也快。但是,有些肿瘤细胞受放射后并不马上进入细胞分裂,而是停留在G2期,我们称为G2期延迟。在这个时期,细胞不仅可以避免其分裂后死亡,而且有足够的时间对受损伤的DNA进行修复,属于自我保护。目前研究认为细胞分裂调控基因使受辐射的细胞停留在G2期。G2期细胞虽不分裂,但细胞内的一系列合成仍存,如DNA的复制、细胞器的产生等。54例接受外放疗后,11例得到二期手术切除机会,我们对肝癌放疗后进行二期手术切除的标本进行病理分析,6例在其肿瘤标本中找到残存癌细胞。这些残存的癌组织中有大量的多核巨细胞存在(图8-29,见插页),与其放疗前的肿瘤细胞比较,放疗后的肿瘤细胞体积巨大(增大15~60倍),胞质多且染色淡,但核仁浓染,核体大且为多核,故得名为多核巨细胞。多核巨细胞的形成是G2期延迟的结果。肝细胞肝癌是最具典型的凋亡细胞(详见第二章第三节)。在过去由于对凋亡现象认识不清,把肝细胞癌归为放射不敏感,颇为可惜。
五、外放疗实验室指标的变化
肝癌外放疗出现实验室指标变化主要是丙氨酸氨基转移酶在放疗结束或以后1~2个月以内升高,如果放射野包括部分肝脏,有70%的患者出现这种反应,但转氨酶均不超过正常值的2倍,白细胞下降[(2~4)×109/L]者约31%。
外放疗会明显抑制患者T细胞功能,表现在T细胞亚群进一步紊乱。表8-10是我们近两年检测原发性肝癌患者放疗前后T细胞亚群的变化。原发性肝癌与其他肿瘤相似,均存在T细胞亚群紊乱,外放疗前后,CD4+、CD8+淋巴细胞亚群均值及CD4+/CD8+的比值分别为30.3%±1.3%比18.9%±1.2%、24.6%±1.2%比24.7%±2.2%、1.32±0.08比0.92±0.13,可见外放疗前后CD4+T细胞明显减少,以致CD4+/CD8+也随之下降。外放疗导致T细胞亚群进一步紊乱的报道在20世纪80年代就有,我们的结果与这些报道相似。
表8-10 外放疗前后T细胞亚群的变化
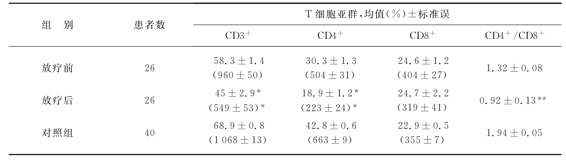
注:与放疗前的数值比较,*代表P<0.001,**代表P<0.05。括号内的数值代表T细胞的绝对值。(https://www.xing528.com)
AFP的变化可以作为肝癌患者治疗效果的评价指标,我们发现AFP阳性患者超过一半出现放疗中AFP一过性上升,一般表现在开始放疗后第2~4周,这些患者在放疗结束后AFP才明显下降。我们观察42例AFP阳性接受外放疗的肝癌患者,22例(52%)出现放疗后AFP一过性上升(图8-6中的AFP动态变化为AFP一过性上升的典型表现)。如AFP一过性上升后下降至低于放疗前水平,其获二次手术切除的机会较大。对放疗后AFP不能转阴者,二次手术切除后,其预后差。因此,患者在放疗中出现AFP上升,不应认为肿瘤在进展,应该观测到放疗结束。
我们对放疗后出现AFP一过性上升这一现象的机制不甚了解。从目前的知识水平,可以推测其与肿瘤细胞放疗后胞质内物质代谢旺盛和再增殖加速有关。Trott报道鳞状细胞癌放疗后第1周出现延缓生长,第2周出现细胞加速生长。Wither也有同样的报道。这种变化与我们观察到的AFP出现一过性上升,在时间上是一致的。多核巨细胞有很旺盛的代谢率。所以,我们亦推测AFP呈一过性上升与放疗引起的多核巨细胞代谢旺盛有关。Puck也报道过,放疗12Gy,多核巨细胞数在放疗后第9~21天最多。这种现象与我们观察到的AFP一过性升高在时间上很接近。
六、呼吸门控的应用
主动呼吸控制系统(ABC)是在放疗时,将呼吸临时暂停在呼吸周期的某一阶段(通常是吸气末),有效减少放疗过程中由于呼吸运动导致的靶区运动。我们应用依科达呼吸门控系统,初步探索ABC应用于肝癌三维适形放疗临床可行性,分析主动呼吸控制和自由呼吸状态下横膈和肝内靶区的动度。
依科达ABC包括手推车装置、患者呼吸系统、反光镜、控制模块、软件控制系统。患者呼吸系统包括吹口、过滤器、鼻夹、传感器涡轮和触发呼吸控制的气球阀门。传感器涡轮和气球阀门与控制模块相连接,传感器涡轮可检测流经呼吸管的气流量而形成流量曲线,当达到预先设置的门槛体积时触发气球阀门呼吸控制。患者首先接受30~45min使用ABC训练,测得患者最大屏气时间。放疗时可通过反光镜看到治疗床前手推车装置上显示器的呼吸流量曲线。技术员通过另一连接控制模块的笔记本电脑显示屏观察患者呼吸周期,保证在呼吸控制时放疗。
13例原发性肝癌患者年龄<70岁、能耐受20s及以上屏气,均能耐受主动呼吸控制,以完成放疗模拟机下动态摄片。软件分析得到使用ABC时横膈运动范围<1mm,肉眼看不到横膈的运动。而自由呼吸时横膈在头尾端(CC)方向运动幅度12.2mm(6.2~19.9mm)。主动呼吸控制呼气和吸气末两CT图像融合得到GTV在三维方向上的动度为CC 11.7mm,前后方向运动(AP)3.0mm,左右方向(ML)3.7mm。模拟机动态片获得横膈在CC方向的动度与CT图像融合GTV在CC方向动度比较无差异(t=1.061,P=0.310)。
肝脏肿瘤由于受呼吸运动影响,增加了靶体积的不确定性,限制了肿瘤照射剂量和精度。Balter等认为由于肿瘤随呼吸运动,改变了位置,引起CT计划的不确定性是肝癌3DCRT的主要障碍。我们通过动态摄片和图像处理软件,可精确地测得ABC时横膈在CC方向动度<0.5mm,而肉眼下无法察觉,显示ABC对肝脏有很好的固定作用。自由呼吸时CC方向平均动度达到12.2mm,Davies等报道用超声扫描测量膈肌和肝脏在平静呼吸时上下方向(Z轴)平均动度分别为12±7mm(7~28)和10±8mm(5~17);于甬华等对84例原发或转移性肝癌动度的彩超测量CC 6~19mm,AP 0~6mm,ML 2~7mm。ABC可将呼吸暂停在呼气或吸气末进行CT扫描,通过TPS手动按照椎体解剖位置融合图像,可更精确地在同一坐标系中测得自由呼吸时GTV中心三维方向的动度。我们观察13例患者平均为CC 11.7mm,AP 3.0mm,ML 3.7mm;而Shimizu等将高速MRI应用于观察仰位单个肝脏肿瘤的移位,结果在CC、AP和ML上分别为21、8和9mm,显然呼吸导致肝脏运动主要表现在CC方向。由于13例患者自身生理、病理情况不同,GTV动度个体差异明显。根据肝脏动度可在常规放疗时尽可能地予以个体化的安全边界,最大限度减少了正常肝脏的损伤。假设肝脏是近似钢体模型,GTV动度可基本反映肝内任意点自由呼吸的运动范围。而我们动态摄片下膈CC方向与图像融合得到的肝脏CC方向动度无差异,说明CC方向膈、GTV的动度是一致的。
因此,肝内肿瘤自由呼吸放疗时,要充分考虑靶区随呼吸三维方向动度,GTV周围予以足够的安全边界,即PTV设计的治疗计划能够保证CTV接受足量的治疗剂量,但这是以增加正常组织并发症的概率为代价的。而肝脏放射耐受性差(全肝照射耐受剂量<35Gy),又进一步限制了靶区剂量递增,这也是放疗局部控制率低的重要原因。由此可见,减少呼吸运动对器官的影响在三维适形放疗中显得尤为重要。为了解决上述问题,放疗医生和物理师运用各种方法,如门控放疗、实时跟踪肿瘤、腹部加压、自主浅呼吸、呼吸不同阶段自主呼吸控制以及ABC等。ABC是在吸气相或呼气相达到预置肺容量时,患者气流被临时阻断,从而制动呼吸运动,并在制动期进行放疗,可有效减少放疗过程中靶区运动。Wong等在CT扫描和治疗时应用ABC以减少与呼吸运动相关的安全边界,取得了令人鼓舞的结果。他们认为ABC技术是减少呼吸移动较为简便的好方法,可有效提高3DCRT的精度。目前ABC主要应用于乳腺癌、肺癌和肝癌等呼吸影响较大的器官。虽然主动呼吸控制时对器官有很好的固定作用,但呼吸周期不同时相是否能完全代替器官位置,即短期重复性和长期重复性如何?多大程度上缩小临床靶区?还需进一步研究。
七、全肝放疗
目前我们主张对原发性肝癌给予局部放疗,不考虑全肝放疗,尤其是对介入治疗后,有肿瘤残存的区域(碘油沉积不佳)进行放疗。但是,有相当一部分患者治疗失败的主要原因仍然是肝内肿瘤未控,也就是进行局部放疗后,肝内肿瘤缩小,但放射野外又新生病灶。这些患者有一部分仍可以进行介入栓塞化疗,但有一部分成为介入治疗的禁忌证,特别是伴有门静脉主干癌栓的患者。
在临床实践中,我们发现既有肝内多发病灶,又伴有门静脉癌栓的患者,其治疗较为困难,因为这部分患者介入治疗后可能导致肝脏动脉和门静脉来源的血供缺失而出现肝衰竭,如不予治疗,肝内病灶很难控制。我们主张给予全肝的放疗,其放疗剂量视肝功能情况而定,如肝功能好的患者(Child-Pugh A),可以常规分割量到24~26Gy,如肝功能分级在Child-Pugh B,放疗剂量<20Gy,然后缩野至癌栓部位,继续放疗到40~50Gy。如果癌栓得到缓解,可以继续考虑对肝内病灶进行介入治疗。
全肝的放疗有前后平行对穿的方法,以保护肝外的胃肠道,也有切线野结合楔形板技术。目前已不再使用移动条技术,因为移动条技术的分割属于低分割,不仅不符合肝癌的放射生物学要求,还由于一部分肝癌细胞放疗早、一部分放疗晚(有可能先后相差2周),出现的时间差,使得迟接受放疗的肝癌细胞继续生长。因此,我们主张同一部位的肿瘤,应同时接受放疗,以减少放疗引起的促放射野外的肿瘤增殖加快。
所谓的放疗促肿瘤增殖加快,是放疗野外的肿瘤细胞,在放疗期间增殖较放疗前快,使得放疗前处于亚临床灶,放疗后表现为临床灶。其实,放疗促进肿瘤远处转移的动物研究早有报道,我们对肝癌荷瘤鼠的初步研究也支持放疗可以促进肿瘤远处转移(结果尚未报道)。认为外放疗促进肿瘤转移的主要依据是:①外放疗明显削弱机体的免疫力;②外放疗损伤瘤床间质,使肿瘤易于外侵;③随着肿瘤转移机制不断被揭示,血管生成在肿瘤生长及转移中起重要作用。
肿瘤放疗存在许多因素影响肿瘤血管生成。第一,是放疗早期,部分肿瘤细胞及间质受射线的损伤引起充血、水肿,导致瘤内压升高。瘤内压升高,血管受压迫,导致肿瘤局部缺血缺氧,显著上调某些血管生成因子的表达,结果加速血管生成。第二,肿瘤血管内皮细胞受射线的损伤,机体需要修复、再生,这种病理变化,刺激受损组织释放血管生成因子。目前已报道放疗能诱导血管生成因子显著升高,如VEGF和PD-ECGF水平在放疗后升高几十倍。第三,肿瘤原发灶可以抑制远处转移灶的生长,Folkman等人认为肿瘤会产生抑制血管生成环境,抑制转移灶生长,一旦原发灶被去除,转移灶生长加快。放疗后肿瘤缩小,肿瘤细胞再增殖加快是放疗失败的主要原因。
八、原发性肝癌放疗指征
原发性肝癌对放疗敏感,不能切除的原发性肝癌需要包括放疗在内的多模式综合。不能手术切除,但局限于肝内的肝细胞癌、伴有门静脉或下腔静脉癌栓的肝癌、出现淋巴结转移的患者,以及不能手术切除的肝内胆管细胞癌患者,分为接受与不接受外放疗两组,结果发现接受外放疗的患者其中位生存期分别延长5~6个月。对肝细胞癌出现肾上腺转移或骨转移患者,接受外放疗可以明显缓解症状。因此,这些患者应充分考虑放疗可能带来的好处,尽管放疗只起姑息作用,迄今还有什么方法能起根治效果?为此,我们很难道出原发性肝癌放疗的适应证,但我们很容易了解肝癌放疗的禁忌证,即肝功能为Child-Pugh C的患者,不适宜接受放疗。只要不是禁忌证,就应该考虑包括放疗在内的综合治疗。
九、放射性肝炎的诊断与处理
放射性肝炎的定义:严格来说,放射性肝炎与放射性肝病(RILD)不能混为一谈,RILD的表现可轻可重,轻者仅出现转氨酶轻度升高,患者没有任何症状,重者我们称为放射性肝炎,是RILD最严重的时期,也就是肝功能失代偿期。
放射性肝炎的表现:放射性肝炎发生的时间通常是放疗后4~8周(2周至7个月);其临床症状为疲乏、体重增加、腹围增大(腹水),有时出现右上腹不适。体征多为腹水、肝肿大(严重的患者)。化验检查显示天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)升高(正常值2倍),总胆红素不升,碱性磷酸酶上升3~10倍。
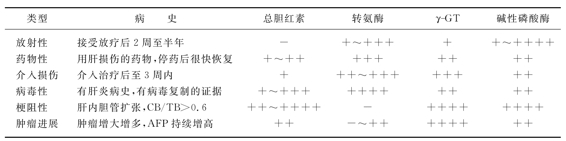
放射性肝炎的诊断:RTOG对肝毒性的分级诸如结合胆红素、γ-GT、清蛋白、AST或ALT、扑翼样震颤和肝昏迷,对诊断放射性肝炎几乎无临床意义。Lawrence 1992定义的放射性肝炎诊断标准:①典型的放射性肝炎,碱性磷酸酶(ALP)升高>2倍,无黄疸,排除肿瘤进展导致腹水、肝肿大;②非典型RILD,转氨酶超过正常最高值或治疗前水平的5倍。放射性肝炎必须与药物性肝炎、介入引起的肝损伤、病毒性肝炎发作、梗阻性黄疸和肝内肿瘤进展鉴别,表8-11可供参考。
表8-11 放射性肝损伤与其他形式的肝损伤的比较
放射性肝炎的治疗:目前对RILD或放射性肝炎的治疗,还没有一种共同的方案,一部分医生建议给予抗凝和激素治疗,但大部分医生还是倾向于保守治疗,施以利尿剂。如果病情不重,大部分患者接受治疗后的1~2个月,症状缓解。少部分患者发展为黄疸,腹水进行性增多,需要腹穿放水、利尿及抗凝治疗。这时期是典型的放射性肝炎表现,血清碱性磷酸酶、胆红素、凝血酶原时间明显升高,而ALT、AST只有中等度升高,患者的死亡率相当高,很少能存活下来。放射性肝炎患者是否需要用保肝药物治疗,目前还没有这方面的临床资料,从理论上说,保肝治疗对患者有益。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




