第一节 放疗及腹盆部肿瘤放疗的发展
1895年德国物理学家伦琴发现X线,1897年德国外科医生亚历山大·弗罗因德把放射线应用于毛痣的治疗,并使毛痣消失,从此揭开了放射治疗(放疗)的序幕。1899年,Thor Stenbeck在斯德哥尔摩首次治疗一位患有鼻背基底细胞癌的49岁女性,经过9个月100次的放疗,这位女性30年后仍然健在,这可能是最早的肿瘤放疗。早期的放疗,只能用电子线或能量不高的深部X线,其穿透力弱,仅用以治疗诸如皮肤癌、毛痣、脚癣等外表性疾患。因此,当时从事放疗工作的大多由外科医生兼职。随着对射线的认识,放射性核素镭也被用为放疗源,用以腔内肿瘤的治疗,或插植到肿瘤组织中。
第二次世界大战,推动着人们对放射线的研究,放射性同位素60 Co发出的γ线,其能量和穿透性比深部X线强,开始被应用于治疗一些稍微深部的肿瘤,如头颈部癌。与此同时,世界上第一台加速器在1940年面世,并于1948年开始用于临床治疗,当时只能发出平均能量为2.3MV的光子,与60Co的能量相当,故其治疗范围仍然局限于头颈部等浅表部位的肿瘤。不管是60Co发出的γ线还是当时的加速器发出的光子,均很难用于治疗腹盆部深部的肿瘤。
20世纪50年代以后,加速器得到不断地改进和发展,已能产生出高能X线,射线到达深部部位的肿瘤,能量不至于大幅减少。食管癌和肺癌的放疗得以开展,这是因为在常规的X线透视下,能直接看到食管、肺部的肿瘤部位,且其周围的正常组织对射线的耐受性好于胃肠道,接受70Gy的根治量放疗不至于出现严重的并发症。但由于腹盆部肿瘤在常规的X线透视下很难定位,且胃肠道黏膜对射线的耐受能力差,当时即使有了高能直线加速器,也很难用于腹盆部肿瘤的治疗。
20世纪70年代,计算机体层扫描(CT)的出现,不仅可以发现腹部的肿瘤,而且可以作为放疗定位的依据,80年代初即普及了二维放疗计划系统(TPS)。由于电子计算机技术飞速发展,很快渗透到放疗领域,CT图像的重组技术,使得三维适形放疗或立体定向放疗应运而生。由此派生出来的多叶光栅变形技术,产生了调强放疗技术甚至断层放疗(tomotherapy)设备,使得肿瘤接受的剂量更趋均匀。目前,又从三维适形放疗发展到四维(考虑到呼吸运动或多次摆位对靶区的影响)放疗。这些技术的出现,为腹盆部肿瘤放疗创造了很好的条件。
近些年,我国的放疗事业随着国家经济发展而得到飞速前进,放疗单位也发生根本性的变化。从20世纪20年代,镭锭和深部X线机集中在一个地方,形成所谓的镭锭医院,到50年代将价格昂贵的直线加速器集中在一个地方,由一个城市或多个城市共享一台直线加速器,以达到最大的使用率,通常安置在肿瘤专科医院内。如今,直线加速器主要集中在综合性医院,而以综合性医院为依托的肿瘤综合治疗中心正蓬勃发展,因为肿瘤患者的首诊不在肿瘤医院,肿瘤属于全身性疾病,肿瘤的治疗需要多学科的协作。到2001年止,全国共有放疗单位715个,放疗设备(直线加速器或钴机)1 000台。与1997年相比,2001年国内的直线加速器增长了1.9倍,治疗计划系统增长了2.15倍。按照这样的速度发展,我国目前应该有放疗单位超过1 000个,放疗设备(直线加速器或钴机)超过1 500台,而且主要集中在综合性大医院。放疗设备和人员的增加,拓展了放疗的适应证,以前因放疗设备和人员的匮缺,曾导致对腹盆部肿瘤放疗不重视,现在这样的情况正在逐步改变。综合性医院放疗科正在重视腹盆部肿瘤的综合治疗。
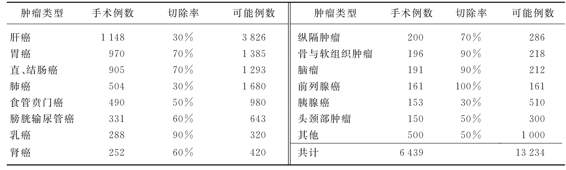
腹盆部肿瘤的放疗其实与肿瘤外科紧紧相连,表1-1为复旦大学附属中山医院2006年全年各种恶性肿瘤手术切除的例数,以及推算出不能手术切除的可能例数。这也说明没有外科医生的积极配合与支持,放疗科医生很难完成合理的综合治疗,这是因为大部分的腹盆部肿瘤对放疗不敏感,也就是单纯的放疗,需要70Gy以上的放疗剂量,这剂量本身就会对肿瘤周围的正常组织产生严重的毒副作用。由于对放射生物学的认识加深,临床放射生物学家已经探索出肿瘤体积、放疗剂量和肿瘤控制率这三者的关系。认为,同样的肿瘤体积或细胞数,放疗剂量越大,肿瘤的控制率越高;或者说,一定的放疗剂量,肿瘤越小,控制率越高。为了达到最大的控制率和尽可能小的放疗剂量,以便减少对正常组织的毒副作用,在放疗前应通过手术切除或其他手段最大限度减少肿瘤负荷。术后辅助放、化疗或术前的新辅助放疗就是基于这一放射生物学理论,以减少亚临床灶复发的可能性。
表1-1 2006年复旦大学附属中山医院手术切除各种恶性肿瘤数(https://www.xing528.com)
最近20年,随着外科手术水平不断提高,麻醉技术及围手术期处理的完善,以前难以切除的大肿瘤或淋巴结清扫,现在可以完全切除,为术后辅助放疗铺平了道路。如直肠癌的全系膜切除(TME),可以将肠系膜潜在的转移淋巴结清除,术后放疗盆腔淋巴引流区;肾癌术后可放疗瘤床和腹主动脉旁淋巴结;腹膜后软组织肿瘤术后,医生留有银夹标示,术后辅助放疗,可以明显减少术后肿瘤复发率和延长患者无瘤生存率和生存时间;肝细胞癌患者经介入结合放疗后,肿瘤缩小,再行序贯切除,使不能手术切除变为可手术切除,不能治愈成为可治愈;胃癌标准术式的确立等。
分子生物学的发展,同时也推动了放射生物学的进展,我们不仅深刻了解肿瘤受放疗后DNA的损伤与修复基因,而且认识很多的肿瘤基因的表达与预后的关系,并用于预测肿瘤放射敏感性或放射性损伤的标记。一些肿瘤标记物在放疗前、中、后的检测,可以随访其放疗的效果和预后。各种分子靶向治疗药物的出现,提高了肿瘤药物治疗的效果。实践证明,分子靶向药物有促进放疗的效果,不仅能起到放射增敏的作用,还可以控制放射野外的肿瘤。
最近几年,一些临床试验的报道,为腹盆部肿瘤放疗提供了循证医学证据。胃癌术后放疗的前瞻性随机分组临床试验,以Macdonald在2001年报道的(INT-0116)临床试验最重要,其术后放、化疗组的中位生存期为36个月,而不接受放、化疗的患者只有27个月,两组生存率有显著差别(P=0.005)。现在美国的胃癌治疗指南已经将ⅠB、Ⅱ、ⅢA、ⅢB、Ⅳ(M0)期的胃癌根治术后辅助联合放、化疗作为标准治疗方案。直肠癌方面,Pahlman等学者进行了一项多中心随机对照研究,提出直肠癌术前放疗比术后放疗更加有效。之后,在全世界范围内进行了多项大规模临床试验以明确术前放疗的有效性。荷兰的结、直肠癌组对1 805例直肠癌患者进行随机分组研究,一组是术前放疗组,给予5Gy/次,连续5次的放疗后结合全直肠系膜切除(TME)手术;另一组是仅接受TME手术,2年局部复发率分别是2.4%、8.2%(P<0.001),术前放疗组明显好于单纯TME手术组。瑞士的直肠癌临床研究组对1 168例可手术切除的直肠癌患者进行随机对照分组研究,术前放疗组给予低分割5 Gy/次,连续5次,放疗后1周内行手术,5年局部复发率为12%,而单纯手术组为27%,具有统计学意义(P<0.001)。循证医学证据表面,三维适形放疗可以降低前列腺癌的放疗毒副反应,从而提高前列腺癌的放疗剂量。对局部晚期的前列腺癌患者,结合内分泌治疗可以提高放疗的效果。在膀胱癌的保留膀胱方面,R9del报道自1982~2000年,共415例膀胱癌患者,T1高分级89例、T2~T4 326例,先接受经尿道膀胱肿瘤切除术(TUR),后予放疗(n=126)或放、化疗结合(n=289)。放疗结束6周复查,重新分期。如完全缓解,定期复查,如肿瘤无变化或进展,予补救性膀胱切除。结果是72%完全缓解,这些患者10年无侵及肌层为64%。所有患者10年生存率为42%;80%患者保留住膀胱,与膀胱癌根治切除的疗效相似。肝癌是我国的高发肿瘤,在回顾性治疗研究的基础上,复旦大学附属中山医院正在致力于不能手术切除肝癌介入结合与不结合外放疗的多中心、前瞻性、随机分组研究。这些结果,坚定了放疗科医生治疗腹盆部肿瘤的信心。
欧美等发达国家每百万人拥有直线加速器数量是我们的10倍,加上他们其他医疗设备比我们先进,因此,在开展腹盆部肿瘤放疗方面,欧美国家比我们普遍。随着我国直线加速器数量的不断上升、医院实力的强大,以及我国腹盆部肿瘤占全身恶性肿瘤55%的较大比例,腹盆部肿瘤的放疗,将成为我国综合性医院放疗科新的增长点和亮点。
(曾昭冲)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




