1)锂离子电池工作原理及结构
锂离子电池俗称“摇椅电池”,是由可脱嵌Li+为正、负极的二次电池,由正极、负极、电解液及隔膜,外加正负引线、电池壳、安全装置等组成的。正极材料一般为金属锂的化合物,如LiCoO2,LiNiO2,LiFeO2,LiWO2,LiMn2O4,LiFePO4等,负极材料一般为碳材料以及TiS2,WO3,NbS2,V2O5等化合物,目前硅等合金类负极也有部分应用,电解液一般由有机溶剂和电解质(锂盐)组成。以C负极、LiCoO2正极电池为例的电化学表达式[88]为
![]()
正极反应:
![]()
负极反应:
![]()
充电时,Li+从正极LiCoO2中脱嵌,经过电解质嵌入石墨晶体中,负极得到电子,正极处于贫锂状态;放电时,锂离子从石墨层脱嵌,又回到LiCoO2的晶格里,正极同时得到电子,负极处于贫锂状态。充放电的反应过程如图16.20所示[89]。
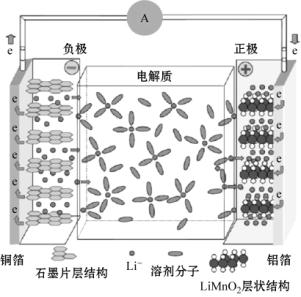
图16.20 锂离子电池充放电反应示意图
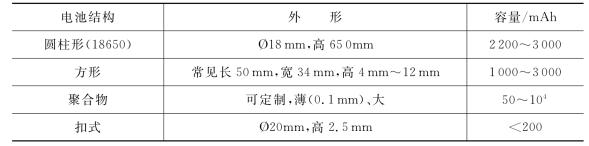
锂离子电池从外形上大致分为圆柱形和方形两种,此外还有扣式锂离子电池,聚合物锂离子电池可根据实际用途具有多变的尺寸[90]。
表16.4 常见锂离子电池结构参数
圆柱形18650电池是最常见的锂离子电池,如图16.21(a),被广泛用于笔记本电脑。方形电池[如图16.21(b)所示]通常性价比较高,同圆柱形电池一样盖子上有一个特殊加工的破裂阀,以防止电池内压过高,阀一旦打开,电池即失效。聚合物电池通过在扁平三明治结构中堆叠电极和电解液材料制作而成,也被称为叠层电池,如图16.21(c)所示,其主要优点是有多变的外形尺寸。
锂离子电池是利用Li+穿过电解液在正负极材料中的脱嵌进行储能,因此合适的电极材料和电解液是锂离子电池拥有优良性能的关键因素,图16.22列出常见锂离子电池材料的比容量和理论电压[91]。
2)锂离子电池各组件研究进展
(1)正极材料。

图16.21 常见锂离子电池结构(a)圆柱形锂离子电池 (b)方形锂离子电池 (c)聚合物锂离子电池 (d)扣式锂离子电池
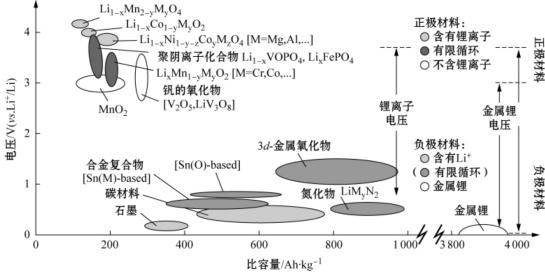
图16.22 锂离子电池正负极材料电位—比容量图
锂离子电池一般选择电位大于3.5V(vs.Li+/Li)的嵌锂过渡金属氧化物为正极。与负极材料的发展相比,正极材料的研究发展要相对滞后一些;正极比容量每提高50%,电池的功率密度将提高28%,因此正极材料的研究,对于锂离子电池的发展和改进有重要意义[92]。
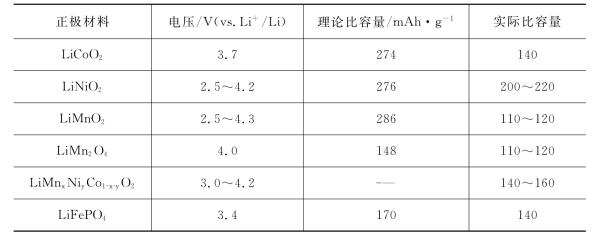
锂离子电池的正极材料按结构可主要分为三类:①层状结构,如LiCoO2、LiNiO2、LiMnO2等;②尖晶石结构,如LiMn2O4等;③橄榄石结构,如LixMPO4(M= Fe,Co,Mn)。表16.5列出主要集中锂离子电池正极材料的性能参数比较。
表16.5 常见锂离子电池正极材料的电压和比容量
1980年,Goodenough等[93]首次合成了能够可逆嵌脱锂离子的层状LiCoO2材料,1990年Sony公司推出首个采用LiCoO2作为正极材料的锂离子电池[94]。锂钴氧化物(LiCoO2)仍是现阶段商品化锂离子电池中应用最成功、最广泛的正极材料。其在可逆性、放电容量、充放电效率和电压稳定方面较好[95,96],目前商品化锂离子电池70%以上仍然采用LiCoO2作为其正极材料。LiCoO2一般采用高温固相法制备,该种方法工艺简单、容易操作、适宜于工业化生产,但是反应物难以混合均匀,需要较高的反应温度和较长的反应时间,能耗大,产物颗粒较大,形貌不规则,均匀性差,并且难以控制,从而导致电化学性能重现性差。
锂镍氧化物(LiNiO2)无过充或过放电的限制,具有高温稳定性好,自放电率低,无污染的特点,是继LiCoO2之后研究得较多的层状化合物,且价格比LiCoO2低。但LiNiO2制备困难,需要在富氧气氛下合成,工艺条件控制要求较高且易生成非计量化合物和无活性的立方晶系LiNiO2,极易导致材料的电化学性能下降。其次与LiCoO2一样,在充放电过程中会发生从三方晶系到单斜晶系的转变,造成容量衰减。并且,相变过程中排放的O2可能与电解液反应。法国SAFT公司已经推出了LiNiO2为正极材料的锂离子电池。
由于锰无毒,污染小,且锰资源丰富,比Co价格便宜很多,因此层状结构的LiMnO2和尖晶石型的LiMn2O4都是正极材料研发的热点。但是LiMnO2在循环过程中,晶型易转变为尖晶石型结构,使其比容量下降。研究表明通过改变掺杂离子的种类和数量及掺杂阴(阳)离子可改变放电平台、容量和循环性能。层状锰镍钴三元复合氧化物正极材料(也称三元材料)综合了LiCoO2,LiNiO2,LiMnO2三种层状材料的优点,其综合性能优于以上每一单一组分正极材料,存在明显的三元协同效应[97]:通过引入Co,能够减少阳离子混合占位情况,有效稳定材料的层状结构;通过引入Ni,可提高材料的容量;通过引入Mn,不仅可以降低材料成本,而且还可以提高材料的安全性。而LiMnxNiyCo1-x-yO2材料充放电平台略高于LiCoO2,适合现有各类锂离子电池应用产品,有望取代现有各类其他正极材料。三元材料的产业发展也显示了较好的势头。
1983年Thackeray等首次提出采用尖晶石结构LiMn2O4为锂离子电池正极材料[98]。LiMn2O4中Mn2O4框架是四面体与八面体共面的三维结构,Li从Mn2O4框架中嵌/脱过程中晶体各向同性地膨胀/收缩,晶体结构体积变化极小,可以发生完全的脱嵌锂。但是锰在电解液中会发生溶解,Jahn-Teller效应致使结构破坏[99]。
钒为多价态金属,与锂可形成多种氧化物,包括层状的LiVO2,LixV2O4,Li1+x V3O8和尖晶石型LiV2O4、反尖晶石型LiVMO4(M=Ni、Co)等。1957年Wadsley提出用层状Li1+xV3O8作为锂离子电池正极材料。层状Li1+xV3O8由八面体和三角双锥组成,锂离子位于八面体位置,与层之间用离子键固定,过量的锂占据层间四面体位置,这种结构使其循环性能非常稳定,但是材料的电导率低,电压平台较低,在2~3.7V之间存在多个平台,氧化能力强,易导致有机电解液分解。
锂铁氧化物体系中由于Fe4+/Fe3+电对的Fermi能级与Li+/Li的相隔太远,而Fe3+/Fe2+电对又与Li+/Li的相隔太近,因此层状LiFeO2一直未能得到应用。1997年Padhi等的开拓性研究揭开了橄榄石型LiFePO4研究的序幕[100]。LiFePO4材料来源丰富、成本低、比容量高、无污染,而且具有优异的热稳定性和稳定的充放电循环性能,以LiFePO4为正极材料的电池被业界称为“最安全的锂电池”,Thackeray认为LiFePO4的发现,标志着“锂离子电池一个新时代的到来”。因此LiFePO4正极材料被认为适合用于高功率型锂离子电池上,是电动汽车以及大型动力设备电源的理想正极材料。目前全球已经有很多厂家竞相产业化生产LiFePO4正极材料,如美国Valence(威能)公司和A123(高博),国内天津斯特兰,北大先行等。国内唯一的锂电池磷酸铁锂正极材料标准制定者贝特瑞公司生产的磷酸铁锂正极材料国内第一,目前全球第三,产能是1 500吨/年。咸阳偏转控股的咸阳威力克能源有限公司,2007年8月成功开发单体120Ah磷酸铁锂电池并使用到奥运大巴车上。美国A123公司已开发出2MW×0.25h的Hybrid-APU柜式磷酸铁锂电池储能系统。2009年开始,美国AES公司与A123公司合作,在其电网中安装了多个Hybrid-APU柜式储能系统,主要用于为电力系统提供包括频率控制在内的辅助服务。我国深圳比亚迪公司已开发出基于磷酸铁锂电池储能技术的200kW×4h柜式储能电站和1MW×4h储能示范站[101]。
(2)负极材料。
锂离子电池的商业化的成功主要功归于负极材料的突破。早期的金属锂负极由于存在安全问题不适用大规模商业生产。锂离子电池负极材料的种类很多,包括碳材料、硅基材料、锡基材料、钛酸锂、过渡金属氧化物等。
目前碳材料仍是应用的重点,可用于锂离子电池负极的碳材料可大致分为石墨、软碳和硬碳三类(见图16.23),包括天然石墨、合成石墨、碳纤维、中间相碳微球等。在锂离子电池负极材料中,石墨类负极材料以其来源广泛、价格便宜,一直是负极材料的主要类型,改性天然石墨、石墨化中间相碳微球(MCMB)、人造石墨占据了主要市场份额。

图16.23 常见锂离子电池负极碳材料示意图(a)石墨 (b)软碳 (c)硬碳
石墨是锂离子电池碳材料中应用最早、研究最多的一种,其导电性好、结晶度高、具有完整的层状晶体结构(见图16.23(a)),层与层之间以范德华力结合,很适合锂离子的嵌入与脱出。石墨分为天然石墨和人造石墨。天然石墨结晶度高,容量大,但是由于是以天然石墨以片状或鳞片状存在,形状是扁的,在涂布成电极片时,鳞片状颗粒大多以平行于集流体的取向存在,锂离子不能从基本面(002)嵌入/脱出,只能从侧面(110)进出,锂离子要绕道而行,锂离子在石墨中的扩散速率较慢,故不能以较快的速率进行充放电,大大限制了其实际应用领域。
软碳是指经高温处理可以石墨化的碳材料,通常都具有乱层的石墨结构[见图16.23(b)],随着热处理温度的升高,层与层之间无规则组织降低,在结构和嵌锂特性上与石墨相似,其中中间相碳微球(MCMB)和石墨碳纤维(MCF)的应用最为广泛。目前大部分商品化锂离子电池中都使用MCMB作为负极,容量比较高,充放电曲线平坦,与溶剂相容性比天然石墨要好,锂离子扩散系数比在石墨中高一个数量级[102],适合用作高功率电池的负极材料。MCF容量更大,高倍率放电性能更高,嵌锂碳可逆性更好,是高容量锂离子电池的首选负极材料,但需要在制造过程中控制其直径,得到稳定的产物。上海杉杉科技有限公司是国内MCMB材料的主要生产厂家。(https://www.xing528.com)
高结晶度的人造石墨化材料容量大,但循环性能差,容易造成电解质溶液分解,低结晶度碳材料在电解质溶液中稳定,但不可逆容量高,主要属于硬碳。硬碳是指高温下也难以石墨化的碳,主要是高分子化合物的热解碳,一般具有无定形结构[见图16.23(c)])。日本公开专利8-83610提出制备的石墨颗粒内部要有高的结晶度,以提高电极的容量,同时石墨颗粒要厚,接近于球形,能形成各向同性的形状,以提高石墨的充电和放电的性能,结合结晶度不同的两类各自的优点,既具有大的容量又要有高的充电/放电速度。
由于碳电极的电位与金属锂的电位很接近,当电池过充电时,碳电极表面易析出金属锂形成枝晶而引起短路,同时石墨负极理论比容量偏低(372mAh/g),已经不能满足日益拓展的应用领域的需求,具有高比容量、安全可靠的非碳类负极材料因而已成为当前负极材料研究开发的热点。非碳类负极材料主要分为三大类:锂金属氮化物和磷化物负极材料、合金类负极材料、氧化物负极材料等。
作为锂离子电池负极材料之一的锂离子氮化物LixMyN(M为金属),分为反萤石(CaF2)和Li3N两种结构,具有代表性的两种材料分别是Li7MnN4[103]和Li3-xCoxN[104]。Li7MnN4属于反CaF2型结构,在充放电过程中通过过渡金属价态变化来保持电荷平衡,比容量比较低(200mAh/g),但循环性能良好,充放电电压平坦,没有不可逆容量。Li3-xCoxN属于Li3N型结构,在0~1.4V电压范围内可逆脱嵌锂容量为760~900mAh/g,是石墨类碳材料理论容量的两倍多,而且密度与石墨相当。其的缺点是不稳定、对湿度敏感。
锂与Si,Sn,Ge,Pb,Ga,Al,Sb,Cd,In,Ag,Zn,Hg等金属可形成合金(LixM),其中某些合金在充放电过程中可实现部分可逆脱嵌锂过程,合金材料可避免锂枝晶的生长,提高锂离子电池的安全性,但是此类材料在脱嵌锂前后体积变化大,机械稳定性差,造成材料的粉化,丧失与集流体的电接触,导致负极材料的容量急剧衰减,循环性能差。有报道采用硅粉为负极,用镍钴酸锂为正极活性材料,组装18650电池12Wh体容量,3.5Ah容量。Canon、FujiPhoto、3M等公司都有从事这一方面的研究。松下在2012年度实现量产以硅系合金为负极的锂离子充电电池,电池单元是笔记本电脑用的标准“18650”(直径18mm×高65mm),容量高达4.0Ah,比现行相同尺寸单元的业界最高容量增加了近30%。
1997年日本富士胶片公司报道了一种锡基氧化物复合负极材料,该材料用于锂离子电池可以得到比石墨类碳负极材料高50%以上的比容量[105],金属氧化物作为负极材料引起了关注。早在1987年WO2,MoO2,VO2,TiO2等金属氧化物就被发现具有可逆的充放电能力[106,107],这类氧化物负极材料嵌锂后会发生结构改变,但不产生应变,循环性能好,脱嵌锂可逆性能较好,充放电平台高,比容量一般,适合应用于超小型二次电池。还有一类氧化物负极为过渡金属氧化物MO(M=Fe,Co,Ni,Cu,Mn等)[108~113],这类氧化物具有岩石盐结构,其嵌脱锂机理与传统的锂插入/脱锂或形成锂合金机理均不一样,在锂插入过程中,Li与MO发生氧化还原反应,生成Li2O,在脱锂过程中,Li2O与M能够可逆生成Li和MO,嵌锂后形成的Li2O具有电化学活性,能够可逆脱嵌锂,此类氧化物负极材料具有很高的贮锂容量(600~900mAh/g),比容量保持率高,但是与Li反应的电位太高,第一次放电在0.7V左右,后几次循环在1V左右。
尖晶石型的Li4Ti5O12也是目前研究和开发非常热的一种负极材料。1995年,日本科学家Ohzuku[114]研究报道了Li-Ti-O三元系化合物的电化学性能,该材料表现出极好的充放电循环稳定性能,首次充放电效率也接近100%。但考虑到Li4Ti5O12比容量较低、嵌脱锂电位偏高等特点,可用于开发超小型二次电池以及一些对容量要求不是很高的应用领域。目前,国内外都对这种材料的产业化兴趣浓厚。
国际上,负极市场主要的供应商包括中国的深圳贝特瑞新能源材料股份有限公司、日本的日立化成公司、三菱化学公司等。据调查国内深圳贝特瑞和上海杉杉的产品结构齐全占据中高低端市场,天津市贝特瑞新能源材料有限责任公司和湖州创亚动力电池材料有限公司以中高端市场为主,长沙海容以中低端市场为主。
(3)电解质。
电解质是电池的重要组成部分,是连接正负极的桥梁,其性能更是大大影响着锂离子电池的安全性能、循环性能、倍率充放电性能及储存性能等。电解质一般是由有机溶剂和电解质(锂盐)组成,可分为液体电解液、全固态电解质电池和凝胶型聚合物电解质电池。
液体锂离子电池的电解液一般是由有机溶剂和锂盐组成的,要求溶剂具有高的安全性、氧化稳定性、与负极的相容性、导电性,以及较高的介电常数和较低的黏度等特征。一般选用极性非质子溶剂,包括碳酸之类、羧酸酯类、醚类和含硫有机溶剂等,现阶段广泛应用的为碳酸酯系列(包括环状碳酸酯如EC和PC及链状碳酸酯如DMC,EMC),碳酸乙烯酯(EC)凭借优良的成膜作用,成为绝大多数电解液的主成分,目前锂电池使用的主要溶剂为EC为基础的二元或者三元混合溶剂,如EC+DMC,EC+DEC,EC+DMC+EMC等。锂盐必须在有机溶剂中易于解离,具有高的离子导电性,很好的热稳定性和化学稳定性,电化学稳定窗口宽,使用温度范围宽,同时与正负极材料和集流体有很好的匹配性和安全性。目前电解质有LiClO4,LiAsF6,LiPF6,LiBF4,LiCF3SO3,LiN(CF3SO3)2,LiC(CF3SO2)3,硼酸盐LiBOB等,其中六氟磷酸锂具有良好的导电性和电化学稳定性,是目前电解质的主流。还可以针对特定的电池体系,加入适当的添加剂以改善电化学性能,常见的添加剂有碳酸亚乙烯酯(VC)、氟代碳酸乙烯酯(FEC)、醌化合物染料、双(三甲基硅烷基)乙炔、氯硅烷等。
1973年Wright等首次发现了聚氧化乙烯(PEO)与电解质盐混合物具有离子导电性,Armand等则推动电解质进入了一个新的发展阶段。1996年,美国Bellcore公司公布了较为完备的聚合物锂离子电池的规模化生产技术。1999年以日本松下公司为首的6家电池公司开始联合开发生产聚合物锂离子电池,并率先实现了其商业化,随后日本、欧洲、美国及中国的多家公司相继投入到聚合物锂离子电池的开发和生产中,并在移动电话、笔记本电脑等多个领域得到应用。目前商品化的聚合物锂离子电池均采用凝胶型聚合物电解质,由于采用有机溶剂作为增塑剂,实际上是半固态电池,聚合物基体主要起支撑作用,离子传输在液相中进行。从本质上看,现有的凝胶型聚合物电解质电池只是对液体电解质电池的一种改良。电解质中有机溶剂仍然严重影响着电池的充放电性能、循环寿命,例如有机溶剂与电极相互作用在界面上形成钝化膜增大了界面阻抗,与正极在高温下分解的氧气发生反应,存在安全隐患,此外还严重降低了聚合物电解质膜的力学性能。
全固态电解质电池采用高离子电导率的固体电解质为隔膜,不会发生泄漏,极大地提高了锂离子电池在电动汽车和大容量蓄电池中的安全性,而且电解质中不含有任何有机溶剂,从而避免了有机溶剂带来机械性能差等问题,是真正意义上的固态聚合物电解质。用于全固态电池的电解质体系包括有机聚合物和无机化合物两类,前者以PEO为代表,通过各种改性技术,人们围绕这类材料已经开展了大量的研究工作,准确地说,PEO仅是一类完全固体化的溶剂,通过加入各种锂盐并利用聚合物分子链对锂离子的链式迁移作用,实现锂离子的导电,但总体来说这类电解质的导电性、稳定性有限,而且在聚合物电解质中锂离子的迁移数往往都不是很高,仍存在很高比例的阴离子的电导,所以这类电解质尚不能满足全固态电池的实用化要求。无机化合物锂离子电解质始终是人们研究的热点,主要包括氧化物和硫化物两类,近年来都取得了一定的突破,硫化物体系的导电性好,但稳定性较差,制备困难;氧化物虽稳定,制备较容易,但导电性相对较低。所以全固态电池的研究尽管很热,但要取得真正意义的突破仍极大地受固体电解质制约。
(4)黏结剂。
在电极中,粘结剂是用来将电极活性物质黏附在集流体上的高分子化合物,它的主要作用是黏结和保持活性物质,增强电极活性材料与导电剂以及活性材料与集流体之间的电子接触,更好地稳定极片的结构,对于在充放电过程中体积会膨胀/收缩的锂离子电池正负极来说,要求黏结剂对此能够起到一定的缓冲作用,因此选择一种合适的黏结剂非常重要。
传统的黏结剂是将聚偏氟乙烯(PVDF)分散在有机溶剂N-甲基吡咯烷酮(NMP)或者N,N-二甲基甲酰胺(DMF)中,其电子和离子导电性差,有机溶剂NMP,DMF易挥发、易燃易爆、毒性大污染环境,此外PVDF中含有氟,容易与嵌锂石墨等发生反应,导致锂离子电池性能下降,且本身对离子及电子的绝缘特性会增加锂离子电池的内阻,影响电池的性能。
与有机溶剂型黏结剂相比,水基型黏结剂具有无溶剂释放、符合环境要求、成本低、不燃、使用安全等特点,成为黏结剂行业的重要发展方向。目前常用的水基型黏结剂有酚醛树脂型、氨基树脂型、聚丙烯酸脂型、橡胶型乳液胶、乙烯-乙酸乙脂型等。采用1%丁苯橡胶(SBR)/1%羟甲基纤维素(CMC)为黏结剂制备的硅负极材料循环性能优于PVDF作黏结剂的传统电极[115]。采用海藻酸钠为黏结剂时,由于海藻酸钠上的羟基和羧基与活性材料存在着相互作用,也可大幅度提高电池循环性能[116]。
(5)隔膜。
在锂离子电池中,隔膜的作用是将正极和负极隔开,避免两个电极接触因而发生短路,并给锂离子提供足够多的孔隙,使得Li+能从孔隙顺利通过,一般要求孔隙率在30%~60%范围,同时还对电解质溶液具有一定的亲合能力,以便容纳电解质溶液,以降低电池电阻。此外,隔膜要尽可能薄,以减少在电池内占有的空间,一般隔膜厚度在10~50μm,从保障安全考虑,锂离子电池的容量越大,所使用的隔膜应越厚,如一般手机用电池可以采用厚16μm的隔膜,18650电池采用25μm的隔膜,动力电池则采用40μm的隔膜。
根据电池的类型不同,可以分为液体锂离子电池用的隔膜和聚合物电池用的隔膜两类。液态锂离子电池用的隔膜包括用拉伸法(干法)制造的PP/PE/PP三层复合膜和用湿法制造的单层隔膜。美国Bellcore公司采用增塑剂苯二甲酸二丁酯(DBP)为造孔剂,将共聚物PVDF-HFP涂布成膜之后,挥发溶剂丙酮,膜中遗留DBP,经溶剂萃取后在薄膜上留下孔隙,制造出PVDF-HFP聚合物隔膜。此聚合物膜不但能和电解质溶液形成凝胶,而且与正极、负极可以热合在一起成为一体,使得电池芯变薄,内阻降低,但是其隔膜较厚,一般在50μm,机械性能较差,只能用于制造叠片式电池,不能用于制造卷绕式电池,生产效率低。Motorola、Antek等公司在此基础上对其进行了改性,将PVDF-HFP涂布在PP/PE/PP多孔薄膜上,使PP/PE/PP多孔膜与电解质溶液接触时能够形成凝胶,并保持良好的机械性能。还有利用铅酸电池中的无纺布隔膜大的孔隙率、价格便宜、安全性高等优点将其应用于锂离子电池、聚合物电池和动力电池。
3)锂离子电池储能系统应用
锂离子电池能量密度大、自放电小、无记忆效应、工作温度范围宽、可快速充放电、使用寿命长、无环境污染等优点,不仅使其可以满足储能系统的电力调峰的需求,而且具备向电力系统提供频率控制、快速功率响应等辅助服务的能力。锂离子动力电池现已广泛应用于移动存储设备、电动汽车等领域,产业链和技术已经比较成熟,属于目前效率很高的储能方式。许多国家已建或在建锂离子电池储能示范工程,我国风光储示范工程中的锂离子电池储能系统也是目前很有影响力的展示成果。
表16.6 全球锂离子电池储能示范工程
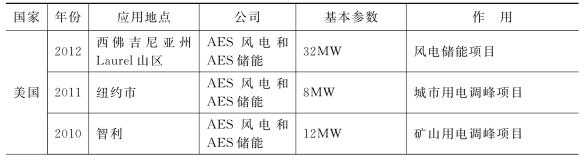
(续表)

2009年,美国电力科学院(EPRI)开展了2kW/4kWh,50kW/200kWh,100kW/400kWh锂离子电池用于分布式储能的研究和开发,并进行了兆瓦级锂离子电池储能系统的示范应用,主要用于电力系统的频率和电压控制,以及平滑风力发电等。
日本的国家项目“分布式电池储能技术”中,就联合多个研究机构和企业研发适合静态储能应用的锂离子电池技术,建立了一些锂离子电池储能示范系统。
美国Altair Nano公司基于钛酸锂系锂离子电池,发展了2MW具有高安全性和长寿命特点的锂离子电池储能系统,向INE公司提供了10MW的锂离子电池储能系统。
美国A123公司研发了基于磷酸铁锂系锂离子电池的储能系统,2008年制备出2MWh的储能模块(见图16.24),并向AES能源公司在智利的发电厂提供了20MW的锂离子电池储能系统,并为其位于西弗吉尼亚州的风电项目配套提供了总容量为32MW的锂离子电池储能系统。2011年,A123宣布为中国东方电气提供500kW的锂电池储能系统,以配备东方电气的风机进行储能测试。

图16.24 A123公司生产的2MW锂离子电池储能装置
2011年,南方电网建成并投运深圳宝清电池储能站,实现了我国储能站“零”的突破。该公司兆瓦级电池储能站成功并网,标志着中国大容量电池储能集成应用技术取得重大技术突破。南方电网兆瓦级电池储能站位于深圳市龙岗区,总容量10MW,第一期为5MW。

图16.25 张北风光储输示范工程
国家电网在河北省张北投资建设的我国首个重点集集风力发电、光伏发电、储能电站、智能变电站一体化的“风光储输示范工程”如图16.25所示,规划总容量为风电300~500MW,光伏发电100MW,储能装置110MW,预计总投资120亿。该示范项目分别安装了磷酸铁锂储能装置14MW(共63MWh),分为四个包(6MW/36MWh、4MW/16MWh、3MW/9MWh和1MW/2MWh),分别被比亚迪、ATL-东莞、中航锂电、万向四家企业中标。
全球多个国家还为推动电动车的发展,发布了多项便利优惠政策。我国政府出台了“十城千辆”节能与新能源汽车计划,国家财政部、科技部、工业和信息化部、国家发展和改革委员会联合出台《关于开展私人购买新能源汽车补贴试点的通知》,确定在上海、长春、深圳、杭州、合肥等5个城市启动私人购买新能源汽车补贴试点工作。美国总统奥巴马上台后,部署实施40多亿美元的电池与电动车研发和产业化计划,还提出2015年实现美国的混合动力汽车销量达到100万辆。日本把发展电动汽车作为“低碳革命”的核心内容。德国政府发布了以纯电动车和插电式电动车为重点的《国家电动汽车发展计划》。从世界各国的战略目标来看,发展电动汽车被普遍确立为保障能源安全和转型低碳经济的有效途径。
目前,锂离子电池储能技术还不能充分证明其在储能市场应用上的经济性和长寿命、高安全等性能的可行性,而且需要复杂的管理系统和精确的状态估计方法,要取得未来大规模的商业应用,锂离子电池仍有一系列技术问题需要进一步突破。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




