(一)酸溶液的配制
(1)盐酸(HCl)。浓盐酸的密度(1.18~1.19)g/mL,含量ω=36%~38%,近似浓度c(HCl)约12mol/L。
c(HCl)=1mol/L盐酸配制:量取浓盐酸83mL,加水稀释至1L。
c(HCl)=6mol/L盐酸配制:量取浓盐酸500mL,加水稀释至1L。
(2)硝酸(HNO3)。浓硝酸的密度1.39~1.40g/mL,含量ω=65%~68%,近似浓度c(HNO3)约15mol/L。
c(HNO3)=1mol/L硝酸配制:量取浓硝酸64mL,加水稀释至1L,用棕色瓶贮存。
c(HNO3)=6mol/L硝酸配制:量取浓硝酸381mL,加水稀释至1L,用棕色瓶贮存。
(3)硫酸(H2SO4)。浓硫酸的密度1.83~1.84g/mL,含量ω=95%~98%,近似浓度c(H2SO4)约18mol/L。
c(H2SO4)=1mol/L硫酸配制:量取56mL浓硫酸,在不断搅拌下缓缓加入适量水中,待冷却至室温后,加水至1L(配制硫酸溶液,有大量热量放出,必须注意安全,硫酸宜缓慢加入,溶液应不断搅拌)。
c(1/2H2SO4)=2mol/L硫酸配制:量取56mL浓硫酸,在不断搅拌下缓缓加入适量水中,待冷却至室温后,加水至1L。
(4)磷酸(H3PO4)。浓磷酸的密度1.69g/mL,含量ω=85%,近似浓度c(H3PO4)约15mol/L。
c(H3PO4)=1mol/L磷酸配制:量取浓磷酸66mL,缓慢加入适量水中,稀释至1L。
(5)高氯酸(HClO4)。浓高氯酸的密度1.68g/mL,含量ω=70%,近似浓度c(HClO4)约12mol/L。
c(HC1O4)=1mol/L高氯酸配制:量取浓高氯酸83mL,缓缓加入适量水中,稀释至1L。
(6)氢氟酸(HF)。浓氢氟酸的密度1.13g/mL,含量ω=40%,近似浓度c(HF)约22.5mol/L。
c(HF)=1mol/L氢氟酸配制:量取浓氢氟酸35mL,加入适量水中,稀释至1L。用塑制容器贮存。
(7)氢溴酸(HBr)。浓氢溴酸密度1.49g/mL,含量ω=47%,近似浓度c(HBr)约9mol/L。
c(HBr)=1mol/L氢溴酸配制:量取浓氢溴酸110mL,加入适量水中,稀释至1L。
(8)冰乙酸(CH3COOH)。密度1.05g/mL,近似浓度约17mol/L。(https://www.xing528.com)
c(CH3COOH)=1mol/L乙酸配制:量取冰乙酸60mL,加入适量水中,稀释至1L。
(二)碱溶液的配制
(1)氢氧化钠(NaOH)。白色固体。
c(NaOH)=1mol/L氢氧化钠溶液配制:将称取的40g氢氧化钠,分几次加入适量水中,不断搅拌(注意:溶解时大量发热!),溶解后让其冷却至室温,加水稀释至1L。用塑制容器贮存。
(2)氢氧化钾(KOH)。白色固体。
c(KOH)=1mol/L氢氧化钾溶液配制:称取56g氢氧化钾,分几次加入适量水中,不断搅拌使其溶解,冷却至室温后加水稀释至1L。用塑制容器贮存。
(3)氨水(NH3·H2O)。浓氨水密度0.90~0.91g/mL,含NH3 ω=28%,近似浓度c(NH3·H2O)≈15mol/L。
c(NH3·H2O)=1mol/L氨水溶液配制:量取66mL浓氨水,用水稀释至1L。
(4)氢氧化钙饱和溶液。c[Ca(OH)2]≈0.02mol/L。
(5)氢氧化钡饱和溶液。c[Ba(OH)2]≈0.2mol/L。
(三)盐溶液的配制
盐溶液的配制见表5-25。
表5-25 盐溶液的配制
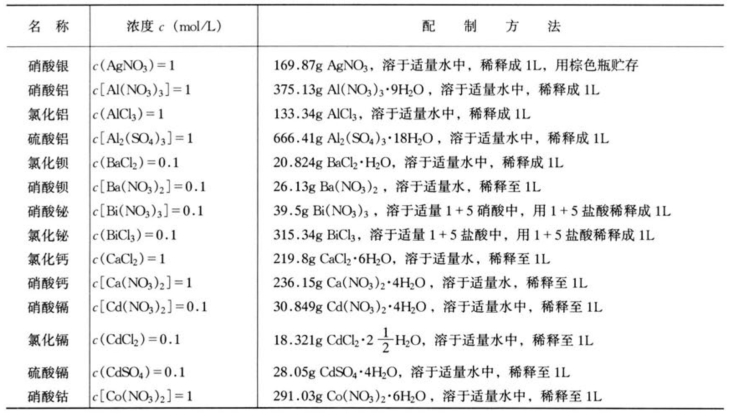
续表
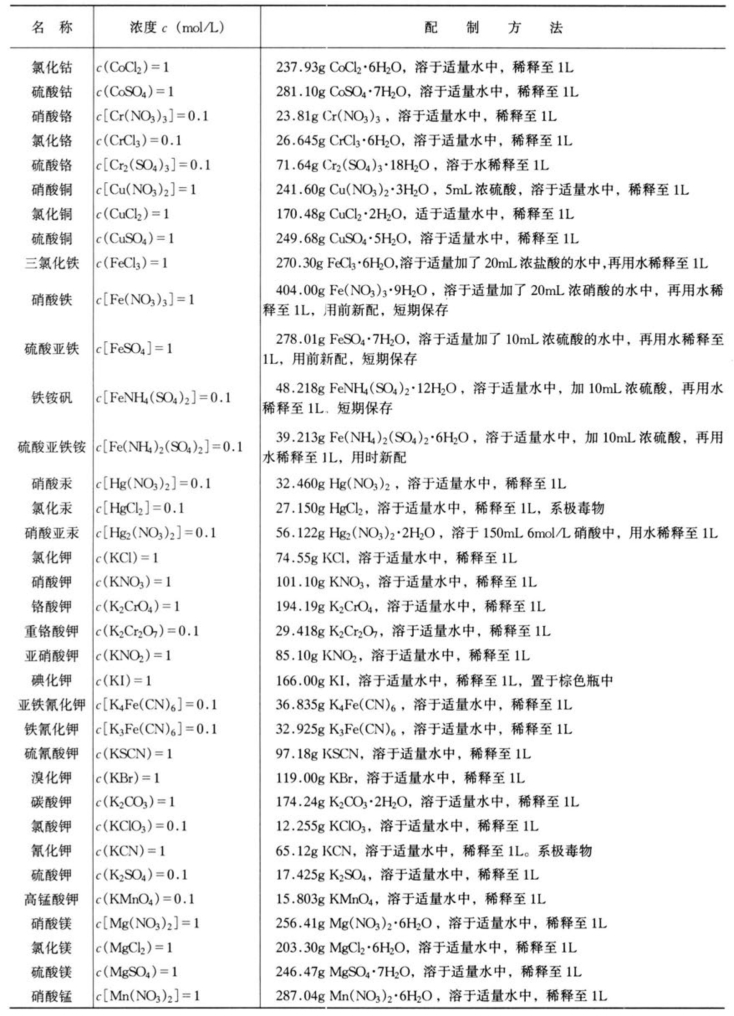
续表
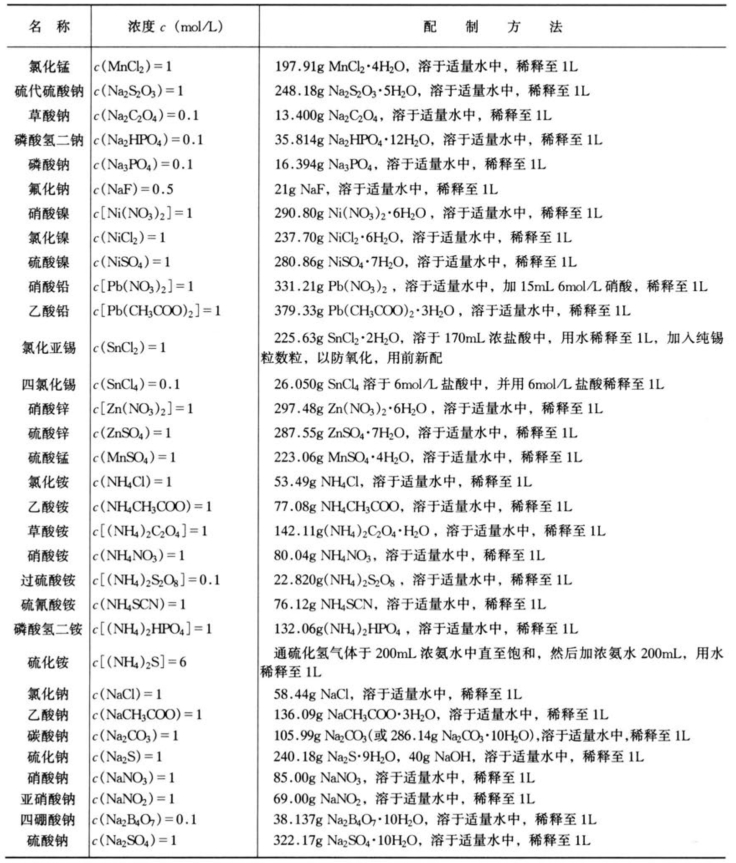
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




