用于水环境样品前处理的萃取法可分为:溶剂萃取法、固相萃取法、固相微萃取法和超临界流体萃取法。溶剂萃取法是一种经典的分离浓集法,后三种方法是近期有很大发展势头的样品前处理方法。
(一)溶剂萃取法
溶剂萃取分离法是比较常用的分离和富集方法之一。在水样中,加入与水不相溶的有机溶剂,利用待测成分在水中和有机溶剂中溶解度的差别,使待测成分被有机溶剂所萃取,从而达到分离的目的。此法简便、快速,应用广泛,既可用于大量元素的萃取分离,更适用于痕量元素的分离和富集;既可分离有机物,也可分离无机物。分离后的组分测定也很方便,被萃取组分可进行直接测定(如用分光光度法、原子吸收法、气相色谱法等),或蒸去有机溶剂后再测定(如发射光谱法、电化学法);若有机溶剂干扰测定,则可使用硝酸—高氯酸消化,或反萃取入水相后再测定。
1.基本原理
(1)分配系数。当溶质A溶于两种共存的互不相混的溶剂时,设一种溶剂为水,另一种为有机溶剂,当达到平衡时,A在这两种溶剂中的浓度的比值(严格说应为活度比)在一定温度下为一常数,称为分配系数,用K D表示:

式中 [A]有——溶质A在有机相中的平衡浓度;
[A]水——溶质A在水相中的平衡浓度。
上述规律称为分配定律,它是萃取分离的基本定律。
(2)分配比。在分析工作中,如遇到溶质在一相或两相中离解、聚合或与其他组分发生反应,而形成多种存在形式,分配定律就不适用了。通常,把溶质在有机相中各种存在形式的总浓度(cA)有与在水相中各种存在形式的总浓度![]() 之比称为分配比,用D表示:
之比称为分配比,用D表示:

所谓分配比大,就是指被萃取溶质在有机相中的量多,也就是说在有机相中的浓度大,在水相中的浓度小。
如果在萃取过程中没有任何副反应发生,则分配系数KD与分配比D就其意义上说是一样的,数值也是一样的,此时:
K D=D
(3)萃取效率(萃取百分率)。分配比可以用来衡量被萃取物在一定条件下进入有机相的程度,但它不能直接表示出被萃取物有多少量已被萃取出来。在实际操作中常用萃取百分率(E)来表示萃取的完全程度:

萃取百分率(E)与分配比(D)的关系为:

式中 V水——水相的体积;
V有——有机相的体积。
若用等体积溶剂萃取,V水=V有,则
![]()
由上式可以看出,萃取百分率E的大小决定于分配比D和体积比V水/V有,D值愈大,或V水/V有值愈小,则萃取百分率愈高。但增加有机溶剂的用量,将导致有机相中溶质浓度降低,不利于富集。实际工作中常常采取分次加入溶剂,连续几次萃取的方法,以提高萃取效率。萃取时,若在水溶液中先加入一定量的电解质(如氯化钠)或酸类,利用盐析效应可以降低有机物在水中的溶解度,从而提高萃取效率。
等体积萃取时分配比和萃取百分率间的关系列于表4-7。
从表4-7可见,萃取率为99%~100%时,相应的分配系数变化范围为100~∞。因此,即使萃取实际上已经完全,但分配系数仍可能有很大差别。所以测定E值要比测定D值更有实际意义。
表4-7 两相体积相等时D和E的关系

从分析目的来考虑,当E=99%时,可认为萃取已经完全;当E≤1%时,则可认为萃取没有发生。因此D的限值范围为-2<lgD<+2。
(4)分离系数。为了达到分离的目的,不仅要求萃取百分率高,而且要求共存组分间的分离效果好,一般用分离系数(分离因数)β表示分离效果:

式中 DA、DB——组分A和组分B的分配比。
β=1,即DA=DB,表明A和B不能分离;
β>1,即DA>DB,表明A和B可分离,β值越大,分离效果越好;
β<1,即DA<DB,表明A和B可分离,β值越小,分离效果越好。
2.萃取体系分类
萃取体系主要分为三类:形成金属螯合物萃取体系、形成离子缔合物萃取体系和有机化合物萃取体系。
(1)形成金属螯合物萃取体系。在水环境分析中这种体系应用最广泛。所用萃取剂一般是有机弱酸,也是螯合剂,形成金属螯合物的特性是难溶于水、易溶于有机溶剂,因而易被有机溶剂所萃取。例如,8-羟基喹啉类、双硫腙类、铜铁试剂类、吡啶偶氮化合物类、吡唑酮类、肟类等,它们与金属离子反应可形成不带电荷的螯合物。
(2)形成离子缔合物萃取体系。利用带不同电荷的离子互相缔合成疏水性的中性分子,从而被有机溶剂所萃取。例如,用乙醚从HCl溶液中萃取Fe3+时,Fe3+与Cl-络合成络阴离子![]() ,而溶剂乙醚可与溶液中的H+结合成离子。盐具有疏水性,可被乙醚萃取。这种萃取体系中,溶剂分子参与到被萃取的分子中,所以它既是溶剂,又是萃取剂。Sb(Ⅴ)、As(Ⅲ)可用同样方式萃取之。
,而溶剂乙醚可与溶液中的H+结合成离子。盐具有疏水性,可被乙醚萃取。这种萃取体系中,溶剂分子参与到被萃取的分子中,所以它既是溶剂,又是萃取剂。Sb(Ⅴ)、As(Ⅲ)可用同样方式萃取之。
(3)有机化合物萃取体系。在有机物的萃取分离中,“相似相溶”原则十分重要。极性有机化合物,包括形成氢键的有机化合物及其盐类,通常易溶于水及极性有机溶剂,而不易溶于非极性或弱极性的有机溶剂;非极性有机化合物不溶于水,但可溶于非极性和弱极性的溶剂,如苯、四氯化碳、环己烷、氯仿等。因此,根据“相似相溶”原则,选用适当溶剂和萃取条件,常可从混合物中萃取某些组分,以达到分离的目的。例如,极性较弱的有机氯农药用石油醚萃取,极性较强的有机磷农药,则选用氯仿萃取。对于有机酸或有机碱,常用控制酸度来达到萃取分离目的。
3.萃取条件的选择
(1)酸度的控制。当萃取剂浓度一定时,影响萃取效率的主要因素是溶液的酸度。溶液的H+浓度越小,D值越大,越有利于萃取。但溶液酸度太低时,金属离子可能水解或引起其他干扰,反而对萃取不利,因此必须正确地控制溶液的酸度。
(2)干扰离子的消除。根据被萃取的离子与萃取剂在不同pH值下形成的化合物稳定性不同,控制适当的酸度,可选择地萃取某种离子,或连续萃取几种离子,使其与干扰离子分离。例如,用双硫腙—四氯化碳萃取分离溶液中Hg2+、Bi3+、Pb2+、Cd2+等离子,控制pH=1,萃取Hg2+,而其他离子留在水相;pH=4~5,萃取Bi3+;pH=9~10,萃取Pb2+,而Cd2+留在水相中,达到彼此分离。
当调节溶液的pH值不能完全消除干扰时,常用络合或氧化还原掩蔽的方法,采用的掩蔽剂有EDTA、氰化物、酒石酸盐、柠檬酸盐、氟化物等。
(3)盐析剂的加入。在离子缔合萃取体系中,如果加入与萃取的化合物具有相同阴离子的盐类,可明显地提高萃取率,这种作用称为“盐析作用”,加入的盐类称作“盐析剂”。一般讲,离子半径小、价电荷高的阳离子盐析作用强,但应注意加入的高价离子对下一步分析的干扰。
(4)萃取溶剂的体积及萃取次数。同样量的萃取溶剂,分几次重复萃取比全部一次萃取效率要高得多。例如,当D=10时,每次用与水样相同体积的有机溶剂萃取,只需要3次即能基本萃取完全。计算表明,分3次萃取后,被萃取离子的剩余浓度仅为原浓度的1/1331。若全部一次萃取,被萃取离子的剩余浓度为原浓度的1/30,可见一次萃取效果要差得多。
(5)萃取溶剂选择。在实际萃取过程中选择溶剂时一般需考虑以下几个方面:①应尽可能选用与水几乎完全不相溶,而且对被萃取物质具有比水更大的溶解度的有机溶剂;②常用溶剂的密度(g/mL)在0.63(正戊烷)和1.59(CCl4)之间,相差过多则两相不易搅拌均匀,相差太小则易形成乳浊液不利分层;③不宜选用室温下蒸气压高的溶剂,以免因挥发而造成物料损失和体积变化而引起误差,也可避免溶剂挥发引起的火灾或中毒;④粘度过高过低时都会使液体转移发生困难,为使两相能迅速分离,应选用表面张力较大的有机溶剂;⑤溶剂介电常数较大时,两种相反电荷的质点在溶剂中缔合的趋向减小,故萃取离子对时,应选用介电常数大的溶剂;⑥若采用萃取光度法检测的则需选用在所检测波长附近范围内无吸收峰的溶剂;⑦溶剂的选择性要高,便于除去干扰组分,为提高效率,也可采用混合溶剂进行萃取;⑧选用时需同时考虑各溶质与溶剂易于分离而溶剂又易于回收精制,还需考虑从溶剂层取出溶质进行分析测定,或在溶剂层中直接测定时的便利程度;⑨要为下一步分析方法考虑,用气相色谱氢火焰离子化检测器测定时,常用二硫化碳、四氯化碳、氯仿、二氯甲烷等溶剂,用电子捕获检测器时,使用己烷、戊烷、庚烷、苯、甲苯等碳氢化合物作溶剂,用原子吸收分光光度法测定时,用甲基异丁酮、乙酸乙酯为溶剂。
表4-8为萃取常用有机溶剂及其物理常数。
表4-8 萃取常用有机溶剂及其物理常数
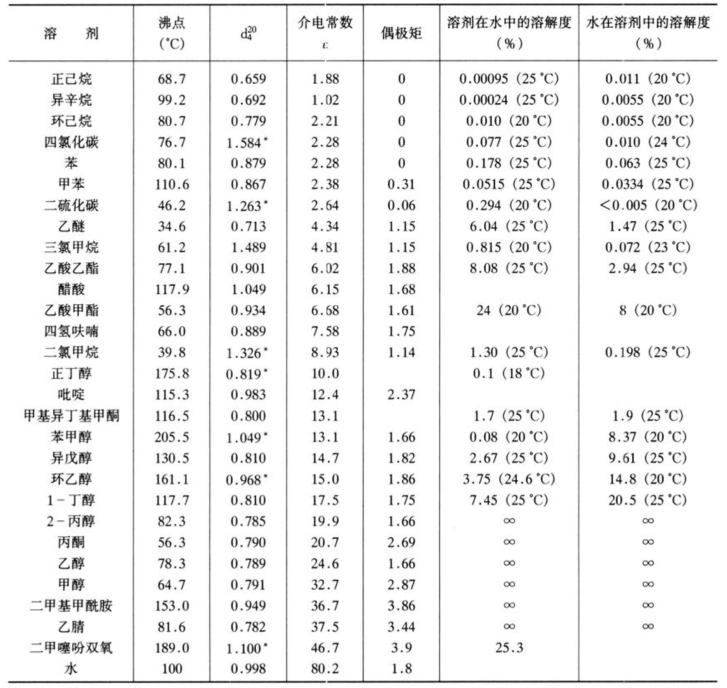
* 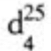 。
。
4.常用萃取方法及装置
(1)间歇萃取。间歇萃取多在分液漏斗内进行。利用与水互不相溶的有机溶剂与水样一起振荡,绝大部分待测物即可进入有机相。萃取率的高低取决于被萃取物在两项中分配比的差异。若经一次萃取不能达到预期的要求,可做两次或多次萃取。间歇萃取优点是简单易行,不需要复杂的仪器,应用范围广,经常用于痕量金属元素或痕量有机物的富集和测定。缺点是溶剂用量多,挥发性有机物在萃取过程中损失大,由于溶剂用量多,容易将溶剂中的杂质带入样品。
一般实验室多采用间歇萃取法,主要操作程序如下:
分液漏斗的活塞和顶塞应严密;根据溶剂的性质,在活塞上涂以合适的润滑剂,使其转动灵活,不漏水;使用时应根据被处理溶液的体积,选择适当容积,并应按照实验的具体要求进行必要的净化处理;
一般用手工操作,振荡时应按住玻璃塞,经常倒转分液漏斗使管颈朝上并打开漏斗活塞以平衡内部气压,分析大批样品时,可使用振荡器;萃取振荡的时间必须严格遵守实验项目操作步骤中所规定的时间;为提高萃取效率,可加盐类使水相饱和;
萃取振荡后,将分液漏斗放在台架上静置,有时可轻轻碰一下分液漏斗的侧壁,使附着在两层界面或器壁上的有机溶剂微粒聚积合并而易于分层,也可以加入几滴适宜的溶剂(如丙酮、乙醇、苯等)以减低水的表面张力促进分层;
打开分液漏斗顶塞,用滤纸卷成小筒吸去下管内壁上附着的水珠,慢慢转动活塞,将两相分离。
(2)连续萃取。在萃取过程中循环一定量的萃取剂保持其体积基本不变的萃取方法称为连续萃取法。这种方法可用于固态或液态样品的萃取。
连续萃取主要用于水中溶解度较大,即亲水性较强的化合物的萃取,这类化合物的分配比较小,用间歇萃取法进行分离时效果很差。连续萃取克服了间歇萃取中的两个限制因素:①连续性提供新鲜的溶剂,因而避免了溶剂饱和;②供萃取用的液体体积没有受到限制,而间歇萃取要受到限制。
液—液连续萃取器的工作原理包括两个循环过程——水样的循环和溶剂的循环。常用的连续的萃取装置如图4-6所示。液—液连续萃取器的构造视所用萃取剂的密度大于或小于样品而有所不同。图(a)是用轻型萃取剂进行连续萃取的装置;图(b)是用重型萃取剂进行连续萃取的装置。萃取剂在烧瓶1中被加热蒸发,当其冷凝并返回储液器2时即与样品(即萃余液)接触而进行萃取。
图4-6 连续萃取装置
(a)轻相萃取剂;(b)重相萃取剂
1—烧瓶;2—储液器;
E—萃取剂;R—萃余液
5.萃取操作及注意事项
溶液中物质萃取和具体操作步骤及注意事项见表4-9。
表4-9 溶剂萃取操作及注意事项

续表

6.溶剂萃取法的应用
溶剂萃取法因为具有简便、快速、易行的优点,因而在水环境监测中应用广泛。
(1)痕量金属元素的分离与富集。在天然水及废水的水质测定中,比较广泛地应用了溶剂萃取法对金属元素的分离与富集。在Minczewski所著《无机痕量分析中的分离和预浓集方法》一书中,收集了各种萃取剂在萃取不同元素时,水相及有机相的最佳萃取条件及其最大萃取百分率,并附有文献。
(2)痕量有机物的分离与富集。水中有机污染物的预处理方法中,液—液萃取法仍然占有主要位置。如美国环保局(EPA)114种优先监测有机污染物,除可气提化合物外,绝大部分的方法皆用液—液萃取法提取。其中除联苯胺用氯仿萃取外,在酸性条件下用二氯甲烷萃取11个酚类化合物;在中性和碱性条件下用相同溶剂萃取42个碱性/中性化合物和26种农药。
用溶剂液—液萃取法也是美国EPA推荐的分析水中有机污染物的标准方法之一。有些水体中的有机物的组成极为复杂,简单地分为酸、碱及中性几部分再作色谱分析还难以将这些污染物区分开来。这时可用化学衍生化后液—液萃取法,使某些污染物在极性、挥发度、稳定性方面更加适合于气相色谱的要求,这是目前环境水样预处理中颇有潜力的一种技术。
(二)固相萃取法
固相萃取(Solid Phase Extraction,SPE)由液固萃取和柱液相色谱技术相结合发展而来。
固相萃取(SPE)被日趋认为是一个非常有用的样品处理技术。使用固相萃取法能避免液—液萃取所带来的许多问题,比如,不完全的相分离,较低的定量分析回收率,昂贵易碎的玻璃器皿和大量的有机废液。与液—液萃取相比,固相萃取更有效,容易达到定量萃取,快速和自动化,同时也减少了溶剂用量和工作时间。
1.基本原理
固相萃取的原理基本上与液相色谱分离过程相仿,是用固态吸附剂以类似的萃取方法浓集液态样品中的微量组分的过程,使样品通过填充疏水性固相的吸附柱,对固相有高亲和性的物质便被吸附,从而得到萃取,然后再用溶剂洗脱下来。因此,此法以所用溶剂量少为特征。所用固相以前为活性炭或XAD树脂,最近又增加了硅胶键合ODS物质及聚苯乙烯、聚丙烯酸酯泡沫类高分子系列物质。
2.固相萃取装置
固相萃取装置分为柱型和盘型两种:
(1)固相萃取管。柱型萃取器结构如图4-7所示。容积为1~6mL的柱体一般是聚乙烯管或不锈钢管,在两片聚乙烯筛板之间填装0.1~2g吸附剂。

图4-7 固相萃取管示意图
使用最多的吸附剂是C18相。该种吸附剂疏水性强,在水相中对大多数有机物显示保留。此外,也使用其他具有不同选择性和保留性质的吸附剂,如C8、氰基、苯基、氨基填料和活性炭、硅胶、氧化铝、硅酸镁、高分子聚合物、离子交换树脂、排阻色谱吸附剂等。表4-10和表4-11分别列出了SPE使用的部分固相萃取剂的基本特性和适用范围。
表4-10 固相萃取剂的基本特性
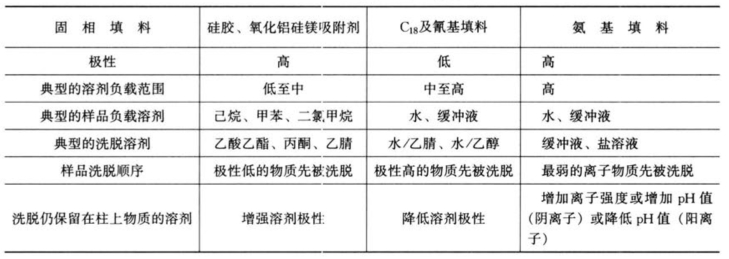
表4-11 固相萃取填料的适用范围

基于对纯度的考虑,一般选用聚乙烯作为柱体材料。也可选用玻璃、纯聚四氟乙烯(PTFE)作为柱体材料。
筛板材料是另一可能的杂质来源,制作筛板的材料有聚丙烯、PTFE、不锈钢和钛。金属筛板不含有机杂质,但易受酸的腐蚀。
为了避免从柱体、筛板、吸附剂、洗脱溶剂可能引入杂质而影响分析结果,试验时应平行做空白试验。
为了加速样品溶液流过,可以接真空系统。为提高效率,可将多个同样或不同样品的固相萃取柱置于一架子上,下接好相应的容器,再一并装入箱中,箱子再与真空系统连接。这样就可以同时进行多个固相萃取柱处理。萃取操作步骤如图4-8所示。第一步用适当溶剂润湿萃取柱中填充物,随后加入一定体积的样品溶液,使其流过柱子,让溶液中被测组分保留在柱上,溶剂和其他不易保留的组分从中流出,再加入适宜的洗涤溶剂,从柱上洗去不需要的已被吸附的组分,最后用洗脱液将保留在柱上需要分析测定的组分淋洗下来,收集在试管中备分析之用。

图4-8 固相萃取操作步骤示意图(https://www.xing528.com)
(a)萃取柱;(b)加入样品;(c)杂质;(d)洗脱
●—杂质;○—被测组分
固相萃取柱使用简便,应用范围广。但在实际应用中仍存在如下的一些问题:①由于柱径较小,使流速受到限制,通常只能在1~10mL/min范围内使用。当需要处理大量水样时,则需要较长的时间;②采用40μm左右的固定相填料,若采用较大的流速会产生动力效应,妨碍了某些组分有效地收集;③对于相对较脏的样品,如各种污水,含生物样品及悬浮微粒的水样,很容易将柱堵塞,增加样品处理时间;④40μm颗粒的填充柱,容易造成填充不均匀,出现缝隙,降低柱效。
(2)固相萃取盘。盘式萃取器是含有填料的PTFE圆片或载有填料的玻璃纤维片,填料约占SPE盘总量的60%~90%,盘的厚度约1mm。由于填料颗粒紧密地嵌在盘片内,在萃取时无沟流形成。SPE柱和盘式萃取的主要区别在于床厚度/直径(L/d)比,对于等重的填料,盘式萃取的截面积比柱约大10倍,因而允许液体试样以较高的流量通过。SPE盘的这个特点适合从水中富集痕量的污染物。1L纯净的地表水通过直径为50mm的SPE盘仅需15~20min。
目前盘状固相萃取剂可分为三大类:①由聚四氟乙烯网络包含于化学键合的硅胶或高聚物颗粒填料,由美国3M和Bio-Rad Laboratiories生产,其中填料含量占90%,聚四氟乙烯只有10%;②由聚氯乙烯网络包含于带离子交换基团或其他亲和基团的硅胶,如FMC公司生产的Anti-Disk、Anti-Mode和Kontes生产的Fastchrom膜;③衍生化膜,它不同于前两种,固定相并非包含在膜中,而是膜本身经化学反应键合了各种功能团,如二乙胺基乙烯基、季铵基、磺酸丙基等。上述三类膜中只有聚四氟乙烯网络状介质与普通固相短柱相仿,用于萃取金属离子及各种有机物,后两类主要用于富集生物大分子。
3.固相萃取方法的建立
市场上可以买到各种构型的SPE产品,而不必自己制备。操作步骤包括固相萃取柱或片预处理、加样、洗去干扰物和回收分析物4个步骤。在加样和洗去干扰物步骤中,部分分析物有可能穿透固相萃取柱而造成损失;而在回收分析物步骤中,分析物可能不被完全洗脱,仍有部分残留在柱上。这些应尽可能的避免。
(1)填料预处理。在萃取样品之前,为了预处理固相萃取管或固相萃取盘填料,先用数毫升的甲醇冲洗萃取管或萃取盘,再用水或缓冲溶液顶替滞留在柱或盘中的甲醇。为了使固相萃取填料从预处理到样品加入时都保持湿润,允许大约1mL的预处理溶剂在管过滤片(frits)或萃取片表面之上。如果在样品加入之前填料管干了,应重复预处理过程。柱或盘的预处理的目的是除去填料中可能存在的杂质;另一个目的是使填料溶剂化,提高固相萃取的重现性。填料未经预处理,会引起溶质过早穿透,影响回收率。
(2)加入样品。填料预处理后,试样溶液被加至并通过固相萃取柱或固相萃取盘。为加强适当的化合物保留在填料上,洗脱或沉淀不要的化合物,要调节pH值、盐的浓度和样品溶液在有机相中的含量。为了避免堵塞固相萃取管的过滤片(frits)或固相萃取片,如果可能应在萃取之前预先过滤或离心样品。
用真空或正压慢慢地让样品溶液通过萃取装置。流速会影响某些化合物的保留。一般来说,对于离子交换固定相萃取管,流速不应大于2mL/min;对于其他的固相萃取管,流速不应大于5mL/min;对于萃取片,大约为50mL/min。
加到萃取柱上的试样量取决于萃取柱的尺寸(填料量)和类型、在试样溶剂中试样组分的保留性质和试样中分析物及基质组分的浓度等因素。固相萃取柱选定后,应进行穿透实验。进行穿透实验时,分析物的浓度应为实际试样中预期的最大浓度。最后选定的试样体积要小于上述测定值,以防止在清洗杂质时分析物受损失。
(3)除去干扰杂质。用中等强度的溶剂将干扰组分洗脱下来,同时保持分析物仍留在柱上。对反相萃取柱,清洗溶剂是含适当浓度有机溶剂的水或缓冲溶液。通过调节清洗溶剂的强度和体积,尽可能多的除去能被洗脱的杂质。为了决定最佳清洗溶剂的浓度和体积,加试样于固相萃取柱上,用5~10倍固相萃取柱床体积的溶剂清洗,依次收集和分析流出液,得到清洗溶剂对分析物洗脱廓形,依次增加清洗溶剂强度,根据不同强度下分析物的洗脱廓形,决定清洗溶剂适合的强度和体积。
(4)分析物的洗脱和收集。这一步骤的目的是将分析物完全洗脱并收集在最小体积的溶液里,而将强保留的杂质尽可能多的仍留在固相萃取柱上。洗脱溶剂的强度是至关重要的。较强的溶剂能够使分析物洗脱并收集在一个小体积的溶液里,但有较多的强保留杂质同时被洗脱下来。当用较弱的溶剂洗脱,所用洗脱剂的体积较大,但含较少的杂质。为了选择合适的洗脱溶剂强度和体积,加试样于固相萃取柱或固相萃取盘上,改变洗脱剂的强度和洗脱剂的体积,测定分析物的回收率。表4-12列出了固相萃取常用的洗脱溶剂。
表4-12 SPE常用的洗脱溶剂

注 引自董玉英等,环境科学进展,1999,7(4)。
①指在硅胶柱上溶剂的洗脱强度。
②指溶剂与质子供体、质子受体或偶极子相互作用大小。
固相萃取柱的操作过程的每一步,都可能影响到分析的重现性。提高重现性的方法有:①使用内标法,加入适当的内标物质作参比;②加入样品的量适当,不超出穿透量;③选择合适的洗涤液和洗脱液,避免待测组分流失。
了解试样基质和待测组分的性质,如结构、极性、酸碱性、溶解度、大致的浓度范围等,对选择和确定预处理方法和条件都是有帮助的。
4.固相萃取法的应用
固相萃取在环境样品预处理的应用主要是对水样的处理,尤其是盘型固相萃取的使用,把1L水的处理时间缩短到10min,与通常的液—液萃取相比,减少了大量的时间和劳动强度,减少使用大量的有机溶剂,降低了对人体和环境的影响。
另外,许多环境水样从野外采集后,由于条件限制不能马上分析,需存放在冰箱内送往实验室,造成运输、保存上的困难。而固相萃取技术可以在野外直接萃取水样,将萃取后的介质送往实验室,这样,不但极大地缩小了样品的体积,方便运输,而且污染物吸附在固相介质上比存放在冰箱的水样中更为稳定。如烃类物质在固相介质上可保存100d,而在水样中只能稳定几天。较为理想的方法是野外取样先经固相萃取处理,再将萃取剂经干燥后予以保存或运送,直至分析前再用溶剂将被测组分从萃取剂上洗脱下来。
固相萃取与其他分析技术的联用也正在得到迅速的发展。说明SPE不仅可作为单纯样品的制备技术(离线分析),也可作为其他分析仪器的进样技术(在线分析)。其中以与色谱分析(包括GC/MS)的在线联用为在环境分析中最为成熟的在线方式。有关固相萃取技术在我国环境分析化学中的应用可参考有关文献。
美国EPA在建立一些分析水样的方法中,已同意使用SPE代替LLE(Liguid-Liguid Extraction,LLE),见表4-13。
表4-13 用SPE净化和富集的EPA方法

注 引自:张海霞等:分析化学,2000,28(9)。
①PS—DVB:聚苯乙烯—二乙烯苯(polystyrene-divinylbenzene)。
(三)固相微萃取法
固相微萃取法(Solid Phase Microextraction,SPME)是在固相萃取基础上发展起来的新的萃取分离技术。固相微萃取法由加拿大Waterloo大学Pawliszyn于1990年提出。美国Supelco公司1993年推出了商品化的固相微萃取装置。由于该法既不使用溶剂,也不需复杂的仪器设备,它一经出现,就得到迅速的发展。在我国,有关固相微萃取法的原理及应用性的论述均有报道。
1.基本原理
固相微萃取的原理与SPE不同,固相微萃取不是将待测物萃取出来,其原理是建立在待测物在固相和水相之间达成平衡分配的基础上。
设固定相所吸附的待测物的量为Ws,因待测物总量在萃取前后不变,故得到:
C0 V2=C1 V1+C2 V2
式中 C0——待测物在水样中的原始浓度;
C1——待测物达到吸附平衡后在固定相中的浓度;
C2——待测物达到吸附平衡后在水样中的浓度;
V1——固定相液膜的体积;
V2——水样的体积。
当吸附达到平衡时,待测物在固定相与水样间的分配系数K有如下关系:
K=C1/C2
平衡时固相吸附待测物的量Ws=C1 V1,故C1=Ws/V1。将C1及C2代入上式并整理后得:
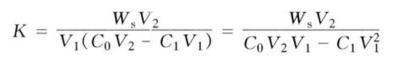
由于V1≪V2,上式中![]() 可忽略,整理后得:
可忽略,整理后得:
Ws=KC0 V1
由上式可知,Ws与C0呈线性关系,并与K和V1呈正比。决定K值的主要因素是萃取头固定相的类型,因此,对某一种或某一类化合物来说选择一个适宜的萃取固定相十分重要。萃取头固定相液膜越厚,Ws越大。由于萃取物全部进入色谱柱,一个微小的固定液体积即可满足分析要求。通常液膜厚度为5~100μm,这已比一般毛细管柱的液膜(0.2~1μm)厚得多。
2.固相微萃取装置
固相微萃取装置主要有两部分组成:一是涂在1cm长的熔融石英细丝表面的聚合物(一般是气相色谱的固相液)构成萃取头(Fiber),固定在中空钢针的活塞上;另一部分就是套筒(Sleeve),中空钢针的活塞就安装在套筒里,整个装置形如一微量进样器。如图4-9所示。

图4-9 固相微萃取装置图
当萃取样品的时候,将萃取器针头插入样品瓶内,压下活塞,使具有吸附涂层的萃取纤维暴露在样品中进行萃取,经过2~30min后吸附达到平衡,使萃取纤维缩回到起保护作用的不锈钢针头中,然后拔出针头,完成萃取过程。将已完成萃取过程的萃取器针头插入气相色谱仪的进样口,压下活塞,使吸附在萃取头上的有机物在进样口进行热解吸,而后被载气送入毛细管柱进行分离测定。SPME法的分析步骤列于图4-10中。
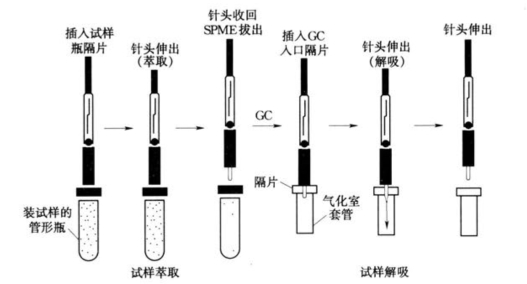
图4-10 SPME试样萃取解吸图
3.固相微萃取条件的选择
(1)萃取头。萃取头应由萃取组分的分配系数、极性、沸点等参数来确定。在同一个样品中因萃取头的不同可使其中某一个组分得到最佳萃取,而其他组分则可能受到抑制。目前常用的萃取头有以下几种:①聚二甲基硅氧烷类,厚膜(100μm)适于分析水溶液中低沸点、低极性的物质,如苯类,有机合成农药等,薄膜(7μm)适于分析中等沸点和高沸点的物质,如苯甲酸酯,多环芳烃等;②聚丙烯酸酯类,适于分离酚等强极性化合物;③活性炭萃取头,适于分析极低沸点的强亲脂性物质。
(2)萃取时间。萃取时间主要是指达平衡所需的时间。平衡时间往往取决于多种因素,如分配系数、物质的扩散速度、样品基体、样品体积、萃取膜厚、样品的温度等。实际上,为缩短萃取时间没有必要等到完全平衡,通常萃取时间为5~20min即可。但萃取时间要保持一定,以提高分析的重现性。
(3)改善萃取效果的方法。改善萃取效果一般需考虑以下几个方面:①搅拌,可以促进样品均一化和加快物质的扩散速度,有利于萃取平衡的建立;②加温,尤其在顶空固相微萃取时,适当加温可提高液上气体的浓度,一般加温50~90℃;③加无机盐,在水溶液中加入硫酸铵、氯化钠等无机盐至饱和可降低有机化合物的溶解度,使分配系数提高;④调节pH值,萃取酸性或碱性化合物时,通过调节样品的pH值,可改善组分的亲脂性,从而可大大提高萃取效率。
4.固相微萃取法的应用
固相微萃取操作简单、快速,不需用溶剂洗脱,萃取后即可将它直接插入气相色谱(包括GC/MS)的进样室,经热解样品即进入色谱柱,减少了很多中间步骤,而且测定灵敏度高,因此被广泛地应用于环境样品有机污染物的分析中,包括固态(如沉积物、土壤等)、液态(地下水、地表水、饮用水、废水)及气态(空气及废气)中的卤代烃(包括卤代芳烃)、有机氯农药、多环芳烃、胺类化合物以及石油类等。已有大量的应用文献报道。
固相微萃取装置既可用于液态样品的预处理(浸渍萃取或顶空萃取),也可用于固态样品的预处理(顶空萃取)和气态样品的预处理。
现将液—液萃取、固相萃取和固相微萃取的相关参数列于表4-14。由表可知,固相微萃取较其他样品预处理方法具有明显的优越性。由于出现一些新的样品预处理方法,一些传统的预处理方法,如液—液萃取今后将逐步被淘汰。
表4-14 液—液萃取、固相萃取和固相微萃取的比较

(四)超临界流体萃取法
超临界流体萃取(Supercritial Fluid Extraction,SFE),在环境样品的预处理方面发展迅速、被广泛应用。1986年超临界流体萃取开始用于环境分析,1988年国际上推出了第一台商品化的超临界流体萃取的仪器,美国EPA1990年提出利用SFE技术在5年内停止95%的有机氯溶剂的使用,并将其定为常规分析方法。
1.基本原理
超临界流体萃取法是利用超临界流体作萃取剂,从组成复杂的环境样品中(固体或液体)将所含待测组分选择性分离出来的一种样品前处理方法。由于本法具有高效、快速、后处理相对简单等特点,因此成为一种理想的现代化样品前处理技术。它特别适用于含烃类及非极性脂溶化合物(如醚、酯、酮等)的样品。但如果样品待测物分子中含羟基或羧基等极性集团,就会使萃取较难,甚至无法进行。
超临界流体是介于气体和液体之间的一种物态,它只有在物质的温度和压力超过其临界点时才能存在。超临界流体的密度近于液体,所以能溶解很多外来物质。另一方面,它的粘度近于气体,所以传质速率快。同时,由于表面张力较小,很容易渗透到样品中去,并保持较大的流速,可使萃取过程得以高效、快速完成。
改变超临界流体的温度、压力或在超临界流体中加入某些极性有机溶剂,可以改变萃取的选择性和萃取效率。
压力的改变可以引起超临界流体对物质溶解能力的很大变化。这样,只要改变萃取的压力,就可以将样品中的不同组分按它们在超临界流体中溶解度的大小,先后萃取分离出来。在低压下溶解度大的物质先被萃取,随着压力的增加,难溶物质也逐渐从基体中萃取出来。因此,在程序升压下进行超临界萃取,不但可以萃取不同的组分,而且还可以将不同组分分离。一般来讲,提高压力可以提高萃取效率。例如,对PAH化合物,在7.5MPa时不能萃取;在10MPa时,可萃取2~3环的PAH;压力提高到20MPa,则可以萃取得到5~6环的PAH。
温度的变化同样会改变超临界流体萃取的能力,将影响萃取剂的密度与溶质的蒸汽压两个因素。在低温区(仍在临界温度以上),温度升高降低流体密度,而溶质蒸汽压增加不多,因此,萃取剂的溶解能力降低,溶质从流体萃取剂中析出;温度进一步升高到高温区时,虽然萃取剂密度进一步降低,但溶质蒸汽压迅速增加起了主要作用,因而挥发度提高,萃取率不但不减少反而有增大趋势。
在超临界流体中加入少量的极性有机溶剂,也可改变它对溶质的溶解能力。通常加入量不超过10%,而且以极性溶剂甲醇、异丙醇等居多。少量极性有机溶剂的加入,还可使萃取范围扩大到极性较大的化合物。有人认为极性有机溶剂的加入起到了与分析物争夺基体活性点的作用而有利于萃取。但有机溶剂的使用,可能导致以下几个问题:①可能削弱萃取系统的捕获能力;②可能导致共萃取物的增加;③可能干扰检测,如氯代溶剂会影响ECD的检测;④会增加萃取毒性。因此,极性有机溶剂的加入,要全面地分析、考虑,包括溶剂的品种、数量等。
超临界流体萃取的选择随萃取对象的不同而不同。通常临界条件比较低的物质优先考虑。表4-15列出了超临界流体萃取中常用的萃取剂及其临界值。其中水的临界值最高,实际使用最少。用得最多的是二氧化碳,它不但临界值相对较低,而且具有一系列优点:化学性质不活泼,不易与溶质反应,无毒、无嗅、无味,不会造成二次污染;纯度高、价格适中,便于推广应用;沸点低,容易从萃取后的馏分中除去,后处理比较简单;特别是不需加热,极适合于萃取热不稳定的化合物。但是,由于二氧化碳的极性极低,只能用于萃取低极性和非极性的化合物。
表4-15 常用超临界萃取剂及其临界值

2.超临界流体萃取装置
超临界流体萃取装置,一般包括:
(1)超临界流体发生源,由萃取剂贮槽、高压泵及其他附属装置组成。其功能是将萃取剂由常温、常压态转变为超临界流体。高压泵通常采用注射泵,其最高压力为10MPa至几十兆帕,具有恒压线性升压和非线性升压的功能。
(2)超临界流体萃取部分,包括样品萃取管及附属装置。
(3)溶质减压吸附分离部分,由喷口及吸收管组成。
萃取的过程是,处于超临界态的萃取剂进入样品管,待测物从样品的基体中被萃取至超临界流体中。然后,通过流量限制出口器进入收集器中。萃取出来的溶质及流体,由超临界态喷口减压降温转化为常温常压,此时流体挥发逸出,而溶质吸附在吸收管内多孔填料表面。用合适溶剂淋洗吸收管就可把溶质洗脱收集备用。
3.超临界流体萃取操作
超临界流体萃取的操作方式可分为动态、静态及循环萃取三种:
(1)动态萃取。动态法是超临界流体萃取剂一次直接通过样品管,使被萃取的组分直接从样品中分离出来进入吸收管的方法。操作简便、快速,特别适合于萃取那些在超临界流体萃取剂中溶解度很大的物质,而且样品基质又很容易被超临界流体渗透的被测样品。
(2)静态萃取。静态法是将待萃取的样品“浸泡”在超临界流体内,经过一定时间后,再把含有被萃取溶质的超临界流体送至吸收管。它没有动态法那样快速,但适合于萃取那些与样品基体较难分离或在超临界流体内溶解度不大的物质,也适合于样品基体较为致密,超临界流体不易渗透的样品。
(3)循环萃取。循环法其本质是动态法和静态法的结合。它首先将超临界流体充满样品萃取管,然后用循环泵使样品萃取管内的超临界流体反复多次经过管内的样品进行萃取,最后进入吸收管,因此,它比静态法萃取效率高,又能萃取动态法不适用的样品,适用范围广。
影响萃取效率的因素除了超临界流体的压力、温度和添加的有机溶剂外,萃取过程的时间及吸收管的温度也会影响萃取的效率及吸收效率。萃取时间取决于两个因素:①被萃取组分在超临界流体中的溶解度,溶解度越大,萃取效率越高,速度也越快,所需萃取时间就短;②被萃取组分在基质中的传质速率,速率越大,萃取效率就越高,速度就越快,萃取所需时间就越短。收集器或吸收管的温度将影响回收率。因为萃取出的溶质溶解或吸附在吸收管内,会放出吸附或溶解热,因此,降低温度有利于提高收集率。
4.超临界萃取法的应用
超临界流体特别适合于萃取烃类及非极性脂溶化合物,如醚、酯、酮等。
超临界流体能进行族选择性萃取是它的一大优点。例如在农药的萃取方面,常见农药分为有机氯(OCPs)、有机磷(OPPs)、三嗪(Trazine)和糖醛(Urons)4类。利用不同含量的有机溶剂添加剂或通过调节萃取压力和温度可将它们分离。如Barnabas等人在13.5MPa时用纯CO2先萃取OCPs,然后在40MPa时用加入甲醇添加剂的CO2,又萃取了OPPs,取得了很好的选择性。
超临界流体萃取主要用于有机化合物的萃取。由于CO2是非极性物质,所以不能用于金属离子的直接萃取,但可将金属离子衍生为金属螯合物后再进行萃取,这就要求衍生后得到的金属螯合物在超临界流体中有较大的溶解度和稳定性。因此,选择合适的螯合剂是关键。这些方面已有文献报道。
就样品形态而言,超临界流体萃取最适于固体和半固体样品的萃取。也可用于其他类型样品的萃取。由于水在超临界CO2中有较高的溶解度(约0.3%),因此,除少量液态样品可直接萃取外,大多数液体及气体应首先进行固相吸附或用膜预处理,然后再按固态样品方式进行萃取,但这种方法只取得了有限的应用。
表4-16列出了超临界流体在萃取环境样品的预处理中代表性的应用。
表4-16 超临界流体萃取在处理环境样品中的典型应用

超临界流体萃取的另一个特点及发展方向是能与其他仪器分析方法的联用,从而避免了样品转移的损失、沾污,减少了各种人为的偶然误差,提高了方法的精密度和灵敏度,提高了工作效率,便于实现自动化。目前使用最普遍且较成熟的联用技术是与气相色谱联用。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




