(一)水样保存的必要性
从水体中取出代表性的样品到实验室分析测试的时间间隔中,由于水样离开了水体母源,水中原有的某些物质的动态化学平衡和氧化还原体系势必遭到破坏,使水中所含物质发生物理的、化学的和生物的变化,这些变化使得进行分析时的样品已不再是采样时的样品。水样变化的原因如下:
(1)水中的细菌、藻类和其他生物可能消耗、释放或改变水中一些组分的化学形态,如溶解氧、二氧化碳、生化需氧量、pH值、碱度、硬度、氮、磷和硅化物等。
(2)水体中具有还原性的某些组分,会由于与空气中的氧接触被氧化,如有机化合物、亚铁离子、硫化物等。
(3)有些组分可能沉淀,如碳酸钙、金属等化合物,并使水体中某些微量组分因吸附、包藏或混晶而发生共沉淀。
(4)pH值、电导率、二氧化碳、碱度、硬度等可能因从空气中吸收二氧化碳而改变。
(5)溶解于水中的易挥发成分和气体,因压力和温度的骤然变化会逸散、挥发(氧氰化物、汞、苯系物、卤代烃),从而引起组分浓度的变化。
(6)溶解状态和胶体状态的金属以及某些有机化合物可能被吸附在盛水器内壁或水样中固体颗粒的表面上。
(7)一些聚合物可能会分解,如缩聚的无机磷和聚合的硅酸。
这些变化进行的程度随水样的化学和生物学性质不同而变化,取决于水样所在的环境温度、所受的光线作用、用于贮存水样的容器特性、采样到分析所需的时间、传送样品时间的条件等。这些变化往往是相当快的,几小时就会明显地改变样品浓度,因此,要想完全制止水样在存放期间内的物理、化学和生物学变化是很困难的。水样保存的基本要求只能是尽量减少其中各种待测组分的变化。即做到:①减缓水样的生物化学作用;②减缓化合物或络合物的氧化—还原作用;③减少被测组分的挥发损失;④避免沉淀、吸附或结晶物析出所引起的组分变化。
由此可见,水样的正确保存是水质监测全程序质量控制的重要一环。尽管现在还找不到使样品待测成分绝对不变的保存方法,但是采取一些有效措施,以减少或延缓某些成分的变化是完全可能的,也是十分重要的和必要的。
(二)水样保存方法
为尽量减少水样组分的变化,使水样具有代表性,最有效的办法是缩短运输时间,尽快分析。但实际上总需要保存水样。为此,应根据不同监测项目的要求,采取不同的保存方法。如需要分析水样中可过滤(溶解)的金属时,应在采样后立即用0.45μm滤膜过滤,需要分析水样中可用酸萃取的金属时,因其常被轻微地吸附在颗粒物上,故采样后应在每升水样中加入5mL浓硝酸;需要分析水样中各种存在形态的金属时(包括无机结合和有机结合的、可溶的和颗粒的),采样后既不加硝酸也不要过滤;测定不可过滤的金属时,应保留过滤水样用的滤膜,将滤膜上的残渣连同滤膜一并消化,并同时做滤膜空白,以便获取空白校正值。有些监测项目则要求必须在限定的时间内将水样送到实验室。下面介绍几种最常用的水样保存方法。
1.冷藏与冷冻
水样在2~5℃冷藏保存,最好放在暗处或冰箱中。这样可以抑制生物活动,减缓物理作用和化学作用的速度。这种保存方法对以后的分析测定没有妨碍。但这种办法不能作为长期保存的手段,尤其对废水样品更是如此。
除了低温冷藏外,有的水样还需要深冷冰冻贮存。有些文献报导,将水样保存在-20℃的深冷条件下,对磷、氮、硅化合物以及生化需氧量等的稳定性都大有益处。但这需要熟练掌握冷冻和融化技术,以便在融化后使样品仍能回复到原来的平衡状态。在这种情况下,建议最好使用塑料容器。
玻璃容器不适合用于冷冻。用作微生物检验的样品不能冷冻。因为冰冻时有可能使生物细胞破裂,使生物体中的化学成分进入水溶液中。
2.过滤与离心分离
取样期间或取样后,立即用滤纸或滤膜进行过滤,或通过离心分离的办法,都可以将样品中的悬浮物、沉淀、藻类以及其他微生物去除。使用孔径合适的滤器可有效地除去藻类和细菌,使滤后样品具有足够的稳定性。当然,如果过滤器会将待测组分截留则不能采用过滤的办法。同样,过滤器亦不应导致样品污染,而且在使用前要对其进行仔细的清洗。
在分析时,过滤的目的主要是区分过滤态和不可过滤态,在滤器的选择上要注意可能的吸附损失,如测有机项目时一般选用玻璃纤维或聚四氟乙烯过滤器,而在测定无机项目时则常用0.45μm的滤膜过滤。
3.加入化学保存剂
保存剂可以在实验室中预先加入已洗净晾干的水样容器内,也可在采样后加入水样中,为避免保存剂在现场被沾污,最好在实验室将其预先加入容器内。但是,易变质的保存剂不能预先添加。不同水样和不同的被测物要求加入不同的保存剂。(https://www.xing528.com)
(1)加冻菌剂。为了抑制生物作用,往样品中加入冻菌剂,如在测![]()
![]() 的水样中,加入20~40mg/L Hg2Cl2。也有加入氯仿、甲苯作防腐剂,以抑制生物对
的水样中,加入20~40mg/L Hg2Cl2。也有加入氯仿、甲苯作防腐剂,以抑制生物对![]() 的氧化还原作用。在测酚水样中加H3PO4调至pH=4,加入CuSO4溶液(1g CuSO4·5H2O/L)以控制苯酚分解菌的活动。
的氧化还原作用。在测酚水样中加H3PO4调至pH=4,加入CuSO4溶液(1g CuSO4·5H2O/L)以控制苯酚分解菌的活动。
(2)加氧化剂。水样中痕量汞易被还原,引起汞的挥发性损失,大量实验证明,实际水样加入HNO3—K2Cr2O7,可使汞维持在高氧化态,汞的稳定性大为改善。
(3)加还原剂。测硫化物的水样,加入还原剂抗坏血酸保存。含余氯的水样,余氯可使CN-氧化,可使酚类、烃类、苯系物氧化生成相应的衍生物,为此在采集水样时应加入适量Na2S2O3溶液予以还原,把余氯除去。
(4)调节pH值。测定金属离子的水样常用HNO3酸化至pH=1~2,既可以防止重金属的水解沉淀,又可以防止金属在器壁表面上的吸附,同时还能抑制生物的活动和防止微生物的絮凝、沉降。按此种方法保存,大多数金属可稳定数周或数月。加碱保存也能抑制和防止微生物的代谢过程。测氰化物或挥发酚的水样,需加NaOH调pH值至12。测定Cr6+的水样应加NaOH调整pH值至8,因在酸性介质中,Cr6+的氧化电位高,易被还原。
以上是常用方法,但不是通用方法,例如测定氰化物水样应加碱至pH=11保存,因为酸性条件下氰化物会产生HCN逸出。
(三)水样保存条件
1.常用水样保存技术
水样的有效保存期限长短,主要依赖于待测物的浓度、化学组成和物理化学性质。一般说来,待测物浓度高保存时间长,否则保存时间短;清洁水样保存时间长,而复杂的生活污水和工业废水保存时间短;稳定性好的成分保存时间长,不稳定的成分保存时间就短,甚至不能保存,需取样后立即分析或现场测定。
由此可见,对水样的保存不可能给出绝对的准则。样品的保存时间、容器材质的选择以及保存措施的应用不仅取决于样品中的组分和浓度,还取决于样品的性质,而现实中的水样又是千差万别的。表3-11列出了水环境监测常用样品保存一般条件。每个分析工作者应结合具体工作验证这些要求是否适用,在制定分析方法标准时应明确指出样品采集和保存的方法。
表3-11 水样保存和容器的洗涤

续表
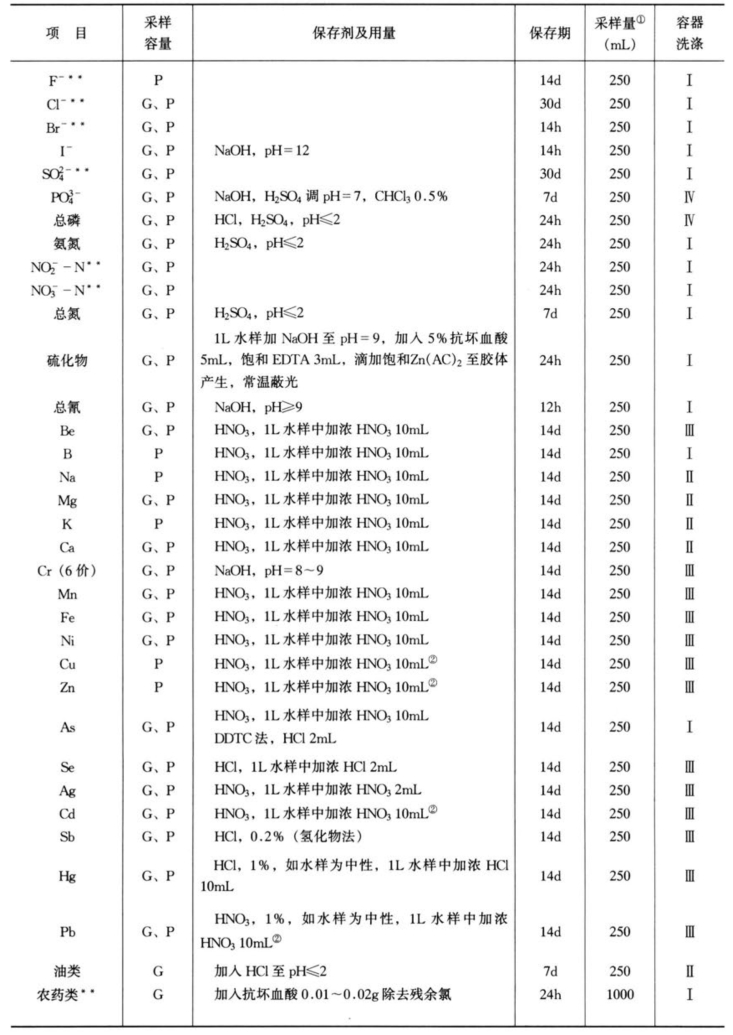
续表
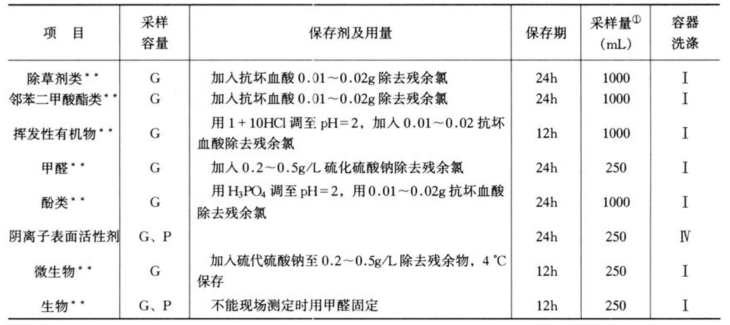
注 1.G为硬质玻璃瓶;P为聚乙烯瓶(桶)。
2.Ⅰ、Ⅱ、Ⅲ、Ⅳ表示四种洗涤方法,如下:
Ⅰ:洗涤剂洗一次,自来水三次,蒸馏水一次;
Ⅱ:洗涤剂洗一次,自来水洗二次,1+3HNO3荡洗一次,自来水洗三次,蒸馏水一次;
Ⅲ:洗涤剂洗一次,自来水洗二次,1+3HNO3荡洗一次,自来水洗三次,去离子水一次;
Ⅳ:铬酸洗液洗一次,自来水洗三次,蒸馏水洗一次。
如果采集污水样品可省去用蒸馏水、去离子水清洗的步骤。
3.经160℃干热灭菌2h的微生物、生物采样容器,必须在两周内使用,否则应重新灭菌;经121℃高压蒸汽灭菌15min的采样容器,如不立即使用,应于60℃将瓶内冷凝水烘干,两周内使用。细菌监测项目采样时不能用水样冲洗采样容器,不能采混合水样,应单独采样后2h内送实验室分析。
①为单项样品的最少采样量。
②如用溶出伏安法测定,可改用1L水样中加19mL浓HClO4。
*表示应尽量作现场测定。
* *低温(0~4℃)避光保存。
2.水样保存注意事项
(1)在采样前应根据样品的性质、组成和环境条件,确定和检验所选保存方法和保存剂的可靠性。
(2)酸和其他化学保存剂本身含有微量杂质。再者,保存剂在现场使用一定时间后,也可能被污染。因此,在分析一批水样时,必须做空白试验,把同批的等量保存剂加入与水样同体积的蒸馏水中,充分摇匀制成空白样品,与水样一直起送实验室分析。在分析数据处理时应从水样测定值中扣除空白试验值。
(3)使用保存剂时必须考虑到,保存剂可能由于对分析方法有干扰而影响随后的分析。若有怀疑则应进行试验,以检查其相容性。由于加入保存剂而引起样品“稀释”的问题,在分析过程中以及结果计算时均应考虑进去。最好使加入的保存剂有足够的浓度,这样只需很小的体积,在大多数情况下就不必考虑相应的稀释问题。
(4)加入保存剂还会改变欲测物的化学或物理性质与形态,故应考虑到这些变化对以后所进行的测定要有可比性,不致产生矛盾。例如,酸化会使胶体组分或固体溶解,因此,若需要测定的项目是溶解组分时,则使用酸化手段就需慎重;如果要分析项目是对水生动物的毒性进行测定,则必须避免将某些组分,特别是将重金属溶解,因为其离子态是有毒的。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




