水质分析结果的检验要从两个方面来进行:一方面应对水样的采集、运送、贮存、仪器、试剂以及每个监测项目的分析测定等全过程作全面的检查,进行必要的分析质量控制;另一方面应根据化学的基本原理,利用同一水样各个被测项目之间的关系和规律性,对水质分析结果的正确性和可靠性进行验证。
(一)水中阴、阳离子平衡的校核
根据水溶液中阴离子和阳离子电荷平衡的原则,在理论上每升水中阳离子总数∑K与阴离子总数∑A应该相等,分析误差δ不得大于5%,即:
![]()
通常,天然水与工业用水及饮用水中,主要阳离子为Ca2+、Mg2+、Na+、K+;主要阴离子为![]() 。对于酸性水与碱性水,还应考虑H+、OH-与
。对于酸性水与碱性水,还应考虑H+、OH-与![]() 。一般而言,其他离子含量甚微,可以忽略不计。因此,在进行离子平衡检验时,只需按下式进行计算:
。一般而言,其他离子含量甚微,可以忽略不计。因此,在进行离子平衡检验时,只需按下式进行计算:

式中 H+、…、OH-、…——各离子的浓度,mg/L。
(二)溶解固体与离子含量的校核
通常以180℃下烘干而得出的溶解固体的含量W(mg/L)进行计算,W应等于离子的含量减去重碳酸盐含量的一半,分析误差不超过5%。这是因为在分析过程中,由于水样烘干至恒重,水中重碳酸盐分解转变成碳酸根而造成二氧化碳和水蒸气的损失,这部分损失的量约等于水中原有重碳酸根含量的一半:

式中 ![]() ——重碳酸盐的含量,mg/L。
——重碳酸盐的含量,mg/L。
(三)pH值与![]() 及游离CO2的校核
及游离CO2的校核
一般天然水体,其pH值一般在6.5~8.5范围内,此时,水体中![]() 近似为0。只需考虑一级碳酸平衡:
近似为0。只需考虑一级碳酸平衡:
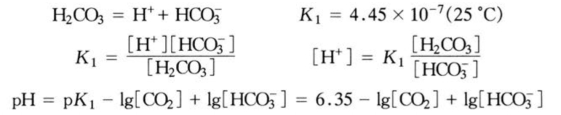
对于某些碱性很强(pH>8.3)的水体,其中游离CO的浓度可忽略不计,只需考虑![]() 与
与![]() 的二级碳酸平衡,即
的二级碳酸平衡,即

式中![]() ——水中游离二氧化碳、游离碳酸、重碳酸盐及碳酸盐的摩尔浓度,mol/L。
——水中游离二氧化碳、游离碳酸、重碳酸盐及碳酸盐的摩尔浓度,mol/L。
用上式进行检验时,pH值计算值与测量值之差一般不应大于0.2pH。由于用酸碱滴定法测定CO2不易得到精确的结果(因为空气中CO2对水样的污染与酚酞指示剂的等当点pH=8.3由酸向碱过渡不易掌握;对于高硬度的水,又可能产生CaCO3沉淀干扰),因此,本检验方法的误差可能较大。
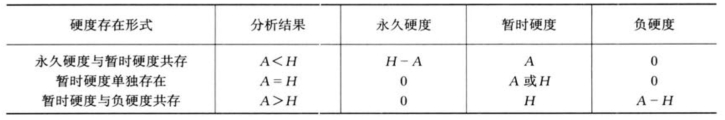
(四)总硬度与总碱度的校核
水中硬度与总碱度分别以钙镁离子总量及重碳酸根、碳酸根表征。总硬度又分为暂时硬度(碳酸盐硬度)、永久硬度(非碳酸盐硬度)和负硬度(碳酸钠、碳酸钾硬度)。其相
互关系如下:
(1)当有永久硬度时,应没有负硬度,此时:
![]()
且
永久硬度=总硬度-总碱度 暂时硬度=总碱度<总硬度
(2)当有负硬度时,应没有永久硬度,此时:
![]()
且
总硬度=暂时硬度<总碱度 负硬度=总碱度-总硬度
(3)当没有永久硬度和负硬度,只有暂时硬度,此时:
总碱度=总硬度 总硬度=总碱度=暂时硬度
(4)硬度与碱度的关系,如表1-14所示。(https://www.xing528.com)
表1-14 水的硬度(H)与碱度(A)的关系
(五)电导率与溶解固体的校核
电导是水溶液的电阻的倒数,水中溶解的盐类越多,离子也越多,电阻就越小,水的电导就越大。因此测定水样的电导率可大致估计水的总含盐量,也可以间接表示水中溶解固体的多少。换句话说,水样的电导率和溶解固体存在一定的相关关系。对于多数天然水来说,溶解固体与电导率之间的关系可用下面的经验公式估算:
TDS=(0.55~0.70)γ
式中 TDS——水中溶解固体,mg/L;
γ——25℃时水的电导率,S/m。
上式只是粗略地反映了溶解固体与电导率之间的数量关系,系数0.55~0.70随不同水质而异。如果水中含有较多的游离酸或荷性碱度,此系数可能小于0.55;如果水中含有大量盐分,则又可能超过0.7。一般估算可取0.67。
(六)列表
把检测结果列成表,通过计算检验硬度、碱度和各离子之间的关系。
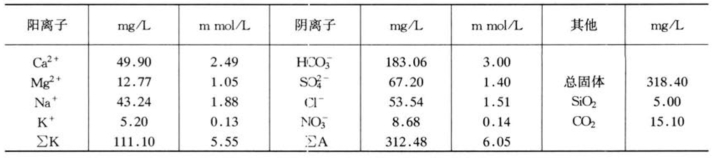
例如,某自来水样品分析结果如下:Ca2+49.90mg/L,Mg2+12.77mg/L,Na+43.24mg/L,K+5.20mg/L,![]()
![]() 总固体(180℃)318.40mg/L,总硬度3.56m mol/L,pH=7.43,CO2 15.10mg/L,试检查分析结果的正确性。
总固体(180℃)318.40mg/L,总硬度3.56m mol/L,pH=7.43,CO2 15.10mg/L,试检查分析结果的正确性。
将上述测试数据列表如下:
(1)离子平衡:

(2)溶解固体与离子含量的关系:
![]()
溶解固体![]()
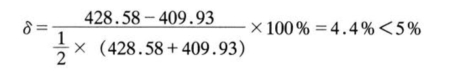
(3)pH值与![]() 及游离CO2的关系:
及游离CO2的关系:
![]()
则与测量值之差:
![]()
(4)硬度、碱度和离子含量间的关系:
![]()
即总硬度(H)>总碱度(A),说明存在永久硬度。
永久硬度=总硬度-碳酸盐硬度=3.54-3.00=0.54(m mol/L)

也说明存在永久硬度(如存在Ca2+、Mg2+的氯化物与硫酸盐)。
以上检验证明,分析结果是正确的。
分析结果的检验是水分析的重要步骤,通常是以前两项检验为主,后两项可用于检验某些项目之间的关系,对确定水样所属的水质类型有所帮助。如果前两项检验合格,则基本上可以确定分析结果是正确的。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




