如何解释酶高度特异性及高度催化效率的特点,目前有以下几种公认的学说。
1.酶-底物复合物的形成和诱导契合学说 酶在发挥其催化作用之前,酶和底物相互诱导,相互变形,相互适应,进而两者结合,形成酶-底物复合物,这种酶与底物相互诱导结合过程,称为诱导 契 合学说(induced-fit hypothesis)(图3-7)。该学说认为酶分子的构象与底物的结构本身并不是完全吻合,酶在底物分子作用下发生的构象改变,利于酶活性中心的形成,并与底物受催化部位靠近。底物在酶诱导下也发生变形,形成具有高度反应能力的过渡态(transition state),而易受到酶的攻击。过渡态的底物与酶的活性中心结合可释放能量,释放的能量称为结合能。结合能是抵消活化能的主要自由能,是酶促反应降低活化能的主要机制。

图3-7 酶与底物结合的诱导契合学说
2.邻近效应和定向排列 通常酶促反应的底物浓度很低,底物分子之间碰撞的概率很少。在化学反应体系中只有底物分子之间以正确方向相互碰撞才能发生反应。在酶的作用下,底物可聚集到酶的活性中心部位,它们相互靠近形成利于反应的正确定向关系。同时底物与酶活性中心结合时,也可诱导酶蛋白发生一定构象变化,使其催化基团和结合基团正确排列定位,利于底物和酶更好地互补,这过程称为邻近效应(proximity effect)和定向排列(orientation arrange,图3-8)。实际上该过程是将分子间的反应变成类似分子内的反应,使反应速率显著提高。用X线衍射分析已经证明了在溶菌酶及羧肽酶中存在着邻近效应和定向排列作用。

图3-8 邻近效应和定向排列
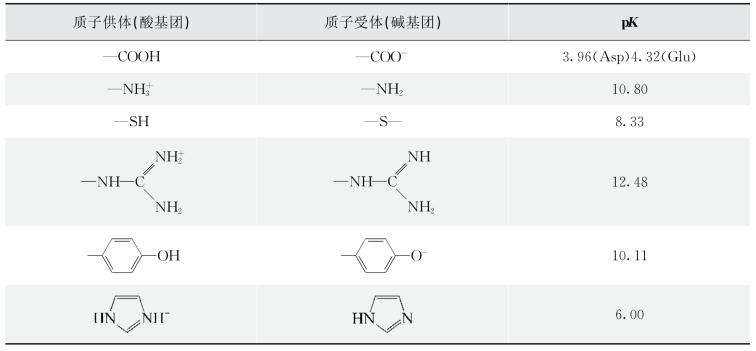
3.多元催化 一般催化剂发挥催化作用时,仅有一种解离状态,只有酸催化,或只有碱催化,很少酸碱催化功能兼而有之。而酶具有两性解离性质,分子内不同基团的p K不等,解离程度不一。即使同一种功能基团,由于各自在蛋白分子中所处的微环境不同其解离度也可不同,即酶活性中心上有些基团是质子供体(酸),有些是质子受体(碱)(表3-4),也就是说即可起亲核催化,又可起亲电子催化作用。可见,酶具有多元催化(multielement catalysis)作用。(https://www.xing528.com)
表3-4 酶活性中心的酸碱基
亲核催化(nucleophilic catalysis)是指亲核催化剂可放出电子攻击缺少电子并具有部分正电性的原子,形成不稳定的共价中间复合物,降低反应活化能,加速反应进程。如胰凝乳蛋白酶中丝氨酸残基的—OH是该酶活性中心的必需基团,当底物结合在酶上后,此—OH基团中的氧原子有非配对电子对能发挥亲核作用,攻击底物肽键中羰基中的C(具有部分正电性)导致肽键的断裂,形成一个不稳定的中间产物——酰基化酶,后者易将酰基转移给水完成水解作用(图3-9)。亲电子催化(electrophilic catalysis)是由酶活性中心内带正电的原子对底物中带负电的原子进行攻击而形成。
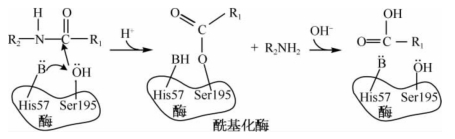
图3-9 胰凝乳蛋白酶的亲核催化
4.表面效应 酶的活性中心多位于其分子内部的疏水“口袋”中,即底物与酶的反应在酶分子内部疏水环境中进行。因为疏水环境能排除周围大量水分子对酶和底物的功能基团的干扰性吸引或排斥,防止两者之间形成水化膜,利于底物和酶分子之间的直接密切接触,故在疏水环境中进行酶促反应有很大的优越性,称为表面效应(surface effect)。
事实上,一种酶的催化反应中常常包括多种催化机制,如溶菌酶的催化作用即有表面效应、多元催化,又有邻近效应及诱导契合等。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




