酶是生物催化剂,它遵守一般催化剂的共同性质,如在化学反应前后都没有质和量的改变;只能促进热力学上允许进行的反应;等效地加速正、反两向反应,而不能改变反应的平衡点,即不改变反应的平衡常数。酶和一般催化剂都是通过降低反应活化能而使反应速率加快的。但因为酶的化学本质是蛋白质,因此又具有不同于一般催化剂的特点,其显著特点有以下几点。
(一)酶的催化效率极高
酶的催化效率通常比非催化反应高108~1012倍,比一般催化剂高107~1013倍。已知任何一种热力学允许的反应体系中底物分子所含自由能平均水平较低。只有那些能量较高,达到或超过一定能量水平的分子才有可能发生化学反应,这些分子被称为活化分子。使底物分子全部变成活化分子(从基态转变为过渡态)所需的能量称为活化能(activation energy),单位为kJ/mol。酶促反应中活化分子愈多,反应速率愈快。要使反应加速进行,或给予活化能,如加热,使分子活化;或降低反应活化能。酶和一般催化剂相同,都是通过降低反应活化能而使反应加速的。酶比一般催化剂更有效地降低活化能,能使底物只需较少的能量便可进入过渡态,发挥高度的催化效率(图3-4)。
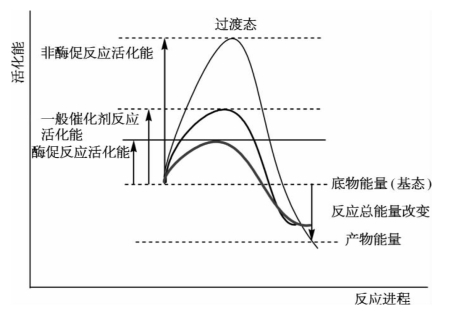
图3-4 酶促反应活化能的变化
例如,在过氧化氢分解成水和氧的反应中:
2H2O2→2H2O+O2
无催化剂时,每摩尔需活化能75 312 J;用胶态钯作催化剂时,每摩尔需活化能为48 953 J;而用过氧化氢酶作为催化剂时,每摩尔需活化能小于8 368 J,即用酶催化可使反应活化能大幅度下降,反应速率可增加千万倍。
(二)酶具有高度特异性
一般催化剂可催化同一类型的许多种化学反应。如H+可催化淀粉、脂肪、蛋白质等多种物质的水解,对底物结构没有严格的选择性。酶对所催化的底物具有严格的选择性,即一种酶只作用于一种或一类化合物,或一种化学键,催化一定的化学反应并产生一定结构的产物,这种现象称为酶的特异性或专一性(specificity)。根据各种酶对其底物结构要求的程度不同,酶的特异性可大致分为以下三种类型。
1.相对特异性 大多数酶作用于一类化合物或一种化学键,这种不太严格的选择性称为相对特异性(relative specificity)。脂肪酶不仅水解脂肪,也可水解简单的酯;蔗糖酶不仅水解蔗糖,也可水解棉子糖中的同一种糖苷键;蛋白酶则可水解各种蛋白质的肽键。消化道的蛋白酶只对构成肽键的氨基酸残基种类有选择性,如胰蛋白酶仅水解由碱性氨基酸的羧基所形成的肽键,胰凝乳蛋白酶能水解中性芳香族氨基酸的羧基所形成的肽键,弹性蛋白酶水解中性脂肪族氨基酸的羧基所形成的肽键;羧基肽酶和氨基肽酶只能分别水解多肽链的C-端和N-端的肽键(图3-5)。(https://www.xing528.com)

图3-5 消化道中各种蛋白酶的键专一性
2.绝对特异性 有的酶只能作用于特定结构的底物,进行一种专一的反应,生成特定结构的产物,这种特异性称为绝对特异性(absolute specificity)。例如,脲酶只能催化尿素水解生成NH3和CO2。该酶对与尿素结构相近的甲基尿素就无催化作用。在自然界中这类酶较少见。
3.立体异构特异性 一些酶仅对其底物的一种立体异构体进行催化反应,或其催化的结果只产生一种立体异构体,酶对立体异构物的这种选择性称为立体异构特异性(stereospecificity)。如乳酸脱氢酶仅能催化L-乳酸脱氢,而对D-乳酸不发生作用(图3-6)。另外,肠道的淀粉酶只能水解淀粉中α-1,4-糖苷键,但不能水解纤维素中葡萄糖残基间的β-糖苷键,因此人类肠道酶能使淀粉水解,而不能消化纤维素。

图3-6 乳酸脱氢酶的立体异构特异性
(三)酶活性的可调节性
酶活性是指酶催化化学反应的能力,也称酶活力。机体通过对酶活力的调节,控制机体内的各种代谢反应。以酶为中心的调控系统是机体整体水平调节和激素水平调节的基础。机体对酶促反应速率的调节包括对酶活性、酶含量和底物浓度的调节。这些调节将直接影响体内物质代谢的速率。
(四)酶具有不稳定性
酶的化学本质是蛋白质,在高温、强酸、强碱等理化因素条件下,可发生变性而失去活性。因此多数酶促反应需要在常温、常压和pH中性环境条件下进行。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




