研究蛋白质的结构和功能需要高纯度的蛋白质样品。利用蛋白质的不同物化特性可以将待研究的蛋白质从众多生物分子的混合物中分离出来。
1.超速离心法 利用超声、化学处理(化学溶剂或生物裂解剂)或机械研磨(高速组织捣碎或玻璃匀浆器)等方法把细胞破碎,使细胞中的蛋白质充分地释放在缓冲液中,然后利用超速离心方法可以将蛋白质从匀浆物质溶液中分离出来。
蛋白质在高达500 000 m/s2的重力作用下,在溶液中逐渐沉降,直到其浮力与离心力相等时,沉降停止。蛋白质在离心场中的行为用沉降系数(S)表示,它与蛋白质的密度和形状密切相关。不同蛋白质的密度和形状各不相同,表现出不同的沉降系数,因此可以利用超速离心法被分离开。
2.丙酮沉淀和盐析 将有机溶剂如丙酮或乙醇,加入到含有蛋白质的液体中可使水溶性的蛋白质受到疏水力作用而聚集在一起从溶液中沉淀出来。有机溶剂应不小于蛋白质液体体积的10倍。沉淀后的蛋白质应当立即分离以防蛋白质变性。该方法必须在0~4℃的低温环境中进行。
在蛋白质溶液中加入过量的盐,如硫酸铵、硫酸钠或氯化钠,可以使蛋白质表面电荷被中和掉,并且破坏水化膜,导致蛋白质在溶液中产生沉淀。这一过程称为盐析(salt precipitation)。盐析沉淀不会引起蛋白质的变性,当除去盐后,蛋白质即可溶解。
3.透析 透析(dialysis)是利用蛋白质分子不能透过半透膜的性质,将蛋白质分子和小分子物质(无机盐、短肽或小蛋白质分子)分开的方法。透析袋是具有微孔的膜,如硝酸纤维素膜。微孔的大小决定了只允许分子量小于特定值的小分子物质扩散出透析膜,而大分子量的蛋白质则滞留在透析袋内。这个特定值称为截留分子量(cut-off molecular weight)。将蛋白质溶液装在透析袋内,再将透析袋置于透析液中,小分子物质就会扩散出透析袋。经过几次更换透析袋外的透析液,透析袋内小分子物质的浓度可以降低到最小的期望值。如在透析袋的水中加入诸如聚乙二醇等吸水剂,袋内的水分子将伴同小分子物质一起透出带外,达到浓缩的目的(图1-34)。
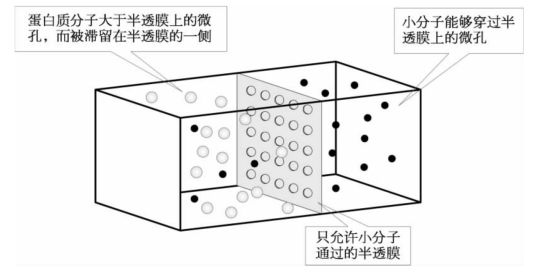
图1-34 利用透析方法分离蛋白质的示意图
利用压力或离心力强行使水和小分子物质透过半透膜,而将蛋白质截留在膜上,从而将蛋白质和小分子分离开,此法称为超滤(ultrafiltration)。
4.层析 层析(chromatography)是利用蛋白质在不同物质相中的分配不同的原理分离和纯化蛋白质的方法。待分离的蛋白质随着样品溶液(也称为流动相)流经一个固定相时,由于蛋白质的颗粒大小、所带的电荷,以及与固定相亲和力的不同,使得不同的蛋白质在固定相和流动相中的分配有所不同。这样,当样品溶液以不同的速度流经固定相时或用不同的洗脱液清洗固定相时,不同的蛋白质就会依次地流出固定相,从而实现蛋白质的分离(图1-35)。
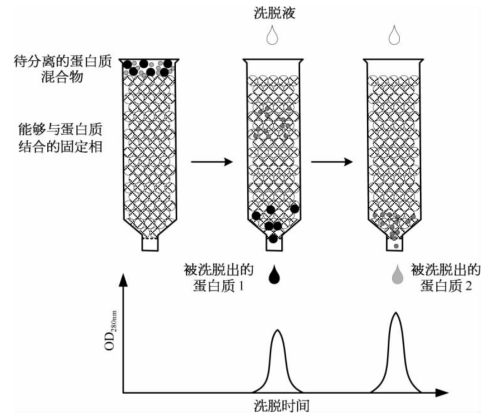
图1-35 利用层析技术分离蛋白质的示意图
(1)凝胶过滤层析:凝胶过滤(gel filtration)又称分子筛层析(molecular sieve)。层析柱内填满了带有筛孔的葡聚糖颗粒,形成一个固定相。将蛋白质混合物溶液加于层析柱的顶端后,所有的蛋白质分子将随着液体的下流通过固定相。小分子蛋白质在流经层析柱时可以自由地出入颗粒的筛孔,使其在层析柱中有较长的滞留时间,而大分子蛋白质不会进入到颗粒的筛孔,则径直流过固定相。层析柱固定相起到了分子筛效应,其结果是大分子蛋白质最先流出固定相,而小分子蛋白质则在较后的时段内流出,实现了蛋白质的分离(图1-36)。
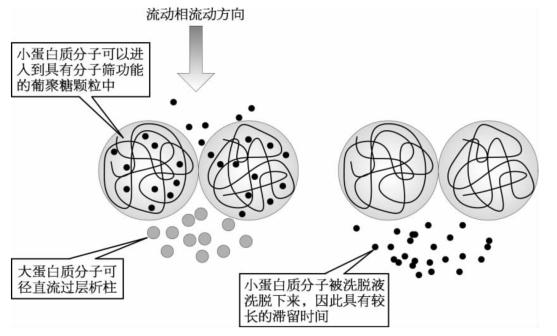
图1-36 凝胶过滤层析分离蛋白质的示意图
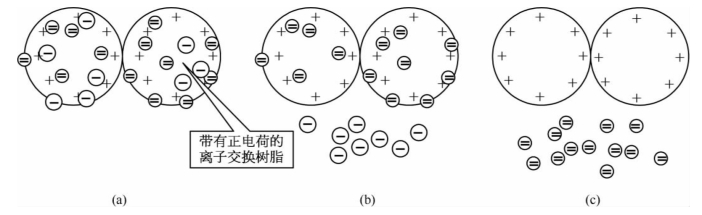
(2)离子交换层析:填充层析柱的阴离子交换树脂颗粒上带有正电荷,能够吸附溶液中的带负电荷的物质。当蛋白质混合物的溶液流经层析柱时,带有负电荷的蛋白质就会吸附在层析柱上。然后再用含有负离子(如Cl-)的洗脱液清洗层析柱。由于带有较少负电荷的蛋白质与层析柱的结合力弱,就会首先被洗脱下来。逐渐地增加洗脱液中的负离子强度,可使带有较多负电荷的蛋白质依次洗脱下来(图1-37)。
 (https://www.xing528.com)
(https://www.xing528.com)
图1-37 离子交换层析分离蛋白质的示意图
(a)带有负电荷的蛋白质分子与阴离子交换树脂的结合 (b)负电荷较少的蛋白质分子与阴离子交换树脂的结合力弱,可被低离子强度的洗脱液洗脱下 (c)带有较多负电荷的蛋白质分子与阴离子交换树脂的结合力强,需要高离子强度的洗脱液洗脱下来
(3)亲和层析:当蛋白质混合物的溶液流经层析柱时,只有待分离的蛋白质才会被吸附在层析柱的树脂颗粒上,而其他蛋白质则径直流出层析柱。然后,用特定的洗脱液将结合在树脂颗粒的蛋白质洗脱下来(图1-38)。

图1-38 亲和层析分离蛋白质的示意图
5.电泳 蛋白质在电场力的作用下会发生迁移。利用蛋白质在电场中泳动速度的不同来分离蛋白质的技术称为电泳(electrophoresis)。目前常用的是凝胶电泳,其支撑物是琼脂糖凝胶(agarose gel)或聚丙烯酰胺凝胶(polyacrylamide gel)。凝胶置于玻璃管中或加在两片玻璃板之间,在凝胶的两端加上正负电极,蛋白质即可在凝胶中移动。电泳结束后,利用显色方法,可以看到一条条被分离的蛋白质条带。
(1)SDS-聚丙烯酰胺凝胶电泳:十二烷基磺酸钠(sodium dodecyl sulfate,SDS)在水溶液中带有一定的负电荷,它们可以在蛋白质分子的表面形成一层SDS分子,其密度大约是每两个氨基酸残基结合一个SDS分子。这就消除了蛋白质分子原本所带电荷的差异。其结果是蛋白质在电场中的泳动速度仅与电荷/蛋白质比的大小有关。作为支撑物的聚丙烯酰胺凝胶是具有网状结构的凝胶状介质,聚合物单体在连结物(linker)的作用下形成具有网状结构的高分子,其网状孔径的大小由聚合物单体浓度和连结物浓度所决定,起到了分子筛效应。在外电场和聚丙烯酰胺凝胶的共同作用力下,越小的蛋白质分子泳动得越快,从而将蛋白质的混合物分离开来(图1-39)。
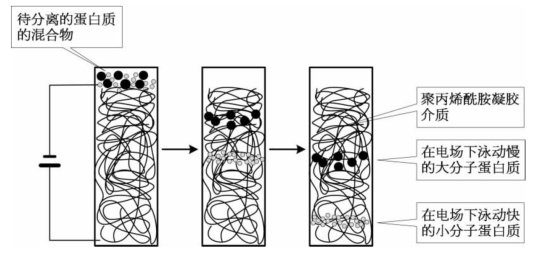
图1-39 聚丙烯酰胺凝胶电泳的工作原理示意图
(2)等电聚焦电泳:当在聚丙烯酰胺凝胶中加入两性电解质载体后,聚丙烯酰胺凝胶可以形成一个连续而稳定的pH梯度,即一个由阳极到阴极逐步变化的pH梯度,正极为酸性,负极为碱性。这样,蛋白质在偏离等电点的pH位置上就会出现净电荷。在电场作用下,该蛋白质将发生泳动。当蛋白质泳动到与其pI相等的pH凝胶位置时,该蛋白质的净电荷为零,蛋白质停止移动。而具有其他pI的蛋白质还会在电场中继续泳动,直到它们达到与pI值相等的pH凝胶位置后而停止泳动。这种方法被称为等电聚焦电泳(isoelectric focusing electrophoresis)(图1-40)。
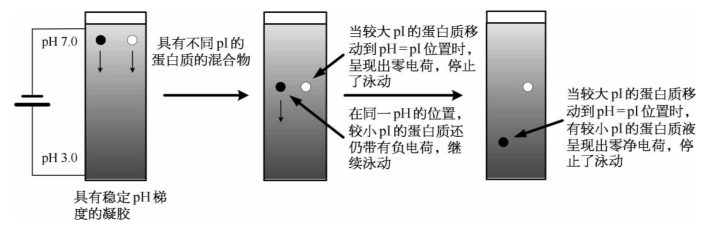
图1-40 等电聚焦电泳的工作原理示意图
(3)二维电泳:由SDS-聚丙烯酰胺凝胶电泳和等电聚焦电泳构成的二维电泳可以高通量分析蛋白质。首先利用等电聚焦将不同的蛋白质按照pI进行分离,而后将等电聚焦胶条置于SDS-聚丙烯酰胺凝胶的顶部,再按照蛋白质的大小对其进行分离(图1-41)。
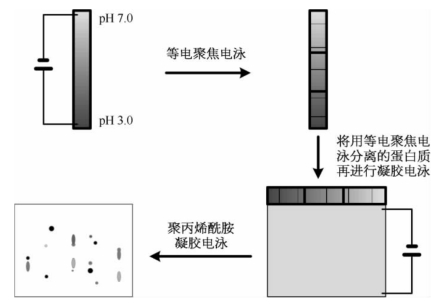
图1-41 二维电泳的工作原理示意图
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




