蛋白质广泛地分布在人体的各个部分,担负着完成体内各种生理功能的任务。蛋白质的主要功能有:①调控作用:调节物质代谢的进行与基因表达的调控功能;②催化作用:生物体内的生物反应几乎都是在酶催化下实现的;③信号转导:通过受体的特异性结合,蛋白质直接参与了细胞间和细胞内的信息传递;④物质输运:蛋白质输运和储存物质以保证体内生物活动的正常进行;⑤识别防御:蛋白质能够识别不同外源物质和实施相应的防御;⑥结构与运动:蛋白质是构建各类细胞和组织的最基本结构单元,并参与了机体各部分的协调运动。
1.血红素 肌红蛋白和血红蛋白能够储存和输运氧分子,是由于血红素存在其中的原因。血红素是含铁的卟啉化合物。4个吡咯环通过4个甲炔基形成1个环状,Fe2+居于环中,与4个吡咯环的氮形成了4个配位键(图1-22)。在肌红蛋白中,血红素中的Fe2+与93位的F8组氨酸咪唑基团的氮形成了第5个配位键,与氧分子形成了第6个配位键(图1-23)。
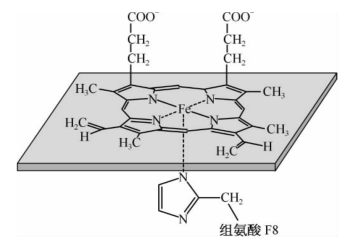
图1-22 血红素的化学结构式

图1-23 血红素中的Fe2+的第5个和第6个配位键的形成
X线衍射法分析表明肌红蛋白是一个单链蛋白质,有8段α-螺旋结构,分别记为A、B、…H肽段。整个肽链折叠成紧密的球状分子,具有极性或电荷的侧链在分子表面,疏水的侧链则包埋在球状的内部。球状Mb的内部有一个袋状空穴,血红素居于其中,与蛋白质部分稳定地结合。
血红蛋白由2个α亚基和2个β亚基组成(α2β2)。α亚基有141个氨基酸,β亚基有146个氨基酸。每个亚基的三维结构与肌红蛋白的非常相似,因此一个血红蛋白质分子可以结合4个O2。4个亚基通过8对离子键结合在一起形成亲水的球状分子(图1-16、图1-17)。
2.与O2结合的能力 Mb和Hb可以可逆地与O2结合。Mb和Hb结合O2的能力用氧饱和度来衡量,即氧合Hb占总Hb的百分数随O2分压变化的规律。Mb的氧饱和度呈直角双曲线,而Hb的氧饱和度曲线呈“S”形(图1-24),这表明在氧分压PO2较低时,Mb易于与O2结合,而Hb则不易结合。Hb的氧饱和曲线还表明Hb的4个亚基与O2分子的结合常数各不相同。在氧分压较低时,Hb的第一个亚基与O2的结合促进了第二个亚基与O2结合,Hb的第二个亚基与O2的结合又促进了第三个亚基与O2结合。以此类推,前三个亚基与O2结合进一步增强了第四个亚基与O2的结合。因此,Hb的最后一个亚基与O2的结合常数为最大。Hb的这种效应称为正协同效应(positive cooperativity)。Hb利用这种正协同效应提高了携氧能力。肺泡中的氧分压为100 mm Hg,Hb在肺泡中的氧饱和度是97%,肌肉的毛细血管中氧分压为20 mm Hg,Hb所对应的氧饱和度是25%,两者相差72%。这样,Hb将有效地释放出O2(图1-24)。
 (https://www.xing528.com)
(https://www.xing528.com)
图1-24 血红蛋白和肌蛋白的氧饱和度曲线
3.血红蛋白是一个变构蛋白 Hb在非氧合时,α1/β1和α2/β2呈对角排列,结构紧密,称为紧张构象(T构象)。处在T构象的Hb与O2的亲合力较小。Hb在氧合时,O2与Fe2+形成了第6个配位键,使得Fe2+更接近卟啉环平面内,同时又带动了His F8残基以及连带的位移(图1-25)。由此引起了8对离子作用力的变化,使得α1/β1相对于α2/β2发生了15°的转动(图1-26),其结果是四级结构变成为松弛构象(R构象)。Hb的一个亚基与O2结合后引起了Hb的构象变化,这种现象称为变构效应(allosteric effect),Hb则称为变构蛋白,O2称为变构剂。
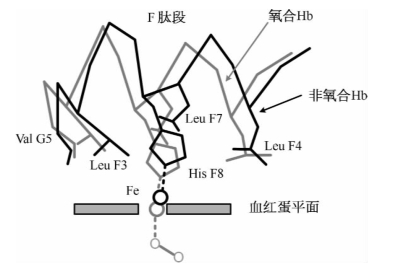
图1-25 氧合导致血红蛋白(灰色)的局部结构变化的示意图
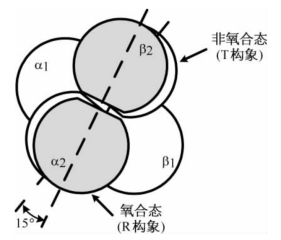
图1-26 氧合血红蛋白的整体结构变化
4.正力协同效应 变构模型假设T构象的Hb具有较低的结合能力,而R构象的Hb具有较高的结合能力。虽然O2不易与T构象的Hb结合。但是一旦氧合发生,Hb的第一个亚基就从T构象变到R构象。这个亚基的氧合增强了邻近亚基的氧合能力,进一步导致Hb的第二个亚基从T构象到R构象的转化,从而依次促进了第三个亚基和第四个亚基的氧合过程(图1-27)。

图1-27 解释血红蛋白变构效应的模型
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




