2.
综上所述,形成σ-配键能力:RNC >> CO >> N2;形成反馈π键能力:CO > N2 > RNC。
3.ΘS2COEt可以“双齿”或“单齿”配位:
若[Te(S2COEt)3]-中3个ΘS2COEt均以“双齿”对Te(Ⅱ)配位,则Te(Ⅱ)价层有4+4×3=16e,即8对电子,按VSEPR模型,应采取十二面体构型,Te(Ⅱ)两孤对电子位于轴向(反位),以使电子互斥作用最小。但这种结构中,Te(Ⅱ)原子有2孤电子对,每个S原子上各有1孤电子对,共有8对孤对电子,互斥作用太大,很不稳定,以致其中一个顶点S原子“脱掉”,即有一个ΘS2COEt以“单齿”配位,另2个ΘS2COEt仍以“双齿”配位,这样,5个S原子在赤道平面上与Te(Ⅱ)配位,形成“平面五边形”配位方式;Te(Ⅱ)价层共有4+4×2+2=14e,即7对,Te(Ⅱ)价电子构型为“五角双锥体”。
4.多硼酸根阴离子由BO4和BO3两种单元共用顶点氧原子构成,阴离子带电荷数=BO4单元个数。由于该硼酸盐组成实际为KB5O6(OH)4·2(H2O),阴离子B5O6(OH)-4带1个单位电荷,故BO4和BO3单元个数分别为1和4,结构式示意图如下:
5.
单元的结构式见下,含有6个3C-2e的AlHB氢桥键,其余均为正常共价单键。
6.由元素分析及分子量得该化合物分子式为B2N2C2H14,它的两种可能的结构为:
(a)为B2H6发生“均裂”的产物;(b)为“异裂”产物。
从11B NMR谱具有单一的四重峰看,(a)最能代表该化合物的结构,因为(a)式表明分子中的2个B原子是等价的,每个硼原子与3个H原子结合,发生偶合,使11B NMR峰分裂成四重峰,且峰的相对强度为1:3:3:1。(https://www.xing528.com)
7.(C5H5)2Mo(NO)I分子中同时存在η5-C5H5和η3-C5H5配位,其结构示意图见下,Mo价层电子总数=6+5+3+3+1=18e,所以该化合物符合“EAN规则”。
8.(1)主族元素形成五配位化合物时,中心原子采用sp3d杂化,此处d为外层d轨道,能级较高,而通常配体轨道能量较低,二者能量匹配不是很好,故沿该d轨道方向配位的配体与中心原子形成的键较弱,键长较长。TBP构型采用![]() 杂化,故z方向(即轴向)键较长;SPY构型采用
杂化,故z方向(即轴向)键较长;SPY构型采用![]() 杂化,故x方向和y方向(赤道平面)键较长。
杂化,故x方向和y方向(赤道平面)键较长。
(2)过渡金属离子具有未充满的d亚层,在[Ni(CN)5]3-中,Ni2+为3d8构型,采用内层![]() 空轨道参与dsp3杂化。由于
空轨道参与dsp3杂化。由于![]() 是空轨道,允许赤道平面4个CN-配体充分接近中心Ni2+成键,故赤道平面上4个Ni-C键比轴向(z方向)键短些。
是空轨道,允许赤道平面4个CN-配体充分接近中心Ni2+成键,故赤道平面上4个Ni-C键比轴向(z方向)键短些。
Cu2+为3d9构型,其![]() 为半充满,可认为该电子被激发至4d轨道,并以内层
为半充满,可认为该电子被激发至4d轨道,并以内层![]() 轨道参与dsp3杂化,这样,轴向(z方向)的两个Cl-配体就可以充分接近中心Cu2+成键,故轴向(z方向)Cu-Cl键会比赤道平面上的Cu-Cl键稍短。
轨道参与dsp3杂化,这样,轴向(z方向)的两个Cl-配体就可以充分接近中心Cu2+成键,故轴向(z方向)Cu-Cl键会比赤道平面上的Cu-Cl键稍短。
9.(1)由于足球烯分子由12个正五边形和20个正六边形组成,每个C原子都被3个五边形和六边形单元共享,所以[(12×5)+(20×6)]/3=60,就是说,足球烯的分子式为C60。
(2)![]() ,每个C原子形成2个单键,1个双键,共3个键,而成键包括2个C原子,故每个C60分子成键总数为:
,每个C原子形成2个单键,1个双键,共3个键,而成键包括2个C原子,故每个C60分子成键总数为:![]() =90(2/3个单键,1/3个双键),因此,C60分子中C-C平均键能=
=90(2/3个单键,1/3个双键),因此,C60分子中C-C平均键能=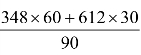 =436(kJ·mol-1)
=436(kJ·mol-1)
(3)(2)的计算C-C平均键能436 kJ·mol-1<480 kJ·mol-1。原因:(2)的计算未考虑离域π键的形成。若考虑在C60分子的球面上、下形成离域π键,甚至在各个相邻的C60“球”之间也存在一定的π电子离域性,则C-C平均键能应增大,这与Huffman报导的一致。
现有结构理论通常认为参与形成离域π键的各原子应该基本上在同一平面上。C60在球面上、下形成“离域π键”,甚至认为在相邻的C60“球”之间π电子也有一定离域性,这表明现有结构理论关于离域π键形成条件的叙述存在较大缺陷,应当修正、完善。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




