1.法国科学家Ludwig Mond于1884年发现部分镍阀门会被CO气体侵蚀,于是特意将镍粉放在CO气流中加热,于1890年合成得到了第一个易挥发的CO配合物——Ni(CO)4。纯净CO燃烧发出蓝色火焰,将CO通过还原镍丝,然后CO燃烧发出绿色的光亮火焰,可能与Ni(CO)4存在有关。
CO和金属原子的配位方式中,CO的端基配位(a)采用C(sp)轨道将其孤对电子的2个电子提供给M(dσ)空轨道,金属已填满电子的M(dπ)轨道将其电子反馈给CO的π*键。如果反馈键足够强,M-C键的强度能够从单键上升到双键的程度,CO键将会由叁键消弱至双键。
对于CO的双桥基对称配位方式(b),C(sp)轨道分别为2个M(dσ)空轨道各提供一个电子成键,金属已填满电子的M(dπ)轨道将其电子反馈给CO的π*键。为更有利于键合作用,CO中C端的杂化方式可能发生调整(sp2),从而使得σ成键作用加强。桥CO基上的O要比端CO的O具有更强的碱性,因为受到了第二个金属的进攻。
对于CO的双桥基不对称配位方式(c),CO与金属的成键方式介于端基配位和双桥基对称配位之间,半桥基CO具有弯曲的趋势,以便第二个金属原子接近。
对于CO与三个M采取面桥基配位的方式(d),金属已填满电子的M(dπ)轨道将其电子提供给CO的π*键,配体CO中C端的杂化方式可能发生调整(sp3),3个C(sp3)轨道中的电子对分别与3个M(dσ)空轨道成键。
对于CO与金属的侧基配位方式(e),C(sp)轨道将其孤对电子的2个电子提供给一个M(dσ)空轨道,金属已填满电子的M(dπ)轨道将其电子反馈给CO的π*键。与此同时,CO的π键电子提供给第二个M(dσ)空轨道,使得C-O间的键级有所削弱。
2.d6组态的金属配合物常采取六配位八面体配位构型,如Cr(CO)6;d8组态的金属配合物常采取五配位四方锥或三角双锥结构,如[Ni(CN)5]3-;d10组态的金属配合物常采取四配位的四面体结构,如Ni(CO)4。
直线型配位构型。配合物空间构型与d电子组态、配位键能、晶体场稳定化能、配体相互间的排斥作用等因素有关。
3.Fe(C5H5)2最稳定,因为该分子遵循18电子规则。稳定性次序:Fe > Ni > Co > V > Cr。三种金属茂分子中,M-C间距依次为:Fe-C=206.4 pm;CO-C=211.9 pm;Ni-C=219.6 pm;解离ΔH分别为:1470 kJ·mol-1,1400 kJ·mol-1和1320 kJ·mol-1。
1979年,Seiler和Dunitz用X射线单晶分析证明,Cp2Fe分子中,C-C键长都是138.9 pm,与未配位苯的C-C键长139.5 pm很接近,Fe-C距离均为206.4 pm。Cp2Co+中为151.9 pm,Cp2Fe+中为266.4 pm。
Fe(C5H5)2是橙色晶体,分子有18个价电子,它们分别填入9个成键与非键MO中,其电子组态为:(1a1g)2(1a2u)2(1e1g)4(1e1u)4(1e2g)4(2a1g)2(2e1g)0,因此该分子是稳定的,具有抗磁性;
Co(C5H5)2紫黑色晶体,分子有19个价电子,其电子组态为:(1a1g)2(1a2u)2(1e1g)4(1e1u)4(1e2g)4(2a1g)2(2e1g)1,反键轨道2e1g中填入一个电子,不稳定,容易在空气中氧化生成黄色的[Co(C5H5)2]+离子。(https://www.xing528.com)
Ni(C5H5)2绿色晶体分子有20个价电子,其电子组态为:(1a1g)2(1a2u)2(1e1g)4(1e1u)4(1e2g)4(2a1g)2(2e1g)2,反键轨道2e1g中填入两个电子,不稳定,容易在空气中氧化生成橙黄色的[Co(C5H5)2]+离子。
4.第一个含有氮分子的过渡金属分子氮配合物直到1965年才由加拿大化学家A D Allen和C V Senoff在常温常压下用水合肼还原五氯一水合钌(Ⅲ)酸钾或三氯化钌制得,其制备反应为:
直接用氮气与金属反应合成分子氮配合物是1967年实现的:
由于N的电负性较高,N2给电子形成σ键的能力较CO弱;N2分子的空π*轨道的能级比CO高,其接受过渡金属原子d电子的能力比CO差,所形成反馈π键也较弱,因此氮分子配合物的稳定性较羰基化合物差。
5.[Re2Cl8]2-中,Re(Ⅲ)是5d4构型,每个Re(Ⅲ)以dsp2杂化轨道![]() 与4个Cl-形成配键,z轴为Re-Re的键轴,Re以
与4个Cl-形成配键,z轴为Re-Re的键轴,Re以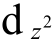 轨道在键轴方向相互重叠形成一个σ键,Re的dxz、dyz轨道以45˚角度方向伸出,它们相互重叠便形成2个d-dπ键。剩下的dxy轨道相互面对面重叠就形成δ键。因此[Re2Cl8]2-中形成Re-Re四重键。
轨道在键轴方向相互重叠形成一个σ键,Re的dxz、dyz轨道以45˚角度方向伸出,它们相互重叠便形成2个d-dπ键。剩下的dxy轨道相互面对面重叠就形成δ键。因此[Re2Cl8]2-中形成Re-Re四重键。
6.由于Cr有空的价层轨道,CO有5σ非键轨道的孤电子对,它们之间具备形成配位键的条件。6个CO配位体的5σ非键轨道,组合为σ群轨道,这些σ群轨道对称性分为a1g、eg、t1u共三组,它们分别与Cr的4s(a1g)、2个3d(eg)、3个4p(t1u)组合形成6个成键σ轨道和6个反键σ*轨道。6个CO配体中的6对非键电子对填充在成键分子轨道上,形成Cr(CO)6的6个σ配位键。这是 M←CO的σ键。Cr的另外3个3d(t2g)轨道,对称性与配体σ群轨道不匹配,成为3条非键轨道。Cr的6个价电子就填在这3个非键轨道上,所以非键轨道上电子对可视为Cr的3d电子。t2g轨道上的3对电子,还可向CO的空π*轨道反馈,形成 Cr→CO的反馈π键。因为配体CO在形成Cr(CO)6时,12个π*群轨道分为t1g、t2g、t1u、t2u四组,其中具有t2g对称性的3个π*轨道与Cr的3个3d(t2g)轨道对称性匹配、能量相近,组成6个分子轨道(3个成键π轨道和3个反键π*轨道),因此,Cr的3d(t2g)轨道上的3对电子填充到成键π轨道上,形成3个Cr→CO的反馈π键。
Cr(CO)6中,形成了σ键,同时还形成了反馈π键,这两种作用是同时进行的。由于反馈π键的形成,分散了中心原子上过分集中的负电荷,增强了中心原子接受电子对的能力,负电荷被转移给CO配体,又提高了CO供给电子对的能力,使σ键得到加强。而σ键的增强,又使中心原子负电荷有所增加,配体负电荷减少,对反馈π键的形成产生促进作用。我们称这种相互促进的成键效应为协同作用。由于σ-π键协同作用的存在,大大加强了Cr与CO之间了键合力,使之稳定性增大。
CO空的π*轨道接受金属t2g轨道的电子,结果t2g轨道能量下降,致使t2g和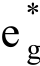 之间能量差Δo增大,电子光谱实验测得Cr(CO)6的Δo值~32000 cm-1,而[Cr(H2O)6]2+的Δo~1740 cm-1。Cr(CO)6的偶极矩为0.5D,说明Cr-C几乎没有极性。
之间能量差Δo增大,电子光谱实验测得Cr(CO)6的Δo值~32000 cm-1,而[Cr(H2O)6]2+的Δo~1740 cm-1。Cr(CO)6的偶极矩为0.5D,说明Cr-C几乎没有极性。
7.CO和金属原子键合时,首先是C原子一端的σ孤对电子(5σ轨道上一对电子)与金属原子空轨道重叠而成σ配键,金属原子的dxz轨道上的电子可以反馈到CO中的2pz反键轨道,形成另一个反馈π配键,反馈π配键的形成,使金属原子的d电子移向羰基,减少了由于生成σ配键而引起金属原子上的过多负电荷。这两种成键作用的相互配合、相互促进,称之谓“协同效应”。由于膦配体是强的σ电子供体和弱的π电子受体,羰基化合物部分CO被pph3取代,νCO降低;π反馈键愈弱,M–C键也就愈弱,因此Cr-CO键长变化的顺序为:
8.(略)
9.首先在了解导师课题组研究方向的基础上,与指导导师沟通,初步确定拟开展研究的方向等。其次通过数据库资源等查阅相关文献资料,在消化理解的基础上,明确研究背景、研究价值(理论或应用)及对本学科的贡献等,确立起点可见、过程可控、结果可及的题目,结合课题组已有条件确定研究所需的实验设计方案和所用的技术方法或路线,准备开题报告。再次,经过开题报告的讨论,初步完善研究计划的各项目标任务。在具体实验工作开展后,针对研究过程中遇到的具体问题,及时与导师沟通,找出解决问题的方法或及时实施研究内容的调整等。及时整理实验结果,做好中期报告准备。最后,经与导师讨论,确定学位论文的结构、内容等,认真撰写论文,完善实验数据。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




