1.(1)C;(2)B;(3)B;(4)C;(5)B;(6)A;(7)A;(8)D;(9)D;(10)B;(11)C;(12)C;(13)C;(14)A;(15)C;(16)A;(17)B;(18)B;(19)B;(20)C;(21)C;(22)B
2.(1)平面六边形,D3h;反式二氟丁烯,C2h;(2)C2h;(3)36˚;(4)D3h,D2h,C2v,C2(顺式)或D2h(反式);(5)D3h
(6)
(7)
(8)
(9)C2v, ,4;(10)D5h,D5d;(11)有无Sn轴;C1,Cn,Dn;C1和Cn;Oh;(12)Dn;Cnh,Cnv,Dnh,Dnd
,4;(10)D5h,D5d;(11)有无Sn轴;C1,Cn,Dn;C1和Cn;Oh;(12)Dn;Cnh,Cnv,Dnh,Dnd
(13)
8.当金属与配体配位形成配合物时,中心原子的电子构型(是否球对称、含d或f电子的多寡等)、阴阳离子间的半径比、配体的性质、体积、配位场强弱、空间位阻效应、溶剂化作用以及配体或抗衡离子间的相互作用等诸多因素,是影响配合物配位数高低及空间构型(对称性)的决定性因素。
配位数为8的配合物,中心原子是ⅣB、ⅤB、ⅥB族的重金属及镧系、锕系成员,配合物的几何构型有5种基本形式:四方反棱柱体(D4d)、三角十二面体(D2d)、立方体(Oh)、双帽三棱柱体(C2v)及六角双锥(D6h),其中四方反棱柱体和三角十二面体构型较为常见。如MoH4(PR3)4为十二面体构型,[TaF8]3-为反四方棱柱体,[ZrF8]4-、[Mo(CN)8]3-、[Mo(CN)8]4-等为十二面体构型(三帽三棱柱畸变,C2v),[Mo(CN)8]3-、Zr(acac)4、[Re(CN)8]3-、K4Mo(CN)8·2H2O晶体等也可形成四方反棱柱结构,主要取决于环境因素及配体空间位阻。[UO2(acetate)3]-和[VO2(C2O4)3]4-为六角双锥构型,[UF8]4-为双帽三棱柱构型,[PaF8]3-、[UF8]3-、[NpF8]3-等为立方体构型。此外,八配位配合物也能形成双帽三棱柱、双帽八面体、D4立方体、畸变四面体(例如金属有机化合物Cp2REL2)等构型。[XeF8]2-是四方反棱柱体而无孤对电子引起的结构畸变。
配位数为9的稀土配合物易形成三帽三方棱柱(D3h)和单帽四方反棱柱(C4v),如[ReH9]2-、[Nd(H2O)9]3+、[Pr(H2O)9]3+等为三帽三棱柱构型,[Pr(NCS)3(H2O)6]等采取单帽四方反棱柱构型。
配位数为10的配合物通常有双帽四方反棱柱体(D4d)、双帽十二面体(D2)、十四面体(C2v)(Al-Karaghouli A R,Wood J S,Inorg Chem,1972,11(10):2293~2299)等,在配位聚合物[La(H2O)2(pmta)3]·3H2O(pmta=嘧啶硫乙酸)中,La3+为10配位的双帽四方反棱柱体构型;[Th(C2O4)5]4-为双帽四方反棱柱体,D4d。
配位数为11的配合物极为罕见,几何构型可能为单帽五角棱柱体或单帽五角反棱柱体,常见于大环配位体和体积很小的双齿硝酸根组成的配合物中。如[Th(NO3)4(H2O)3]2·H2O。
配位数12的配合物最稳定的几何构型是二十面体(Ih),(NH4)3[Ce(NO3)6]·2H2O和[Mg(H2O)6]3[Ce(NO3)6]·6H2O中的[Ce(NO3)6]3-为二十面体(Ih),Mg[Th(NO3)4]·8H2O中的[Th(NO3)4]2-具有Ih对称性。
9.(1)D2h;(2)D2h;(3)D2d;(4)Td;(5)D3h;(6)C2v
10.(1)D∞h;(2)C∞v;(3)Cs;(4)C2v;(5)Cs;(6)C2v;(7)C3v;(8)D∞h;(9)C2v;(10)D3h;(11)Td;(12)Cs;(13)C2v;(14)C4v;(15)C2v;(16)C3v(可能为Cs,甚至C1);(17)C2v;(18)C3v;(19)C3v;(20)C3v;(21)C2v;(22)Td;(23)D3;(24)D4h;(25)C4v;(26)C3v;(27)Cs;(28)C2v;(29)C3v;(30)C4v;(31)C2v;(32)C4v(由于孤对电子的排斥,使Te位于F4平面的下方);(33)C4v;(34)C4v;(35)C2v;(36)C2v;(37)C2v;(38)C2v;(39)D2d;(40)C4h;(41)C3;(42)C4;(43)C2;(44)D∞h;(45)C∞v;(46)C4v;(47)C4v;(48)D3h;(49)C2v;(50)D∞h
11.去掉1和2,余下球所构成图形的点群是C2v;去掉1和3,余下球所构成图形的点群是C2v;去掉1和7,余下球所构成图形的点群是D3d。
12.(1)乙烷分子可有3种典型的构象,其中完全重叠构型所属点群为D3h;全交叉构型所属点群为D3d;任意角度构型所属点群为D3。因此乙烷分子从重叠构象转到交叉构象的过程中,经历的点群变化是:D3h→D3→D3d。(2)交叉构象。
13.联苯(C6H5C6H5)分子可有三个不同的构象,其中苯环间的二面角δ分别为0˚,90˚和0˚<δ<90˚,所属点群分别为:δ=0˚,D2h;δ=90˚,D2d;0˚<δ<90˚,D2。
对m,m-二氯联苯所属点群,当苯环间的二面角δ为0˚时,C2v;δ=90˚,C2v;0˚<δ<90˚,C2。
14.等边三角形有C2轴,且共有3根C2轴,共有3个C2操作。
15.将通过C=C=C连线的C2轴规定为主轴较为合理,这样的C2轴含有的原子数目最多,对称性较高,且有2个过主轴的镜面,有利于采用群论手段对分子有关性能进行处理、讨论。
16.顺式为C2v对称性,反式为C2h对称性,扭式为C2对称性。
17.MA2B2C2类型的“八面体”配合物的几何异构体共有5种,其结构示意图如下,其中C1为不对称结构。
中心原子M是d2sp3杂化的MA4B2分子有2种异构体,一种为反式结构,属于D4h点群;另一种为顺式结构,属于C2v点群。
18.正四方棱柱形状![]() 离子所具有的对称操作有:Re-Re连线的C4和C2轴,通过棱柱相对的垂直边中心的C2'及通过棱柱相对的垂直面中心的C2"轴;三种类型的对称面σh,σv和σd;S4轴和i。
离子所具有的对称操作有:Re-Re连线的C4和C2轴,通过棱柱相对的垂直边中心的C2'及通过棱柱相对的垂直面中心的C2"轴;三种类型的对称面σh,σv和σd;S4轴和i。
19.I2Cl6分子内有两个桥Cl原子,每个I原子上有6对电子按八面体方式排布,孤对电子处于不相邻的反位位置上,围绕I的Cl原子为平面四方结构,因此,分子属于D2h点群。
20.溴二氯苯有6种异构体,结构示意图及所属点群见下。
21.5个顶点,6个面,9条棱,具有D3h点群对称性,全部对称元素有:E+C3+3⊥C2+σh+3σv+S3。
22.(1)C3v,(2)C2v,(3)Cs,(4)C2v,(5)C2v
23.PCl5分子为三角双锥结构,D3h点群;![]() 离子为四面体形状,具有Td点群对称性,
离子为四面体形状,具有Td点群对称性,![]() 离子为八面体形状,具有Oh点群对称性。
离子为八面体形状,具有Oh点群对称性。
24.环己烷-1,4-二酮分子的5种不同构象及所属点群见下图。
25.(1)角形,C2v;全部对称元素有:E+C2+σ+σ′,极性分子,无光学活性。
(2)三角锥形,C3v;全部对称元素有:E+C3+3σv,极性分子,无光学活性。
(3)平面构型,C2h;全部对称元素有:E+C2+i+σh,非极性分子,无光学活性。
(4)四面体,Td;全部对称元素有:E+4C3+3C2+3S4+6σd,非极性分子,无光学活性。
(5)八面体,Oh;全部对称元素有:E+3C4+3C2+4C3+6C2'+3σh+6σd+i+3S4+4S6,非极性分子,无光学活性。
26.对于八面体配合物MClpBrq(en)r,p、q和r取值不同,配合物的空间构象就有可能产生差异,从而具有不同的点群对称性。在假定螯合环为平面型的条件下,下图给出了具有C4v,C2v,D4h,C3v,D3,C1,C2,D2h点群的一种示意图,每种点群对称性的组成还有多种形式,这里不一一列举。
27.对苯醌分子为D2h点群,氯气为D∞h点群,顺二氯苯醌为C2v点群,四氯苯醌为D2h点群。
28.中心原子不带孤对电子时,五配位主族元素的化合物采用三角双锥结构,如PX5,X=卤素,甲基等。反之,若中心原子有一孤对电子,化合物将采用正方锥型结构,如BrF5和XeOF4。三角双锥结构只比SP结构稍稳定一些。对于过渡金属化合物,配位场影响和(或)π键合的存在有利于四方锥结构的形成。对于三角双锥和四方锥结构,考察晶体稳定化表明,除d10、d5、d0以外,对其他所有电子组态,四方锥结构更有利。然而其他效应,如晶体中的堆积作用,则可能有利于其中的任何一种结构。例如两种结构形式(三角双锥和四方锥)的[Ni(CN)5]3-都已在化合物[Cr(en)3][Ni(CN)5]·1.5H2O(en代表H2NCH2CH2NH2)中找到。
(1)当中心原子是主族元素时,在TBP结构中,轴向的键比赤道面的键长,而在SP结构中,情况则相反,可采用sp3d杂化或VSEPR理论解释。例如在PCl5(TBP结构),轴向和赤道面P-Cl键长分别为212.4 pm和202.0 pm;而在BrF5(SP结构),轴向和赤道面Br-F键长分别为169 pm和177 pm。
(2)当中心原子是过渡金属时,例如在[CuCl5]3-(TBP结构)中,最高d轨道d2z仅半充满,轴向和赤道面的Cu-Cl键长分别为229.6 pm和239.1 pm,即轴向键比赤道面的键稍短。当中心金属原子为过渡金属时,对[Ni(CN)5]3-(SP结构)最高d轨道![]() 空着,因此允许底部的配位体更接近中心金属原子,使[Ni(CN)5]3-中轴向和赤道面的Ni-C键长分别为217 pm和187 pm。
空着,因此允许底部的配位体更接近中心金属原子,使[Ni(CN)5]3-中轴向和赤道面的Ni-C键长分别为217 pm和187 pm。
29.在BrF5分子中,底部平面下方的孤对电子推斥平面中的配位体向上;反之,在[Ni(CN)5]3-中没有这种效应。此外,配位体之间的斥力将迫使底部配位体向下。
(9)RuCl2(PPh3)3,Cs,对称元素有:E+σ,对称操作有:E+σ;群阶为2。
(10)NiBr3(PPh2Me)2(赤道为3个Br-),D3h,对称元素有:E+C3+3⊥C2+σh+3σv+S3,对称操作有:E+2C3+3C2+σh+3σv+2S3;群阶为12。
37.Li4(CH3)4的几何构型为四面体,所属的点群为Td群,全部对称元素有E+8C3+3C2+6S4+6σd,偶极矩为零,无旋光性。
38.(1)D2d点群,无旋光性;(2)C2点群,有旋光性;(3)D3d点群,无旋光性;(4)C3v点群,无旋光性;(5)Cs点群,无旋光性
39.(1)E+C∞+C2+σv+σh,D∞h点群,非极性分子;
(2)E+C2,C2点群,极性分子;
(3)E+C2,C2点群,极性分子;
(4)E+C3+3σv,C3v点群,极性分子;
(5)E+C3+3σv,C3v点群,极性分子;
(6)E+C5+5⊥C2+5σd,D5d点群,非极性分子。(https://www.xing528.com)
40.对于取代丙二烯分子所属点群及偶极矩有无的情况为:(1)D2d,无偶极矩;(2)C2,有偶极矩;(3)C2v,有偶极矩;(4)C1,有偶极矩
41.如果n为奇数,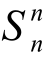 将产生一个垂直于Sn轴的附加对称操作σ,因此点群Sn将变为Cnh点群,所以n必须是偶数。另外,S2=i,因此点群S2与Ci点群等同。这样,S1=Cs;S2=Ci;S3=C3h。所以,n必须是大于或等于4的偶数。
将产生一个垂直于Sn轴的附加对称操作σ,因此点群Sn将变为Cnh点群,所以n必须是偶数。另外,S2=i,因此点群S2与Ci点群等同。这样,S1=Cs;S2=Ci;S3=C3h。所以,n必须是大于或等于4的偶数。
42.(1)Td;(2)交错式构象为D3d,重叠式构象为D3h,非重叠交错构象为D3;(3)D3h;(4)D4h;(5)D6h
43.(1)S8:D4d;S7O:Cs(2)(a)S2,D∞h;(b)S3,链式角形(C2v),正三角形(D3h);(c)S4,理论上有如下11种情况(Quelch G E,Schaefer Ⅲ H F,Marsden C J,J Am Chem Soc,1990,112(24):8719~8733):
(d)S5,链状连接,对称点群分为Cs和C2
(e)S6,主要为环状椅式(D3d)和环状船式(C2v)
(f)S7,环状船型和椅型结构,对称点群均为Cs
(g)S8,冠状结构,D4d点群
44.
45.
46.(1)C1,abdf或abce;(2)C2,abcd或abdg;(3)Cs,abde或abcf;(4)C4v,aceg;(5)D2d,abef
47.(1)C1,a;(2)C2,ab;(3)Cs,ah;(4)C2v,abef;(5)S4,aceg;(6)D2,adeh
48.(1)C1,af;(2)C2,bm;(3)C3,bdf;(4)Cs,b;(5)C2v,de;(6)C3v,a;(7)D2d,gfij
49.(1)D2d(仅置换桥连氧原子ej);(2)D2d(置换桥连和末端氧原子abcdej);(3)C3v(仅置换末端氧原子a);(4)C3v(仅置换桥连氧原子efg);(5)C3v(置换桥连和末端氧原子ahij);(6)C2v(仅置换末端氧原子ab);(7)C2v(仅置换桥连氧原子e);(8)C2v(置换桥连和末端氧原子abj);(9)Cs(仅置换桥连氧原子ef);(10)Cs(置换末端和桥连氧原子aef);(11)C2(仅置换桥连氧原子efi);(12)C2(置换末端和桥连氧原子abfi);(13)C1(置换一个末端氧原子和任何数目的桥连氧原子aeh);(14)C1(置换两个末端氧原子和任何数目的桥连氧原子abfj)
50.因为Br-半径较大,在中心离子半径相对较小情况下,高配位数的配位体互相接触,而配位体间又存在有排斥力,因此即便配离子有孤电子对,也可能被挤压入价电子层里面,占据球形s轨道,这样配离子的结构就是对称性高的八面体。以![]() 为例,Br-Br之间的距离为381 pm,比范德华距离390 pm稍小,说明所有的Br原子互相接触,没有给孤电子对留下空隙。被挤压进入价电子层的孤电子对部分减低了Te的电负性,导致Te-Br键变长。在
为例,Br-Br之间的距离为381 pm,比范德华距离390 pm稍小,说明所有的Br原子互相接触,没有给孤电子对留下空隙。被挤压进入价电子层的孤电子对部分减低了Te的电负性,导致Te-Br键变长。在![]() 中,观测到的键长为275 pm,比共价半径和(251 pm)稍长,说明确实存在该种作用。
中,观测到的键长为275 pm,比共价半径和(251 pm)稍长,说明确实存在该种作用。![]() 中,孤对电子成为“立体化学惰性的”,类似的例子还有
中,孤对电子成为“立体化学惰性的”,类似的例子还有![]() ,
,![]() 等。
等。![]() 都是正八面体而非畸变八面体等。
都是正八面体而非畸变八面体等。
在固体中,某些AX6E离子具有八面体对称性(其中A是低价的p区元素,如Sn2+,Pb2+,As3+,Sb3+,Bi3+,Se4+,Te4+,Po4+等),因此ns2非键电子对是立体化学惰性的。这些固体有颜色,并常具有金属或半导体性质。K J Wynne认为,当存在软的给予体原子(Cl,Br等)时,AX6E分子或离子中非键电子对为立体化学惰性的。当存在最硬的给予体原子(O,F)时,AX6E分子或离子中非键电子对具有立体化学活性。
[Sb(C2O4)3]3-中,孤对电子占有五角双锥(稍畸变)的一个顶点,草酸根配位氧占据其余6个顶点,孤对电子具有“立体化学活性”。XeF6气态分子的形状不是理想的八面体的对称性(Oh),因为气态XeF6在75℃时有3种电子异构体:基态为Oh点群(30%);第一激发态在450 cm-1,为D3d点群(55%);第二激发态在1230 cm-1,也是D3d点群(15%)。XeF6固态时以![]() 的形式存在,每个
的形式存在,每个![]() 单位都是八面体,且三聚或四聚成“环”。
单位都是八面体,且三聚或四聚成“环”。
51.二茂铁(Cp2Fe)的构型可以是D5d对称的交叉构型;也可以是D5h对称的重叠构型;处于重叠构型与交叉构型之间、具有D5对称性的扭转构型。示意图见下。
52.(1)正四面体的对称性为Td,簇合物核心为嵌套结构,具有垂直C2轴,因此属于D2点群。
(2)Ih点群,[Ni12(μ12-As)]3-二十面体包封于As20的十二面体内。
53.
54.7配位的离子可能具有以下5种构型之一:五角双锥(D5h),单帽三棱柱(C2v),单帽八面体(C3v),正七边形(D7h),六棱锥(C6v)。
价层具有7个电子对的分子AX7,电子对之间的排斥类似于稀有气体原子间的范德华力,则排斥力是1/rn的函数;若考虑静电作用,排斥力与1/r2有关。如果n=2,7对电子对形成1:5:1的排列,AX7分子应为五角双锥形(D5h点群),如![]() 等;
等;![]() 五角双锥(D5h);如果作用力为1/rn的函数(n),7对电子形成1:3:3的排列,AX7分子为不规则八面体(第7个配体对着八面体的一个三角面的中心),具有C3v点群。如La、Ce、Pr、Nd的A型氧化物M2O3;如果作用力为1/rm的函数(n>m>2),7对电子形成1:4:2的排列,AX7分子为一帽三棱柱(第7个配体对着三棱柱一个矩形侧面的面心),分子具有C3v对称性,如
五角双锥(D5h);如果作用力为1/rn的函数(n),7对电子形成1:3:3的排列,AX7分子为不规则八面体(第7个配体对着八面体的一个三角面的中心),具有C3v点群。如La、Ce、Pr、Nd的A型氧化物M2O3;如果作用力为1/rm的函数(n>m>2),7对电子形成1:4:2的排列,AX7分子为一帽三棱柱(第7个配体对着三棱柱一个矩形侧面的面心),分子具有C3v对称性,如![]() 等。多于6个价电子对分子的形状,VSEPR模型不能给出明确的结果,因为电子对之间的斥力是1/rn的函数。
等。多于6个价电子对分子的形状,VSEPR模型不能给出明确的结果,因为电子对之间的斥力是1/rn的函数。
![]() 形成单帽三棱柱构型结构,
形成单帽三棱柱构型结构,![]() 多为D5h对称性,但固态化合物中,
多为D5h对称性,但固态化合物中,![]() 采取单帽三棱柱结构。
采取单帽三棱柱结构。
55.分子所采取的构型应是价态激发能最小而总体本征结合能最大的那种结构。若单纯考虑价态激发能要小,则AX2分子应采取直线形,即sp杂化较为有利,但这时本征结合能并不是最大;若考虑总本征结合能足够大,则分子采取弯曲形有利(θ=120˚或109.5˚),但这时价态激发能又增大,当θ=90˚,即用纯的p轨道成键时,价态激发能最高,本征结合能最小,显然这种构型是最不稳定的。AX2分子所采取的构型必须根据价态激发能和本征结合能的相对大小而定。碱土金属原子的价态激发能值对于Be约为300 kJ·mol-1,Ba约为170 kJ·mol-1,而总的热化学键能对于碱土金属氟化物约为1200 kJ·mol-1,碱土金属碘化物约为700 kJ·mol-1,因此碱土金属碘化物一般是直线形(虽然键能小,但采取直线形价态激发能也小),Be的卤化物也是直线形的(Be的价态激发能值大),而所有Ba的二卤化物都是弯曲形的(Ba的价态激发能值小),SrF2,SrCl2,CaF2,MgF2也都是弯曲形的。Zn,Cd,Hg原子也形成sp杂化,它们的价态激发能比碱土金属约高400~500 kJ·mol-1,这些原子形成直线形二卤化物分子。
VSEPR规则不能解释部分碱土金属二卤化物为什么会出现不同程度的弯曲,实际上,VSEPR规则也不能解释Li2O为什么是线形而不是V字形。
基于MO理论的Walsh图可以根据d轨道的收缩对此加以解释。
参比(直线)构型ML2体系,典型的MO LCAO价电子能级图见下,占据能级的形成主要是由配体L(p)轨道,金属原子M的s,p和d组合为非占据轨道。若占据σu轨道与激发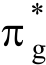 轨道混合发生赝Jahn-Teller效应,则产生弯曲。
轨道混合发生赝Jahn-Teller效应,则产生弯曲。
重金属原子和电负性强的配位体倾向形成弯曲分子,例如BaX2的基态电子组态为[Core]6s2,当一个6s电子被激发时,产生的最低激发组态为[Core]6s15d1,Ba原子采用![]() 杂化形成键角约为90˚的弯曲型BaX2分子。虽然HgX2的基态电子组态也为[Core]6s2,但形成的最低激发组态为[Core]6s16p1,因此Hg原子采用sp杂化形成直线型的HgX2分子。d轨道在杂化中的有效参与,会导致弯曲型分子的形成。配位体电负性强,可使中心原子上带部分正电荷,引起d轨道的收缩,使之在金属-配体重叠中更加有效,这样电负性强的配位体也有利于非直线型分子的形成。
杂化形成键角约为90˚的弯曲型BaX2分子。虽然HgX2的基态电子组态也为[Core]6s2,但形成的最低激发组态为[Core]6s16p1,因此Hg原子采用sp杂化形成直线型的HgX2分子。d轨道在杂化中的有效参与,会导致弯曲型分子的形成。配位体电负性强,可使中心原子上带部分正电荷,引起d轨道的收缩,使之在金属-配体重叠中更加有效,这样电负性强的配位体也有利于非直线型分子的形成。
56.不一定一致。因为分子在晶体中所占据位置的点对称性一般比较低,造成两者的不一致。晶体不只可以低于自由粒子的对称性,也可以高于自由粒子的对称性,且对称中心可以是粒子组合的总体效果。比如无对称中心的![]() 形成的K2CrO4晶体具有D2h对称性。
形成的K2CrO4晶体具有D2h对称性。
57.(1)C2v点群,有偶极矩;(2)C2v点群,有偶极矩;(3)C2v点群,有偶极矩;(4)Cs点群,有偶极矩;(5)D3h点群,无偶极矩。
58.属于C1、Cs、Cn、Cnv点群的分子,可以有永久偶极矩。属于C1、Cn、Dn点群的分子,可具有旋光性;属于Sn、Cnh、Cnv、Dnh、Dnd、Td、Oh点群的分子,无旋光性。
59.二碳硼烷阴离子![]() 具有邻位、间位和对位三种异构体,其中邻位和间位二碳十二碳硼烷阴离子(2-)均具有C2v对称性,对位异构体属于D5d点群。
具有邻位、间位和对位三种异构体,其中邻位和间位二碳十二碳硼烷阴离子(2-)均具有C2v对称性,对位异构体属于D5d点群。
60.HBC具有D6h对称性,可以被看作组建石墨烯的单元,其尺度大概为1 nm。
61.XeF4分子中,Xe的价电子对数为:(8+4)/2=6,杂化方式为sp3d2,由于配体只有4个,有2对孤对电子,因此,XeF4分子的几何构型为平面正方形而不是正四面体。
62.根据VSEPR理论知,XeF2为直线形结构,sp3d杂化,属于D∞h点群;XeF4为平面正方形结构,sp3d2杂化,属于D4h点群;XeF6为变形八面体结构,sp3d3杂化,属于C3v点群;XeF8为正方反棱柱形结构,sp3d4杂化,属于D4d点群。
63.立方体变为a=b≠c的长方体,Td对称性变为C2v群;长方体的边a≠b≠c,则4个顶点组成的四面体属于Cs点群。
64.取代产物C8H6Cl2有邻、间、对3种可能构型,对应的点群分别为C2v、C3v和D3d。C2v和C3v取代物有偶极矩,无旋光性;D3d取代产物无偶极矩,亦无旋光性。取代产物C8H5Cl3也有3种可能构型,对应的点群分别为C3v、Cs和Cs。3种构型均具有偶极矩,均无旋光性。
65.非过渡元素AB4型分子若具有8个价电子,则分子构型为正四面体结构(Td);若价电子数为10,则分子为在赤道面有一孤对电子占据的三角双锥结构(C2v);若价电子为12,则AB4络合物为平面正方形结构(D4h);价电子数为9的![]() ,PCl4等具有似10电子的C2v对称性;价电子数为11的ClF4具有D4h对称性。3种点群对应MO能级相关图见下图(Gimarc B M,Khan S A.J Am Chem Soc,1978,100(8):2340~2345)。
,PCl4等具有似10电子的C2v对称性;价电子数为11的ClF4具有D4h对称性。3种点群对应MO能级相关图见下图(Gimarc B M,Khan S A.J Am Chem Soc,1978,100(8):2340~2345)。
非过渡元素形成的AB6型化合物一般具有Oh或D3h对称性,12价电子的AB6型分子或离子构型为八面体(Oh),HOMO为双重简并的非键eg,包括所有第3族至第7族AB6型卤化物。
ClF6,BrF6,![]() 等为13电子体系,
等为13电子体系,![]() 被认为是包含有
被认为是包含有![]() 和
和![]() 的混合价化合物。14电子AB6分子或离子构型多为八面体形状,如XeF6,
的混合价化合物。14电子AB6分子或离子构型多为八面体形状,如XeF6,![]() ,
,![]() 等。由于这类分子或离子HOMO为反键2a1g,其能级较D3h的2a'1高,因此部分分子或离子可能发生构型畸变或流变。14电子系列碘及溴的络合物较12电子系列的常见,且
等。由于这类分子或离子HOMO为反键2a1g,其能级较D3h的2a'1高,因此部分分子或离子可能发生构型畸变或流变。14电子系列碘及溴的络合物较12电子系列的常见,且![]() 稳定性变化顺序为:
稳定性变化顺序为:![]() 中存在类似的变化规律,这是因为,对于一个给定的中心原子,较大配体能够提高配体-配体间AO的重叠,这有利于MO稳定化能。
中存在类似的变化规律,这是因为,对于一个给定的中心原子,较大配体能够提高配体-配体间AO的重叠,这有利于MO稳定化能。
XeO6为三棱柱形状,![]() 则为八面体(Oh)。具有较低中心原子氧化态的AB6分子或离子,具有较长的A-B键长,例如,
则为八面体(Oh)。具有较低中心原子氧化态的AB6分子或离子,具有较长的A-B键长,例如,![]() 中,P-Cl键长为250 pm(ν1=281 cm-1);
中,P-Cl键长为250 pm(ν1=281 cm-1);![]() 中,P-Cl键长为293 pm(ν1=202 cm-1)。8电子BeF6为三棱柱(D3h)形状。
中,P-Cl键长为293 pm(ν1=202 cm-1)。8电子BeF6为三棱柱(D3h)形状。
66.XeOF2,C2v;XeO2F2,C2v;XeO3F2,D3h;XeOF4,C4v;XeO2F4,D4h;XeOF6,C3
67.(1)
(2)
(3)
68.二茂钌为重叠夹心型化合物,具有D5h对称性,因此是非极性分子。
69.配离子属于D3群,不含非真旋轴,因此该配离子具有手性。若该构象足够稳定,就可能具有旋光性。
70.6Co[acacCN]2 + 6tpt → TM(2D六角形网)
配体Co[acacCN]2具有D2h对称性,配体tpt具有D3h对称性。
71.化合物(a)所属点群为C6;化合物(b)所属点群为C3。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




