6.8.1 结构图
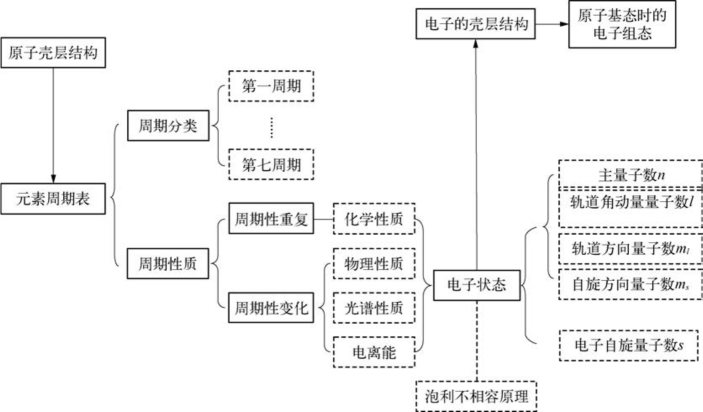
6.8.2 元素周期表
1.周期分类
(1)原子序数:到2015年,国际纯粹和应用化学联合会(IVPAC)确认了118种元素,其中原子序数1~92的元素存在于自然界,93~118的元素是人工制造的。
(2)原子序数等于原子中的电子数。
(3)原子序数也等于原子核的电荷数。
(4)1电子电荷e=1.602192×10-19C。
(5)全部118种元素分为7个周期。
第一周期:2种;
第二周期:8种;
第三周期:8种;
第四周期:18种;
第五周期:18种;
第六周期:32种,其中包括过渡元素和15种稀土元素;
第七周期:32种,其中包括15种锕系元素。
2.周期性质
(1)周期性重复:元素的化学性质。
(2)周期性变化:元素的物理性质、光谱性质、电离能等。
6.8.3 电子状态
1.元素的性质取决于原子的结构,即取决于原子中电子所处的状态。
2.电子所处的状态由四个量子数表示。
(1)主量子数n
n=1,2,3,…代表电子运动区域的大小(电子运动的轨道大小)和它的总能量的主要部分。
(2)轨道角动量量子数l
l=0,1,2,…,(n-1),代表轨道的形状和轨道角动量,也与电子的能量有关。
(3)轨道方向量子数ml
ml=l,l-1,…,0,…,-l,代表轨道在空间的可能取向,也代表轨道角动量在某一特殊方向的分量。
(4)自旋方向量子数ms![]() 代表电子自旋的取向,也代表电子自旋角动量在某一特殊方向的分量。
代表电子自旋的取向,也代表电子自旋角动量在某一特殊方向的分量。
另外:电子自旋量子数s=1/2,代表自旋角动量,对所有电子都是相同的,不作为区别电子状态的一个参数。
3.根据泡利不相容原理,在原子中,不存在两个电子具有相同的四个量子数。
4.电子的壳层结构
(1)在原子中,具有相同的主量子数n的电子构成一个壳层。如果电子比较多,就分成几个壳层。
(2)在同一个壳层中,对不同的轨道角动量量子数l,又分为几个不同的次壳层。
(3)对一个l,可以有(2l+1)个ml。
(4)对每一个ml,又可以有两个ms,即![]() (https://www.xing528.com)
(https://www.xing528.com)
因此,对每一个次壳层l,可以有2(2l+1)个不同的状态。每一个次壳层l可以容纳的最多电子数为:
Nl=2(2l+1)
(5)对每一个n,可以有n个l。每一个n层可以容纳的最多电子数为:
![]()
(6)各壳层可以容纳的最多电子数如表6-1所示。
表6-1 各壳层可容纳的最多电子数
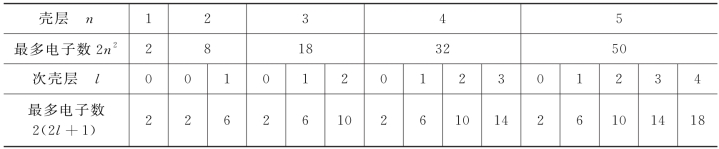
(7)存在问题:各壳层的最多电子数是2、8、18、32、50……各周期的元素数是2、8、8、18、18、32……两者既有相似之处,又有差别。
5.原子基态的电子组态
(1)原子中的电子数等于原子序数。每一种原子,就核外部分来说,是由周期表中前一位元素的原子加上一个电子而成。
(2)原子的基态是原子能量最低的状态,它所有的电子都处于各自可能的最低能量状态中。按周期表顺序逐个增加的电子,也尽可能填补在最低能量状态。
(3)原子基态时的电子组态如表6-2所示。
表6-2 原子基态时的电子组态
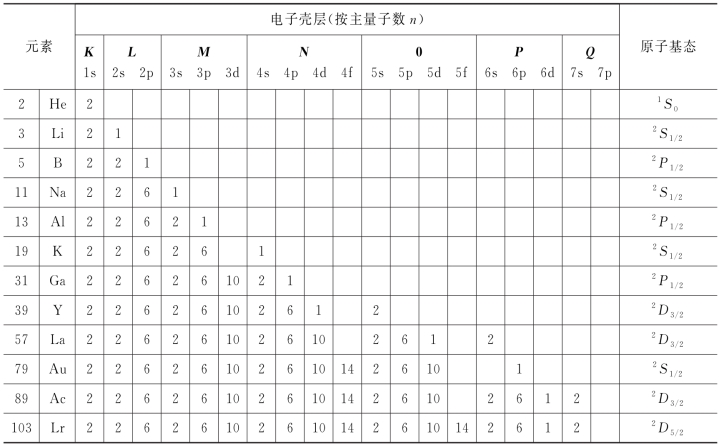
说明:①壳层n=1、2、3、4、5、6和7分别用K、L、M、N、O、P和Q表示。
②次壳层l分别用s、p、d、f表示。
③第一壳层:K,原子序数为1~2,次壳层为1s;
第二壳层:L,原子序数为3~10,次壳层为2s、2p;
第三壳层:M,原子序数为11~18,次壳层为3s、3p、4d;
第四壳层:N,原子序数为19~36,次壳层为4s、4p、4d、4f;
第五壳层:O,原子序数为37~54,次壳层为5s、5p、5d、5f;
第六壳层:P,原子序数为55~86,次壳层为6s、6p、6d;
第七壳层:Q,原子序数为87~103,次壳层为7s、7p。
④原子基态时的电子组态以碱金属为例。
碱金属电子态的符号
轨道角动量量子数l=0,1,2,3,…电子态分别用小写字母s、p、d、f等表示,在这些字母的前面再加上主量子数,就成为电子态的符号,例如:
n=1,l=0,电子态符号为:1s;
n=2,l=0,电子态符号为:2s;
n=2,l=1,电子态符号为:2p;
n=3,l=0,电子态符号为:3s;
n=3,l=1,电子态符号为:3p;
n=3,l=2,电子态符号为:3d。
碱金属原子态的符号
用大写字母S、P、D、F等表示原子态,在左上角写一个2代表双重结构,在右下角标明j量子数,例如:

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




