6.6.1 结构图
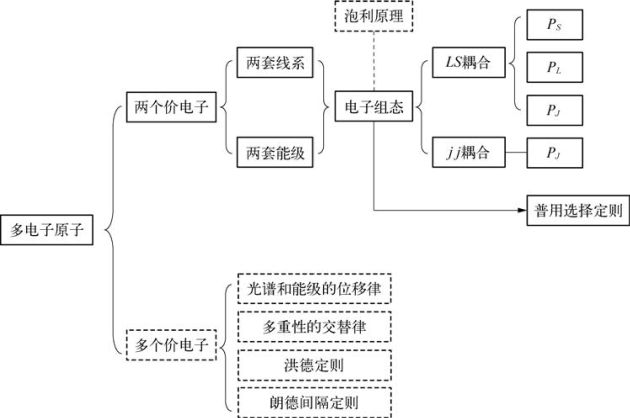
6.6.2 具有两个价电子的原子
前面讨论单电子原子(氢原子)的光谱和具有一个价电子的原子(碱金属原子)的光谱,推得原子的能级和如何出现双层结构。现在讨论氦和元素周期表第二族的铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)、镭(Ra)等,它们的原子序数分别为:4、12、20、38、56和88,这也表示它们原子内部的电子数,它们的最外层都有两个价电子,具有相仿的结构。
1.氦的光谱和能级
(1)两套光谱线系:如有两个主线系、两个第一辅线系等。
(2)两套能级:一套谱线都是单层的,另一套谱线都是三层的,两套能级之间没有相互跃迁,各自的内部跃迁产生两套光谱。
2.具有两个价电子的原子态
(1)两个价电子可以处于各种状态,这些状态总称电子组态,不同的电子组态具有不同的能级。
(2)除基态外,所有能级都是一个电子留在最低态,一个电子被激发。例如氦,一个电子留在1s,另一个电子被激发到2s、2p、3s、3p、3d等。
(3)在每一种电子组态中,两个电子各有轨道和自旋,形成四种运动,产生六种相互作用,形成不同的原子态。
①四种运动的量子数记作:l1、l2、s1和s2。
②六种相互作用记作:G1(s1、s2)、G2(l1、l2)、G3(l1、s1)、G4(l2、s2)、G5(l1、s2)、G6(l2、s1)。
③六种中极端的两种
ⓐLS耦合:G1和G2比G3和G4强。即两个电子之间的自旋作用很强,两个电子之间的轨道运动作用也很强,如图6-20所示。
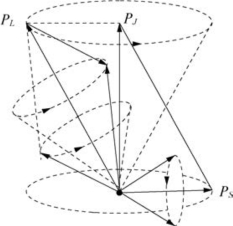
图6-20 LS耦合
合成的电子自旋总角动量:
![]()
式中,S只能是1或0。
合成的电子轨道总角动量:
![]()
式中,L=l1+l2,l1+l2-1,…,|l1-l2|。
合成的原子总角动量:
![]()
式中,J=L+S,L+S-1,…,|L-S|。
对于有两个价电子的原子,当S=0时,PS=0,J=L,只有一个能级;当S=1时,![]() J=L+1,L,L-1,共有三个J值,即有三个能级。
J=L+1,L,L-1,共有三个J值,即有三个能级。
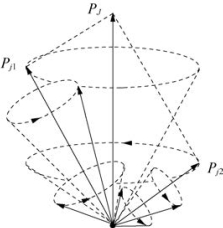
图6-21 jj耦合(https://www.xing528.com)
洪德定则(略)
朗德间隔定则(略)
ⓑjj耦合:G3和G4比G1和G2强。即两个电子的自旋对自身轨道运动的相互作用比两个电子间的自旋或轨道运动相互作用强,如图6-21所示。
每一个电子的自旋角动量:
![]()
式中,s=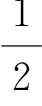 。
。
每一个电子的轨道角动量:
![]()
合成的一个电子的总角动量:
![]()
式中,j=l+s或j=l-s;s=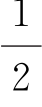 。
。
两个电子合成的原子总角动量:
![]()
式中,J=j1+j2,j1+j2-1,…,|j1-j2|。
对同一个电子组态,两种耦合形成的原子态的数目是相同的,而且代表原子态的J值也相同。两种耦合所不同的是它们能级的间隔,反映的是几种相互作用的强弱不同。
(4)泡利原理:不能有两个电子处在同一状态。
①标准电子态的量子数有五个:n,l,s,ml,ms,即五个量子数不能完全相同。ml为轨道量子数,ms为自旋量子数。
②其中,s=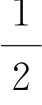 代表电子自旋角动量,对所有电子是相同的,所以不作为区别电子状态的参数,因此由剩下的四个量子数表示电子态。
代表电子自旋角动量,对所有电子是相同的,所以不作为区别电子状态的参数,因此由剩下的四个量子数表示电子态。
③同科电子指n和l这两个量子数相同的电子。
3.普用选择定则
(1)首先考虑电子空间分布的状态分为偶性和奇性,这种性质称为“宇称”。
(2)跃迁只能发生在不同宇称的状态之间:从偶性到奇性,或从奇性到偶性。其表达如下:
偶性态(∑li为偶数)↔奇性态(∑li为奇数)
(3)然后考虑LS耦合:
ΔS=0;ΔL=0,±1;ΔJ=0,±1(0→0除外)。
(4)jj耦合:
ΔJp=0或0,±1;Δj=0,±1或0;ΔJ=0,±1(0→0除外)
6.6.3 具有多个价电子的原子(略)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




