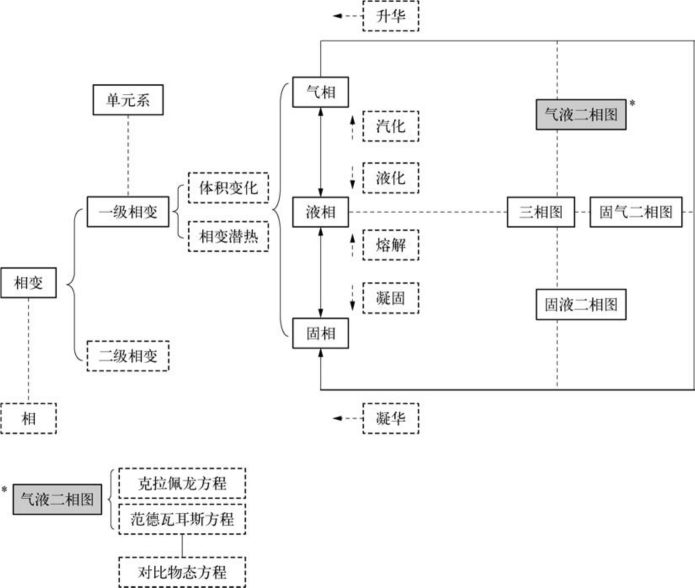
3.10.1 结构图
3.10.2 总述
1.三态:自然界中的许多物质都是以固态、液态和气态这三种聚集态存在。在一定条件下,它们可以同时平衡共存,也可以相互转变。
2.相:指系统中物理性质均匀的部分,它与其他部分之间有一定的分界面隔离。例如:水和冰组成的系统,水是一个相,冰也是一个相。
(1)水和冰虽然是两个相,但都是化学成分相同的物质,这称单元复相系,即:一种物质有两个相或两个以上的相。
(2)单元系:指单一物质,如纯金属。
多元系:指多种物质,如合金。
3.相变:不同的相之间的相互转变。
相变的原因:在一定压强下,由于温度升高或降低而发生的变化。
4.相变分类
(1)一级相变
对于单元系物质:①相变时体积发生变化。在液相转变为气相时,气相的体积总是大于液相的体积。
②相变时要吸收或放出大量热量(称相变潜热)。
l=(u2-u1)+p(v2-v1)
式中,l为相变潜热;(u2-u1)为两相的内能差,称为内潜热;p为外部压强;(v2-v1)为两相的体积差,p(v2-v1)称为外潜热。
h1=u1+pv1和h2=u2+pv2称为两相的单位质量的焓。
(2)二级相变
物质体积不变,也没有相变潜热,只有热容量、热膨胀系数和等温压缩系数这三者发生变化。
本章节只讨论单元系一级相变。
3.10.3 气液相变
1.汽化:物质由液相转变为气相
(1)汽化热:1kg液体汽化时所吸收的热量。温度升高,汽化热减小。
(2)汽化的两种形式
①蒸发:发生在液体表面,任何温度下都能进行。
对于同种液体,影响蒸发的因素很多。
在敞开容器中,需要从外界补充能量,使大量分子能够脱离液面。
在密闭容器中,会形成与液体保持动态平衡的饱和蒸气,此时的压强称饱和蒸气压。
②沸腾:发生在液体内部,只在沸点下才能进行。
沸点就是饱和蒸气压p0等于外界压强p时的温度。
当p0=p时,附加压强:
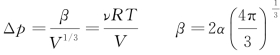
式中,V为体积;ν为气体的物质的量;R为气体普适常数;T为温度;α为液体表面张力系数。
2.液化:物质由气相转变为液相
液化方法之一:等温压缩法。将气体的温度降低到临界温度以下,然后采用压缩的方法,如图3-13所示。

图3-13 等温压缩
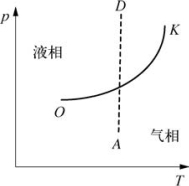
图3-14 气液二相图
图3-13中,ABCD称等温曲线,反映了在压缩过程中压强和体积之间的关系。AB段是气体液化之前的等温压缩过程,CD段是液体的等温压缩过程,BC段是液化过程。当温度升高时,B和C两点重合于K点,即气体全部转变为液体,K的温度为TK,称临界温度。此时的压强称为临界压强,此时的体积称为临界体积。
3.气液二相图
图3-14中,T为温度,p为压强,OK为汽化曲线,是液态和气态的分界线,OK的左上方表示液相存在区域,OK的右下方表示气相存在区域,OK上的各点就是两相平衡共存的区域。K为临界点,K点以上不存在气液共存区域;O为始点,O点以下气相只能与固相平衡共存。虚线DA表示等温压缩过程(参见图3-13中的曲线ABCD)。
4.克拉佩龙方程
根据气液二相图,OK上的每一点的温度T与该点的压强p下的沸点相对应。温度低于沸点时只存在液相,温度高于沸点时只存在气相。
![]()
式中,l为相变潜热;T为相变温度;(v2-v1)为相变时体积的变化;dp/dT为相变时相平衡曲线的斜率(如图3-14所示)。(https://www.xing528.com)
(1)沸点与压强的关系
![]()
式中,1atm=1.01×105Pa。
(2)熔点与压强的关系

图3-15 范德瓦耳斯等温线
![]()
5.范德瓦耳斯方程
该方程考虑了分子作用力的影响,因此比理想气体方程更好地描述了实际气体的状态,而且在一定程度上还能描述液体的状态和气液相变的某些特点。
范德瓦耳斯等温线:根据范德瓦耳斯方程得到,如图3-15所示。
图3-15中,AB部分代表未饱和的蒸气,CD部分代表液体,BE代表过饱和蒸气,CF代表过热气体。图中的弯曲线段BEGFC代替了气液二相图中的BC线段,更加详细地反映了相变的过程。
范德瓦耳斯方程:
![]()
式中,p为压强;R为普适气体常数;T为温度;v为1mol气体的体积;a、b为常数。
(1)临界点K的状态参量

式中,KK为临界系数。
(2)对比物态方程:
![]()
状态参量与临界点状态参量的比值:
π=p/pK ω=v/vK τ=T/TK
3.10.4 固液相变
1.熔解:物质从固相转变为液相
(1)熔点:在一定的压强下,晶体的温度上升到熔解时的温度。
(2)熔解热:在熔解过程中,温度保持不变,但要吸收热量。熔解1kg的晶体所吸收的热量称为熔解热。

图3-16 固液二相图
2.凝固:物质从液相转变为固相
晶体的熔液凝固形成晶体,称为结晶。这个过程是无规则排列的原子形成空间点阵的过程。
3.固液二相图
图3-16中:①T为温度;p为压强;OL为熔解曲线,是固态和液态的分界线,左方为固相,右方为液相;OK为汽化曲线,是液态和气态的分界线,左方为液相,右方为气相。
②OL和OK的交点O称三相点,此时三相平衡共存。
③熔解曲线的斜率和汽化曲线的斜率一样,也决定于克拉佩龙方程。
3.10.5 固气相变
1.升华:物质从固相直接转变为气相
2.凝华:物质从气相直接转变为固相
3.固气二相图
图3-17中,T为温度;p为压强;OS为升华曲线,是固态和气态的分界线,其左方为固相,右方为气相;O点为三相点。
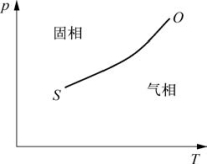
图3-17 固气二相图

图3-18 三相图
3.10.6 三相图
图3-18中,T为温度;p为压强;OS为升华曲线,是固态和气态的分界线;O为三相点,对应一个确定不变的温度和一个确定不变的压强。O点是唯一的三相共同平衡的状态。水的三相点温度是0.01℃(273.16K),压强是4.581mmHg。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




