3.6.1 结构图(见下页图)
3.6.2 热力学过程
当系统与外界交换能量时,系统的状态就要发生变化。当系统的状态随时间发生变化时,我们就称之为热力学过程。
在实际的热力学过程中,始末两个平衡态之间的中间状态,不可能都处于平衡态,而经常处于非平衡态,这样的过程称为非静态过程。如果把非静态过程近似看成平衡态,这个过程称准静态过程,也称平衡过程。这是一种理想过程,必须进行得无比缓慢才能无限接近平衡态。如图3-2所示。
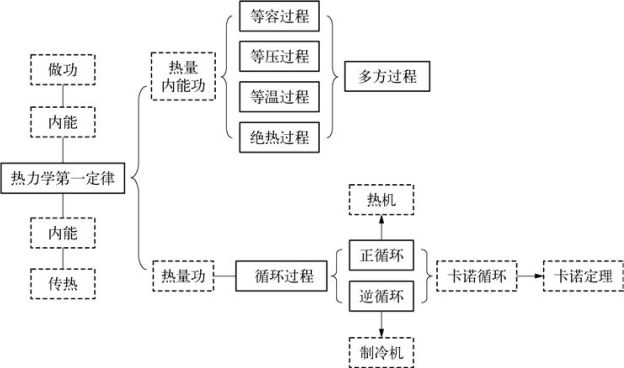
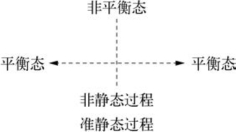
图3-2 平衡过程
3.6.3 做功和传热
做功和传热是系统与外界交换能量的两种方式,也是两种过程。
1.做功
dA=pdV
式中,p为气体压强。
说明:当dV>0时,系统膨胀,dA>0,系统对外界做正功;当dV<0时,系统压缩,dA<0,外界对系统做正功。
总功:
![]()
式中,A为系统做功,气体体积从V1变化到V2。
2.传热
dQ=νCmdT
式中,ν为物质的量,ν=M/Mm,M为气体的质量,Mm为气体的摩尔质量;Cm为摩尔热容,即1mol理想气体在一定条件下温度变化1K时传递的热量。
说明:当dT>0时,系统温度升高,dQ>0,外界对系统传热;当dT<0时,系统温度降低,dQ<0,系统对外界传热。
总热量:
Q=νCm(T2-T1)
式中,Q为系统传热,气体温度从T1变化到T2。
(1)等容过程:QV=νCV,m(T2-T1)
说明:气体体积不变,CV,m为定容摩尔热容。
CV,m=iR/2 (i为气体分子自由度,R为普适气体恒量)。
(2)等压过程:Qp=νCp,m(T2-T1)
说明:气体压强不变,Cp,m为定压摩尔热容。
Cp,m=(i+2)R/2
3.6.4 内能
1.内能是用来表达系统状态的物理量。
2.理想气体的内能仅是温度的函数。或者说,温度是系统内气体状态的一种表象,它的实质是能量的变化。
3.内能的变化:
E2-E1=ν(i/2)R(T2-T1)
4.热量传递的本质是传递能量,同样,做功的本质也是传递能量。
做功:系统发生位移;传热:系统温度发生变化。
3.6.5 热力学第一定律
1.这个定律是热力学系统的能量转化和守恒定律。即:不需要外界供给能量的永远做功的永动机是不存在的。

说明:系统吸热,Q为正值;系统放热,Q为负值。系统对外做功,A为正值;外界对系统做功,A为负值。
从公式中我们可以发现Q、E、A三者的关系,或者说热量、内能、功三者的关系。其实,统一可以看作是能量。
2.热力学第一定律对理想气体准静态过程的应用
(1)等容过程:V=常量
气体吸收的热量全部转化为内能增量:
QV=ΔE=νCV,mΔT=ν(i/2)RΔT
气体对外不做功:
A=0
(2)等压过程:p=常量
气体吸收的热量的一部分转变为内能增量:
Qp=ΔE=νCV,mΔT=ν(i/2)RΔT
气体吸收的热量的另一部分转变为气体对外做功:
![]()
(3)等温过程:T=常量
气体吸收的热量全部转变为对外做功:
![]()
(4)绝热过程:dQ=0(https://www.xing528.com)
绝热过程就是在系统状态改变的过程中,既不从外界吸热,也不放热。上面的三种情况都不是绝热过程。
dQ=0 Q=0
在绝热膨胀过程中:气体内能减少,全部转变为对外做功。
A=-νCV,mΔT
在绝热压缩过程中:外界对气体做功,全部转变为内能增量:
ΔE=νCV,mΔT
p、V、T三者的关系,用理想气体的绝热过程方程表达为:
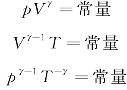
式中,γ为绝热指数。
(5)多方过程
实际上,气体既不等温,也不绝热,而是介于两者之间。
多方过程方程:
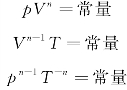
式中,n为常数,称为多方指数。
这个多方过程概括了以上四种过程:当n=∞时,是等容过程;当n=0时,是等压过程;当n=1时,是等温过程;当n=γ时,是绝热过程。
气体对外做功:
A=(P1V1-P2V2)/(n-1)
气体内能增量:
ΔE=νCV,m(T2-T1)
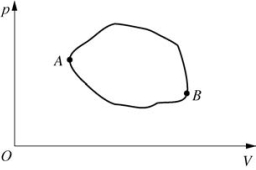
图3-3 循环过程
3.6.6 循环过程
1.一个系统从一种状态出发,经过任意一个过程后,又回到原来的状态,这个过程称循环过程,简称循环。
2.系统经过循环后,内能不变。循环过程仅涉及热量和功;多方过程涉及热量、内能和功。
(1)正循环:循环沿图3-3顺时针方向进行,系统对外界做正功。
(2)逆循环:循环沿图3-3逆时针方向进行,外界对系统做正功。
3.热机:利用工作物质做正循环的机器。
(1)工作物质从高温源吸收热量Q1,向低温源放出热量Q2,同时机器对外做正功,即:Q→A。
![]()
(2)热机效率:
![]()
4.制冷机:利用工作物质做逆循环的机器。
(1)外界对工作物质做功,从低温源吸收热量传递给高温物质,即:A→Q。
![]()
(2)制冷系数:
![]()
5.卡诺热机和卡诺循环
(1)卡诺热机
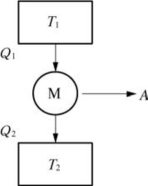
图3-4 卡诺热机
图3-4中,T1为温度恒定的高温热源,T2为温度恒定的低温热源,M为工作物质。工作物质M从高温热源T1吸收热量Q1,部分用来做功A,部分热量Q2从低温热源放出。
(2)卡诺循环由两个等温过程和两个绝热过程组成。
(3)目的:提高热机效率。
![]()
显然,T1越大,T2越小,效率η越高。
同理:
![]()
显然,T2越小,制冷系数ω越低。
6.卡诺定理
(1)在相同的高温热源和相同的低温热源之间工作的一切可逆热机,其效率η都相等,与工作实质无关。
(2)在相同的高温热源和相同的低温热源之间工作的一切不可逆热机,其效率η'不可能高于可逆热机的效率η。
(3)什么是可逆?
一个系统从某一状态出发,经过某一个过程,达到另一状态。如果沿相反方向进行,一切回到原状。这是一种理想过程,无摩擦的准静态过程是可逆过程。
(4)什么是不可逆?
一个系统从某一状态出发,经过某一过程,达到另一状态。如果沿相反方向进行,不能回到原状。一切自发的热力学过程都是不可逆过程。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




