一、实验目的
学习核糖核酸(RNA)提取及反转录PCR 的原理;了解RNA 提取中外源、内源RNA酶污染的去除方法;掌握RNA 提取方法及反转录PCR 的基本操作方法。
二、实验原理
1.RNA 提取
在进行实时荧光定量PCR、Northern杂交分析、cDNA 文库构建、cDNA 末端快速扩增等研究时均需要高质量的RNA,所以提取纯度高、完整性好的总RNA 是研究微生物表达组学的重要前提,是分子生物学研究的基础。RNA 的提取过程有五个关键点:①样品细胞的有效破碎;②核蛋白复合体的有效变性;③RNA 酶(RNase)的有效抑制;④RNA 从DNA 和蛋白混合物中有效分离;⑤杂质的有效去除。其中,最关键的是抑制RNase的活性。RNA 不稳定,极易被内源或外源的RNase降解,所以在RNA 提取过程中始终围绕着保护RNA 的完整性进行,避免其被RNase降解。围绕这条主线,要关注无RNase工作环境的建立,反应中无RNase条件的保持,RNA 电泳及结果分析等一系列的细节问题。
为了获得高质量RNA,必须使用RNA 酶抑制剂或采用破碎细胞和灭活RNA 酶同步进行的方法,最大限度地降低细胞破碎过程中所释放的RNase活性。同时,避免偶然引入实验室内的其他潜在的痕量RNA 酶也很重要。
下面列举外源RNase污染的来源及去除方法。
(1)玻璃制品、塑料制品和电泳槽的污染
灭菌的一次性使用塑料制品基本无RNA 酶,可以不经预处理直接用于制备和贮存RNA。实验室用的普通玻璃器皿和塑料制品通常有RNA 酶污染,玻璃器皿使用前可以在180℃条件下干烤8h灭活RNase;塑料制品或其他用于RNA 制备的用品可以用0.1% 焦碳酸二乙酯(DEPC)的水溶液浸泡以灭活RNase。DEPC是RNA 酶的强烈抑制剂,通过和组氨酸的咪唑环结合使蛋白质变性,可灭活所有蛋白质,但其作用也不是绝对的。玻璃或塑料器皿在0.1% DEPC水溶液中浸泡24h,取出于121℃湿热灭菌20min,烘干备用。高温处理可以彻底去除器皿上残留的DEPC,以防DEPC 通过羧甲基化作用对RNA 的嘌呤碱基进行修饰。用于RNA 电泳的电泳槽需要用去污剂洗干净,再用水冲洗,干燥后灌满3%的H2O2溶液,于室温放置10min,再用0.1%DEPC处理过的水彻底冲洗电泳槽。用于RNA 实验的玻璃器皿、塑料制品和电泳槽最好能做上特殊标记,存放在指定地点,作为RNA 实验专用。
注意:DEPC是一种潜在的强致癌剂,操作应尽量在通风橱中进行,并避免接触皮肤。DEPC在水溶液中不稳定,极易分解,所以处理塑料制品及容器的0.1% DEPC 水溶液必须现配现用。利用DEPC 高温下易分解为乙醇和CO2 的性质,将使用后的DEPC 溶液于121℃高压灭菌至少30min以去除溶液中的DEPC,避免环境污染。
(2)实验人员造成的污染
RNA 酶最主要的潜在污染源是实验人员的双手。因此,在涉及RNA 的一切操作过程中,实验人员都应戴一次性手套,一旦接触未经处理的玻璃器皿和其他物品,手套就可能沾染上RNase,因此进行RNA 实验时应定时更换手套。
(3)溶液的污染
配制用于RNA 提取和分析实验的溶液时,也要充分注意去除RNase。用RNA 研究专用的化学试剂配制溶液,用经无RNase处理过的药匙称取试剂,将溶液装入无RNase的玻璃器皿。溶液尽量用DEPC水配制,室温放置24h,然后121℃湿热灭菌20min。
注意:DEPC可与胺类迅速发生化学反应,因此不能用来处理含有Tris的缓冲液。可利用未开封的Tris晶体,用DEPC 处理水配制无RNA 酶的溶液。DEPC 水指终浓度含0.1%DEPC的水,配制方法是在1L双蒸水中加入1mL DEPC原液,摇匀过夜。DEPC 处理水是指用终浓度为0.1% DEPC 处理过的水,配制方法是在1L 双蒸水中加入1 mL DEPC原液,摇匀过夜后经过高温灭菌是彻底去除了DEPC的无菌无RNase水。
另外,细菌细胞内存在大量RNase,在细胞破碎的同时,RNase也被释放出来。提取RNA 时要注意抑制内源RNase活性,所以RNA 提取的样品要新鲜,一般是取样后立即提取RNA,如不能立刻进行提取,样品应保存在-80℃或含RNase抑制剂的溶液中。RNA 提取应始终在低温下进行以抑制内源RNase酶活性,如在冰上操作,4℃离心,并尽快去除蛋白质。加入去除蛋白质的试剂可去除内源RNase污染,RNase作为一种蛋白质,去除蛋白质的试剂可非特异性的抑制其活性。酚、氯仿、蛋白酶K、十二烷基硫酸钠、盐酸胍、异硫氰酸胍等均可抑制内源RNase活性,实验中一般选择性地加入一种或几种。
Trizol是一种新型总RNA 抽提试剂,含有苯酚、异硫氰酸胍等物质,能迅速破碎细胞并抑制细胞释放出的核酸酶,可以直接从细胞或组织中提取出高总产量的总RNA,结合机械破碎可获得更好的裂解样品,是目前常用的RNA 提取试剂。
2.反转录PCR
反转录PCR(Reverse Transcription,RT-PCR)又称为逆转录PCR。其原理是:提取组织或细胞中的总RNA,以其中的RNA 作为模板,采用随机引物或Oligo(dT)利用逆转录酶将RNA 反转录成cDNA,再以cDNA 为模板进行PCR 扩增,从而获得目的基因或检测基因表达。该技术主要用于分析基因转录的产物,获取目的基因,合成cDNA 探针以及构建RNA 高效转录系统等。
RT-PCR技术在环境领域中已被用于检测RNA 病毒、酶基因在特定环境条件下的表达情况等。按传统方法,水中肠道病毒检测依赖于动物细胞培养,这种方法费时费力。目前,已经有水生微生物学家用RT-PCR的方法检测出环境中的肠道病毒。RT-PCR 的另一重要应用是mRNA 分析,估计代谢活性。从某种意义上说,PCR 可以检测遗传潜能,而RT-PCR 能检测出实际的基因活性。
实验中,RT-PCR 可以分为两个步骤:第一步,在单引物和逆转录酶的作用下,合成RNA 互补的cDNA 链;第二步,以cDNA 为模板进行PCR 扩增,加入引物和Taq酶等进行常规PCR。也可用试剂盒进行一步法RT-PCR,即反转录和PCR 在一个反应管中依次进行。实验中要注意:反转录体系对RNA 总量有要求,做反转录前必须测定RNA 浓度。合成cDNA 时如选择随机引物,体系中所有的RNA 分子都充当了cDNA 第一链合成的模板,则cDNA 中约96%来源于核糖体RNA(rRNA)。真核细胞mRNA 具有3′端poly(A+)尾,用oligo(dT)作为合成cDNA 第一链的引物,仅有mRNA 可被转录。由于mRNA 仅占总RNA 的1%~4%,因此以oligo(dT)为引物合成的oligo(dT)比随机引物所得到的cDNA 的浓度和复杂性均要小。对于要研究特定mRNA 的情况,可以用目的mRNA 的互补序列的寡核苷酸作为合成cDNA 的引物,这类引物仅产生所需要的cDNA,特异性更高,利于后续的PCR 分析。
三、实验条件
1.仪器设备
小型台式高速冷冻离心机,FastPrep 样品处理器,PCR 仪,超微量紫外分光光度计(Nanodrop 2000),单道可调微量移液器,电泳仪,水平电泳槽,凝胶成像仪,离心管,Tip头,2mL研磨管,1mm 玻璃珠(或氧化钴珠),0.5cm 玻璃珠。
研磨管的准备:2mL研磨管中装入约1.5g 1mm 玻璃珠(或氧化钴珠)及一颗0.5cm玻璃珠,高压灭菌,烘干备用。
2.试剂与样品
(1)试剂:Trizol(Invitrogen公司),氯仿(AR),异丙醇(AR),无水乙醇(AR),RNA 纯化试剂盒,逆转录酶,RNase-Free水,RNA 酶抑制剂(RNasin),随机引物(或用逆转录试剂盒),Taq酶,dNTP,特异性的上下游引物,琼脂糖,6×Lodding Buffer,0.5×TAE,DNA Marker,溴化乙锭溶液。
75%乙醇溶液配制方法:75mL无水乙醇加25mL DEPC水,混匀。
(2)样品
由于RNA 极易被内源或外源的RNase降解,用于提取RNA 的样品最好是新鲜样品,如不能立刻抽提RNA,样品需要远距离运输或长期储存,建议先将样品(土壤、活性污泥、细胞、组织等)保存在RNA 保存液(RNAwait、RNAlater)中,或先用液氮冷冻,放入-80℃冰箱保存备用。冷冻的样品提取RNA 时,不要先解冻,直接加入Trizol进行RNA提取。
四、实验步骤
1.从活性污泥中提取微生物总RNA
(1)在无菌且含有玻璃珠的2mL 研磨管中加入活性污泥1.5mL,12 000r/min离心5min,去上清液,收集沉淀。此步骤重复三次(约收集4.5mL活性污泥的沉淀)。
(2)加入1mL Trizol,放入FastPrep 样品处理器,设置条件:高速振荡40s(如没有FastPrep 样品处理器,可用涡旋振荡器振荡5min代替),室温放置10min。
(3)加入0.2mL氯仿,盖紧离心管,用手剧烈振荡离心管15s,冰上静置15min。
(4)4℃,12 000r/min离心15min。小心转移上层水相于新的离心管中。这是关键的一步,离心后溶液分成三层,RNA 溶解在上清液里,所以从离心机取出离心管时要避免晃动,以免管内物质振荡导致下层沉淀激起。吸取上清液的时候一定要轻且慢,切忌吸入沉淀。如有必要可重复上述步骤一次。(https://www.xing528.com)
(5)加入2/3体积预冷的异丙醇,轻轻击打,冰上放置10min,12 000r/min离心10 min,去除上清液。
(6)加入1mL 75%乙醇洗涤沉淀,去除残留的有机试剂。涡旋混匀,务必使沉淀悬浮于乙醇中,冰上放置1~2 min,4℃12 000r/min 离心5 min,去上清液。重复上述步骤一次。
(7)小心弃去上清液,室温干燥5~10min,使乙醇完全挥发。注意不要过分干燥,过干的RNA 将难以溶解。加入50μL经DEPC处理的水溶解RNA,此即为粗提RNA,可进一步采用RNA 纯化试剂盒纯化RNA。提取的RNA 置-80℃冰箱保存备用。
(8)用超微量分光光度计Nanodrop 2000测定RNA 浓度及纯度。纯RNA 的OD260/OD280的比值为2.0,一般认为R=OD260/OD280值在1.8~2.0时,RNA 中蛋白或其他有机物的污染是允许的;当R<1.8时,说明RNA 中蛋白或者其他有机物的污染比较明显,应重新纯化。当R>2.2时,说明RNA 已经水解成为单核酸了。OD260/OD230的比值表征RNA 受多糖、酚、盐类等污染的程度,其值<2.0 表明RNA 中有碳水化合物(糖类)、盐类或有机溶剂污染。
2.两步法RT-PCR
(1)反转录
在0.2mL薄壁管中,按表7-2各试剂比例配制反转录体系(或按反转录试剂盒说明配制)。
表7-2 反转录体系配制比例

设置PCR 仪运行条件:30℃反应10min,42℃反应50min,然后于95℃加热5min以终止逆转录反应。
(2)PCR 扩增
在0.2mL薄壁管中,按表7-3比例配制PCR 体系。以没有反转录的RNA 样品和无菌水分别作为阴性对照。
表7-3 PCR 体系配制比例

放入PCR 扩增仪中,设置合适PCR 条件进行扩增,参考条件见表7-4。
表7-4 PCR 扩增条件

琼脂糖电泳检测PCR 扩增情况,凝胶成像仪观察并拍照。
五、实验结果与数据分析
1.PCR 结果记录
RNA 对照_________________cDNA_________________
无菌水对照_________________
注:cDNA 有目的扩增条带,RNA 对照无目的条带,无菌水对照无目的条带,说明RNA 提取及反转录实验成功。如无菌水对照有目的条带,说明PCR 受到污染;如RNA 对照有目的条带,说明提取的RNA 不纯,含有基因组DNA 污染。
2.数据分析
参考RNA 电泳图(图7-4),提取较好的RNA 电泳图中可见三个条带,原核分别是23S,16S和5S 核糖体RNA,而真核则分别为28S,18S和5S核糖体RNA。
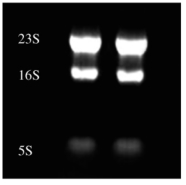
图7-4 总RNA琼脂糖电泳图
六、问题讨论
1.RNA 提取时避免RNase污染至关重要,请简述如何避免外源RNase污染。
2.什么是RT-PCR?在RT-PCR 时设置阴性对照和RNA 样品对照有何意义,如何设置?
七、注意事项
1.实验过程中要防止RNA 的降解,保持RNA 的完整性。在总RNA 提取时,注意避免mRNA 的断裂。
2.原核生物RNA 无poly(A)尾,所以不能用Oligo(dT)引物反转录,只能采用随机引物进行反转录。
3.RNA 提取时很可能会混入基因组DNA,为了避免DNA 污染,可以在反转录前采用转录级的DNA 酶处理,也可以采用试剂公司推出的具有去除基因组污染功能的反转录试剂盒来消除DNA 污染。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




