一、实验目的
学习PCR 扩增原理;了解PCR 扩增过程中各因素对扩增结果的影响;掌握PCR 扩增实验的操作方法;学会利用琼脂糖凝胶电泳法分析PCR 扩增结果及实验可能存在的问题。
二、实验原理
PCR 是聚合酶链式反应的简称,也可称为DNA 体外扩增技术。PCR 是以单链DNA为模板,4种dNTP为底物,在模板3′末端有引物存在的条件下,用DNA 聚合酶进行互补链的延伸。
1.PCR 循环
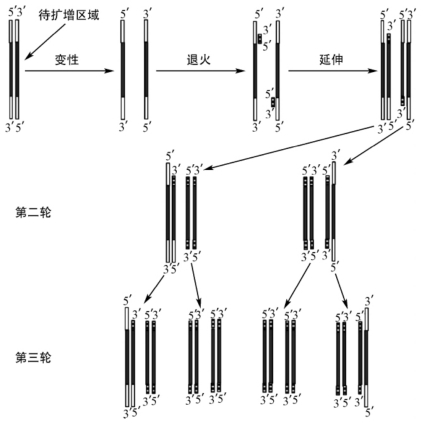
图7-2 PCP技术原理
PCR 循环一般分为变性(Denature),退火(Anneal),延伸(Extension)三个基本步骤(图7-2)。变性是指模板双链DNA 片段在高温时碱基对间的氢键断裂,DNA 双螺旋结构解体,由双链变成单链。退火指特异性寡核苷酸引物在适当温度下与单链模板上的目的DNA 序列互补结合。由于引物浓度较高,长度较短,在适宜温度下,引物与模板互补结合的速度要比两条模板链重新形成双链的速度快。延伸是指DNA 模板-引物结合物在DNA 聚合酶的作用下,以dNTP(四种脱氧核糖核苷三磷酸混合物,即dATP、dTTP、dGTP和dCTP的混合物)为反应原料,靶序列为模板,按碱基配对原则,合成一条新的与模板DNA 链互补的半保留复制链的过程。目前常用的DNA 聚合酶是Taq DNA 聚合酶,这种酶能耐受长时间高温,最适温度是72℃,在最适条件下每个酶子每分钟可以合成约1 000 bp的DNA。
重复变性-退火-延伸的过程,就可获得更多的“半保留复制链”,而且这种新链又可成为下次循环的模板。理论上,每增加一个循环,目的DNA 分子数就扩大一倍,即以指数方式增加。实际上,经历约25个循环以后,PCR 反应条件逐渐恶化(扩增产物的积累,引物及dNTP浓度的逐渐减少,DNA 聚合酶活性的降低等),PCR 产物趋于饱和,反应进入平台期,非特异性扩增产物逐渐增多。对于环境样品而言,为了降低非特异性扩增及PCR 反应偏好性的影响,一般采用25~30个循环为宜。
2.PCR 反应必备五要素
PCR 反应必须具备的五要素是引物,dNTP,DNA 聚合酶,模板与镁离子。
(1)引物
引物是PCR 特异性反应的关键。反应中,每条引物的浓度一般为5~100pmol/L,引物浓度偏高会引起错配和非特异性扩增,且可增加引物之间形成二聚体的机会,浓度过低则合成产物量减少。一般根据合成引物的nmol数加适当体积无菌超纯水将引物稀释为100mmol/L的储存液,再稀释十倍得到10mmol/L的使用液。50μL反应体系中加入1μL使用液即可。引物设计原则:长度一般15~30bp,常用18~27bp,有效长度不能大于38bp;序列Tm 值(Tm 值就是DNA 熔解温度,指DNA 的双螺旋结构降解一半时的温度)一般控制在55℃~60℃,尽可能保证上下游引物的Tm 值一致,一般相差不超过2℃;有效引物中(G+C)的比例为40%~60%;引物间无3′端互补、二聚体或发夹结构;引物3′端最末及倒数第二个碱基要求严格配对;引物3′端最好不用T,因为末端为T 时,在错配的情况也能引发新链的合成,引物3′端的最佳碱基选择是G 和C,因为它们形成的碱基配对比较稳定;引物应与核酸序列数据库里除目的序列外的其他序列无明显同源性。
(2)dNTP
dNTP的质量与浓度和PCR 扩增效率有密切关系。dNTP 很不稳定,多次冻融会使dNTP降解,保存不当其易变性失活。在PCR 反应中,常用的dNTP 浓度为20~200μmol/L,使用浓度高低取决于扩增片段的长短,扩增的片段长,需要的dNTP多,反应中四种dNTP的浓度要相等(等物质的量)。过高或过低的dNTP 浓度都对PCR 反应不利,dNTP浓度过高易产生错误碱基的掺入,浓度过低则降低扩增产物产量。实验中常用的dNTP浓度为每50μL反应体系中加入0.5μL 10mmol/L each的dNTP使用液。
(3)DNA 聚合酶
DNA 聚合酶对复制精确性影响较大,常用的Taq DNA 聚合酶由于没有3′→5′核酸外切酶活性,所以对合成的碱基没有校对作用,复制精确性较低。一些具有3′→5′核酸外切酶活性的DNA 聚合酶则复制精确性较高,PCR 产物的突变率低。典型的PCR 反应约需DNA 聚合酶量0.5~2.5U/50μL,酶浓度过高可引起非特异性扩增,浓度过低则不能得到足够的扩增产物。
(4)模板
单、双链DNA 均能作为模板,每个PCR 反应中加入的模板数量可在102~105分子间变化,必要时可低至50个分子。模板加入量不宜过多,加入过多的模板实际上也引入了多余污染物,难于得到纯净的DNA,当扩增产物不理想时,减少模板用量会得到意想不到的效果,而且模板浓度过高会导致反应的非特异性增加。
(5)镁离子(Mg2+)
Mg2+浓度与DNA 的解链温度、产物特异性及忠实性、引物二聚体的形成、酶活力及产物产量等因素有关。PCR 反应中使用的游离Mg2+浓度为0.5~2.5mmol/L,但dNTP、模板与产物DNA、引物、EDTA 都会与Mg2+结合,所以Mg2+的加入量要考虑这些物质的浓度。一般PCR 反应中,当dNTP浓度为200μmol/L 时,Mg2+浓度为1.5~2.0mmol/L 为宜。Mg2+浓度过高,反应特异性降低,出现非特异扩增,Mg2+浓度过低会降低Taq DNA聚合酶的活性,使反应产物减少。Mg2+浓度与PCR 反应成功与否关系密切,必要时可考虑按不同浓度加入Mg2+,寻找出其反应最适浓度。
除上述PCR 反应五要素外,必要时,可以在反应体系中加入一些PCR 添加剂。加入酶保护剂,如甜菜碱、小牛血清蛋白(BSA)、明胶或二硫苏糖醇(DTT),对扩增长片段或需时较长的PCR 反应效果明显。对于扩增长片段或高GC 含量的片段时,可加入甜菜碱、二甲亚砜、甘油或甲酰胺以降低DNA 变性温度。加入四甲基氯化铵能增加引物与模板配对的严格性,能提高PCR 效率和反应特异性。加入Tween 20会减少可能存在的阴离子去污剂对酶的抑制作用。添加剂的用量不宜过高,一般2%(v/v)即可。有些添加剂浓度过高还会抑制PCR 反应,如二甲亚砜达5%时即可抑制PCR 反应,所以PCR 添加剂在不同反应体系中的用量应通过实验来调整和合理选择,合理准确的使用会使一些难以进行的PCR 反应获得很大改善,得到试验所需要的理想结果。
3.琼脂糖凝胶电泳
琼脂糖凝胶电泳是分离纯化DNA 最常用的实验技术。琼脂糖是从琼脂中提取的聚合长链分子,能形成具有刚性的凝胶,凝胶孔径的大小与凝胶的浓度有关,浓度越大孔径越小。DNA 分子带负电荷,电泳时由负极向正极泳动,在分子筛效应影响下,DNA 分子根据分子质量大小及构型的不同,形成不同的DNA 条带。DNA 在凝胶中的迁移速度与其相对分子质量的对数值成反比。溴化乙锭(EB)是一种扁平分子,带正电荷,电泳时从正极向负极泳动。电泳时,DNA 分子与EB相遇结合形成EB-DNA 复合物,该复合物在紫外光下显橙红色荧光,其荧光强度与DNA 的含量成正比。电泳后,DNA 可分出不同的区带,达到分离、鉴定和提纯DNA 片段的目的。用已知片段大小和浓度的分子质量标准物作参考,根据条带的相对位置可粗略估计样品DNA 的片段大小,根据条带的荧光亮度可粗略估计样品DNA 的浓度。
本实验以PCR 扩增水样总DNA 中的16SrDNA 为例,学习PCR 的原理和一般操作过程,以大肠杆菌DNA 作阳性对照,以无菌水作阴性对照。学习用琼脂糖电泳判定PCR 扩增成功与否,并学会用琼脂糖电泳图分析实验中可能存在的问题。
三、实验条件
1.仪器设备
PCR 扩增仪,单道可调微量移液器(2.5μL、10μL、100μL、1 000μL),电泳仪,水平电泳槽,凝胶成像仪,1.5mL离心管,0.2mL薄壁管,无菌Tip头。
2.试剂与样品
(1)模板DNA:水样总DNA 和大肠杆菌(E.coli)总DNA。
(2)Taq DNA 聚合酶及其缓冲液:商品化的Taq DNA 聚合酶均配有10×Buffer,有的Buffer里面含有1.5mmol/L MgCl,没有的需要自己另行加入,使用前注意查看说明书。
(3)dNTP:2.5mmol/L each,dATP、dCTP、dGTP、dTTP浓度均为2.5mmol/L。
(4)引物:选用扩增16SrDNA 上V3区的引物,扩增产物大小约200bp,引物名中的数字是大肠杆菌16S rDNA 碱基编号的序号,引物名及序列分别为:338F:5′-ACTCCTACGGGAGGCAGCAG-3′;518R:5′-ATTACCGCGGCTGCTGG-3′。
(5)琼脂糖。
(6)50×TAE 电泳缓冲液(pH=8.5):每1 000mL 含Tris 242.0g,NaAc 57.1mL,Na2EDTA·2H2O 37.2g。使用时稀释100倍。
(7)6×Lodding Buffer:0.25%溴酚蓝,36%蔗糖,0.6% Tris碱。
(8)溴化乙锭的配制:称取0.1g溴化乙锭,溶于10mL 水,配成终浓度为10mg/mL的母液,于棕色瓶中保存。溴化乙锭为强致癌剂,使用时务必小心。可用无毒害的GelRed替代溴化乙锭。
(9)DNA Marker:可选用TaKaRa的DL2000。
四、实验操作(https://www.xing528.com)
1.预混液的配制
取一个1.5mL离心管,按表7-1用量,根据样品数计算出各试剂的加入量(本实验中模板仅为水样总DNA、E.coli总DNA,加上一个阴性对照,共计需要3个反应管,由于管壁吸附等损耗,预混液按4个反应体系配制),依次加入无菌水、10×buffer、dNTP、上下游引物、Taq DNA 聚合酶(注意:不加模板DNA),用微量移液器轻轻混匀(不要产生气泡)。
表7-1 PCR 反应体系的配制

2.分装
每个无菌0.2mL薄壁管中加入24μL预混液。
3.加模板
在上述已加入预混液的薄壁管中分别加入1μL 的水样总DNA、E.coli 总DNA(阳性对照)、无菌水(阴性对照),做好标记。
4.打开PCR 仪,按下述条件设置扩增程序,运行。
94℃3min→94℃30s,55℃30s,72℃40s(30个循环)→72℃5min→15℃
运行结束后,关闭PCR 仪,取出样品,PCR 产物于4℃或-20℃保存备用。
5.制胶
配制质量浓度约为1%的琼脂糖凝胶,称取琼脂糖0.2g,加入20~25mL 0.5×TAE,微波加热至完全溶解,待冷却到约50℃,加入EB(EB 是致癌剂,操作中注意戴好防护手套),终浓度0.5μg/mL,轻轻摇匀,倒入放有制胶板的制胶器中,插上梳子凝固待用。
6.点样
待凝胶完全凝固,轻轻拔出梳子,拿制胶板的两侧将凝胶从制胶器中取出,连制胶板一起放入电泳槽中,加入0.5×TAE至淹没凝胶,5μL PCR 产物与1μL 6×lodding buffer混匀后加入加样孔中,在一个空孔中加入4μL DL2000 Marker,记录点样次序和加样量,注意Tip头不要扎破胶孔边缘的凝胶。
7.电泳
连接电泳槽电极导线,点样孔端接负极,另一端接正极,打开电源,调电压至8~12V/cm,电泳30min左右,当溴酚蓝移到距胶孔2~4cm 时,停止电泳。
8.观察电泳结果
取出凝胶,在凝胶成像仪的托板上将凝胶从制胶板中倒出,312nm 波长紫外灯下观察,有橙红色荧光带的位置即为DNA 条带,电脑拍照记录电泳图谱。
五、实验结果与数据分析
1.记录观察结果:
阳性对照_____________水样总DNA_____________阴性对照_____________
注:阳性对照有目的条带,水样总DNA 有目的条带,阴性对照无目的条带,说明PCR实验成功。
2.参考电泳图(图7-3)
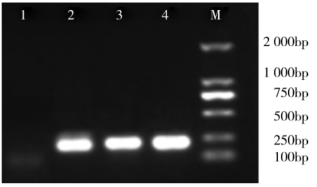
图7-3 PCR 产物琼脂糖电泳图
注:1—阴性对照;2—阳性对照;3—样品;4—样品;M—DL2000 Marker
六、问题与讨论
1.什么是PCR?PCR 技术的基本原理是什么?该技术在环境领域有何应用?
2.简述PCR 五要素在PCR 过程中的功能及各要素对PCR 结果的影响。
3.设计PCR 引物时,需要注意些什么?
4.如果PCR 产物电泳后发现样品没有出现目的条带,可以从哪些方面来分析出现此种情况的原因?
七、注意事项
1.阴性对照是PCR 结果可靠性的保证,每一次PCR 都必须设置阴性对照,只有在阴性对照无目的条带,而样品出现目的条带时才能证明PCR 实验成功。阴性对照出现目的条带,说明试剂被污染或操作过程中引入了污染,实验结果不可信。
2.设置阳性对照,可以避免假阴性结果。如果出现样品无目的条带,且阳性对照无目的条带,则很可能是PCR 操作出现问题或PCR 试剂失效。阳性对照出现目的条带,样品没有目的条带的情况则很可能是样品DNA 质量不够好(DNA 浓度过低或存在抑制PCR 反应的物质等)或样品中目的基因浓度低于PCR 检测限。
3.不同公司生产的Taq DNA 聚合酶的酶浓度不同,根据说明书的推荐用量加入合适体积的酶,大多DNA 聚合酶的最适温度是72℃,也有一些较为特殊的,要根据说明书设置延伸温度。
4.由于PCR 实验中加入试剂量都比较少,为了避免试剂未加入反应体系的操作失误,按体积从多到少的顺序加入试剂,且每次都需将Tip头插入液面以下。
5.EB 是致癌剂,使用中要注意防护并控制污染范围。有条件的实验室建议用Gel Red、SYBR Green、Gold View、Gel Green等毒性较小的染料替代EB,使用时注意选用合适的激发光波长。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




