一、实验目的
了解总脱氧核糖核酸(DNA)提取的基本原理;学习并掌握样品总DNA 提取的基本操作方法;了解各类环境样品DNA 提取的基本思路。
二、实验原理
从样品中分离纯化基因组脱氧核糖核酸(DNA)的技术称DNA 提取。环境样品总DNA 的提取是微生物分子生态学研究中最重要的实验技术之一,提取DNA 的质量将直接影响后续分析结果的可信度。
DNA 存在于细胞内,在细胞中以脱氧核糖核蛋白复合物(DNP)形式存在。从细胞中提取DNA 时,先把DNP与细胞碎片等其他杂质分开,再进一步将DNA 与核蛋白分离,得到纯化的DNA。DNA 呈弱酸性,溶于水,不溶于乙醇、氯仿等有机溶剂,其钠盐比游离酸DNA 易溶于水。提取DNA 时常采用1mol/L 的氯化钠浓度以增加DNA 在水中的溶解度。DNA 在酸性溶液中易水解,一般保存于pH=8.0的弱碱性溶液中。
DNA 的提取主要包括以下三个方面。
1.细胞的裂解
细胞裂解指用物理、化学或酶促方法使细胞裂解释放出DNA 的过程。环境样品常用的细胞裂解方法有物理裂解法(机械裂解法)、化学裂解法和酶裂解法。常用物理方法有:煮沸、冻融、微波、超声、研磨或玻璃珠振荡等;化学法包括浓盐、表面活性剂、热酚等,酶解法包括溶菌酶、蜗牛酶、蛋白酶等。DNA 提取中可选用上述一种或多种细胞裂解法,以提高细胞裂解效率,并保持DNA 分子的完整性。
2.蛋白质的去除和DNA 沉淀
酚-氯仿抽提法是传统的蛋白质去除方法,其作为蛋白质变性剂,同时抑制脱氧核糖核酸酶(DNase)的降解作用。抽提过程中,变性蛋白质的密度比水大比酚-氯仿小,因而离心后会沉淀在水相与酚-氯仿相中间。小心取出水相,多次重复抽提,可以彻底去除蛋白质。利用DNA 不溶于乙醇的特点,水相中加入终浓度为75%的乙醇,低温沉淀DNA,离心即可分离DNA。异丙醇也常被用于沉淀DNA。
3.DNA 纯化及DNA 提取效果的检测
沉淀得到的DNA 常含有腐殖酸、酚、氯仿等杂质,会影响后续分子生物学操作,需要进行纯化。纯化方法主要有电泳回收、氯化铯密度梯度离心、纯化试剂盒纯化等。氯化铯密度梯度离心有很好的分辨率,双链DNA,单链DNA,RNA 及蛋白质具有不同的密度,离心时形成不同密度的区带,该方法需要超速离心,适合大量DNA 的制备。电泳回收是DNA琼脂糖电泳后,切割下含有DNA 的胶块,用胶回收试剂盒回收凝胶中的DNA,该方法得到的DNA 纯度高,是分子生物学操作中常用的DNA 纯化方法。纯化试剂盒纯化指利用纯化试剂盒直接对DNA 进行纯化的方法,目前常用的DNA 纯化试剂盒大多采用纯化柱离心法,即在一定的条件下,核酸被选择性吸附到核酸吸附材料上,从而与其他杂质分离。受限于核酸吸附材料的核酸吸附量,该方法适用于少量DNA 纯化。
提取DNA 的量和纯度是衡量DNA 提取质量的重要参考指标,常用琼脂糖电泳检测DNA 完整度,用OD260(核酸吸光度)、OD280(蛋白质或氨基酸的吸光度)和OD230(其他杂质,如酚、盐类、多糖等的吸光度)的值来判定DNA 的浓度及纯度。标准DNA 样品浓度为1μg/mL时,其OD260=0.02,所以当OD260=1时,dsDNA 浓度约为50μg/mL,ssDNA 浓度约为37μg/mL。OD260/OD280反应核酸中蛋白质、RNA 的情况,纯DNA 的OD260/OD280≈1.8,该比值若大于1.9,说明DNA 中很可能有RNA 污染;若小于1.6则说明DNA 中有蛋白质、酚等污染。OD260/OD230 表征DNA 受多糖、酚、盐类等污染的程度,纯净的核酸OD260/OD230应该为2~2.5,过大或过小都说明核酸中有其他杂质污染。
环境样品种类较多,如饮用水、河流湖泊水、污水、土壤、沉积物、活性污泥、厌氧污泥等,对于气体样品、较为洁净的水样(如饮用水、海水)DNA 提取可以先用0.22μm 滤膜过滤,将微生物截留到膜上,再将膜剪碎放入离心管中裂解细胞提取DNA。污水、污泥样品可以先离心,去上清液后按土壤、沉积物类似的方法裂解细胞提取DNA。河流湖泊水根据水质情况选择过滤或离心处理后提取DNA。试剂公司推出了针对各类样品的商品化DNA提取试剂盒,其中一些能很好地提取小量DNA,如Mo Bio公司和MP Bio公司,这两个公司的试剂盒种类全,且提取的DNA 质量较好,一般无须再纯化,即能满足后续分析实验的纯度需要,但价格昂贵。下面以传统的DNA 提取法为例说明水样及土壤样品的DNA提取。
三、实验条件
1.仪器设备
样品处理器(MP FastPrep),水浴锅,单道可调微量移液器,台式高速离心机。
2.试剂与样品
无菌0.22μm 微孔滤膜,TE 溶液(10 mmol/L Tris-HCL,1 mmol/L EDTA,pH=8.0),DNA 提取缓冲液(100mmol/L Tris-HCl,100mmol/L EDTA,100mmol/L Na3PO4,1.5mol/L NaCl,1%CTAB,pH=8.0),20mg/mL 溶菌酶,10mg/mL 蛋白酶K,10 mg/mL RNase A,20% SDS,酚∶氯仿∶异戊醇(25∶24∶1),氯仿∶异戊醇(24∶1),5mol/L NaCl,3mol/L NaAc(pH=5.2),无水乙醇,70%乙醇,异丙醇,无菌Tip头,1.5mL、2mL和50mL离心管。
四、实验步骤
1.水样总DNA 提取
(1)用0.22μm 微孔滤膜过滤水样,根据水样的微生物含量确定需要过滤水的体积,确保滤膜上截留有足够数量的微生物,若微生物细胞数少于103将难以提取DNA。
(2)将滤膜对折(有微生物的面朝内),剪碎,放入2mL 离心管,加1mL TE 充分振荡混匀,去除滤膜,13 000r/min离心1min,去上清液。
(3)沉淀再悬浮于500μL的TE中,加20μL 20mg/mL 溶菌酶,室温放置10min;加40μL蛋白酶K,37℃放置1h。
(4)加1/3体积5mol/L NaCl,剧烈振荡混匀,13 000r/min离心5min,转移上清液至1.5mL离心管中。
(5)加等体积酚∶氯仿∶异戊醇(25∶24∶1),剧烈振荡,13 000r/min离心10min,溶液分为三层,中间白色层为变性蛋白质,小心转移上清液至1.5mL离心管中。重复此步操作,抽提至无可见白色蛋白质层为止。
(6)加等体积氯仿∶异戊醇(24∶1),剧烈振荡,13 000r/min离心10min,上清液转移至1.5mL离心管中。
(7)上清液加入0.6倍体积异丙醇,冰上静置30min,13 000r/min 离心10min,去除上清液。
(8)加500μL 70%乙醇洗涤沉淀,小心去除洗涤液。
(9)加300μL TE重新溶解沉淀,再加5μL 10mg/mL RNaseA 于65℃放置10min,加1/10体积3mol/L pH=5.2 的NaAc,2.5 倍体积无水乙醇,-20℃放置30 min 沉淀DNA,13 000r/min离心10min,去除上清液。(https://www.xing528.com)
(10)加500μL 70%乙醇洗涤沉淀,去除洗涤液。
(11)沉淀于50℃烘干,加50μL TE 溶解。测定![]() ,确定DNA 的纯度和浓度,DNA 于-20℃保存备用。
,确定DNA 的纯度和浓度,DNA 于-20℃保存备用。
2.土壤样品总DNA 提取
(1)于50mL离心管中加入5g土壤和20mL 无菌水,混匀,8 000r/min离心5min,去除上清液。再加入20mL无菌水重复上述操作。
(2)加入13.5 mL DNA 提取缓冲液(100 mmol/L Tris-HCl,100 mmol/L EDTA,100mmol/L Na3PO4,1.5mol/L NaCl,1% CTAB,pH=8.0),3g无菌玻璃珠,置于Fast Prep样品处理器上,设置运行参数:速度4.0,运行4×30s,运行仪器,破碎细胞。
(3)加入100μL 10mg/mL蛋白酶K 和200μL 20mg/mL溶菌酶,37℃水浴30min,每隔10min颠倒混匀(或用37℃恒温摇床,225r/min振荡30min)。
(4)加入1.5mL 20%SDS溶液,65℃水浴2h,每隔20min轻柔颠倒混匀。
(5)8 000r/min离心15min,小心转移上清液至无菌离心管中。
(6)上清液加等体积氯仿∶异戊醇(24∶1)抽提;重复2~3次,直至无变性蛋白析出为止。
(7)上清液中加入0.6倍体积的异丙醇,-20℃放置30min,沉淀DNA。
(8)12 000r/min 4℃离心20min收集DNA 沉淀。
(9)预冷的70%乙醇漂洗沉淀两次,干燥后用100μL双蒸水(ddH2O)溶解,加入10μL 10mg/mL RNase A,65℃放置30 min,转入1.5 mL 离心管,即为DNA 粗提液。测定OD260/OD280及OD260/OD230,确定DNA 的纯度和浓度,粗提的DNA 于-20℃保存备用。根据需要可用氯化铯密度梯度离心或胶回收试剂盒进行纯化。
五、实验结果与数据分析
提取出来的DNA 除做吸光度测定,一般还要进行琼脂糖电泳,观察DNA 的完整程度。较为完整的DNA 在琼脂糖胶上会形成一条明亮的条带,如图7-1所示。该图为实验室研究生提取活性污泥总DNA 的电泳图,该DNA 完整度较好,适于进行后续分析。
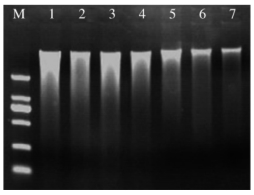
图7-1 基因组DNA琼脂糖电泳图
注:M:①DL2000marker;②1~7:总DNA
六、问题讨论
1.影响DNA 提取效率的因素有哪些?
2.如何根据OD 值来判断DNA 的纯度及浓度?
七、注意事项
1.最好使用新鲜样品,低温保存的样品置冰上解冻且不要反复冻融。
2.样品务必裂解完全、彻底,这是影响DNA 提取率的关键因素。固体样品提取时,如果没有FastPrep样品处理器,可采用涡旋振荡器代替,振荡时间可延长至10min。
3.加入氯仿后要充分混匀,但是动作要轻柔,避免DNA 断裂。离心分离的离心力和时间要足够。
4.转移上清液时,确保不要吸入中间的蛋白层及有机相。如果所得DNA OD260/OD280比值偏低,可以用氯仿∶异戊醇(24∶1)重新抽提一次,再沉淀,溶解。
5.DNA 沉淀离心后,去上清液、去除洗涤液等操作务必小心,不要将DNA 也一并丢弃。不建议直接倒去上清液,特别是洗涤后的DNA 可能与管壁黏合不牢,容易被溶液带走。比较可靠的做法是用移液器小心地将液体吸出,吸液体时Tip头不要碰到DNA 沉淀。
6.DNA 干燥要适度,过分干燥的DNA 很难完全溶解。
7.DNA 溶解可以用无菌水或TE缓冲液,但如果要长期保存,建议用TE 缓冲液。TE缓冲液中的EDTA 可以螯合Mg2+和Mn2+,从而抑制DNase,并且TE缓冲液pH=8.0,可以防止DNA 酸降解,利于DNA 长期稳定保存。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




