甲烷中的C-H 键能(439 kJ·mol-1)与氢气中的H-H 键能(435 kJ·mol-1)相近,因此与氢氧燃烧的启动步类似,甲烷的自由基启动步是氧分子O2从甲烷分子中提取一个氢原子的过程
如果压力在1~10 个大气压之间,当温度足够低(<800 K),甲基自由基CH3·与一个氧分子结合生成过氧化甲基自由基CH3O2·的反应步占主导
接下去的反应步为CH3O2·的氢提取反应
CH3O2H的分解为分岔反应步
式(4.14)的反应产物会引发如下的反应传播步
显然,式(4.13)~式(4.17)代表的分岔链式反应能否发生取决于可逆反应步(4.12)的正向反应是否占主导。
从焓的角度,反应倾向于向化学键生成而非分解的方向进行,即偏向于放热反应方向,这样可以使得体系的总能量(总焓)更低。而从熵增的角度,温度的上升会使得TΔS0r取越来越大的负值,熵增对反应方向的影响与焓的影响相互竞争。反应生成的反应物摩尔数越多,体系的熵增越大,所以熵效应会使得反应倾向于向分解而非合成的方向进行。对于正向反应为成键反应,而逆反应为分解反应的反应而言,正方向还是逆方向反应占优取决于焓效应和熵效应之间的竞争。(https://www.xing528.com)
式(4.12)的正向反应为放热反应,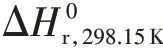 =-119 kJ⋅mol-1,且在温度范围298.15~1 000 K 时基本保持不变,而在高温下CH3O2⋅中的C-O 键会断裂。式(4.12)的正向反应熵变化为
=-119 kJ⋅mol-1,且在温度范围298.15~1 000 K 时基本保持不变,而在高温下CH3O2⋅中的C-O 键会断裂。式(4.12)的正向反应熵变化为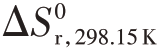 =-137 kJ⋅mol-1,同样
=-137 kJ⋅mol-1,同样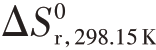 在温度范围298.15~1 000 K 内基本保持不变。式(4.12)的正向反应在298.15 K、800 K 和1 000 K 下Gibbs 自由能的变化ΔGr0 分别为-78 kJ·mol-1、-8 kJ·mol-1和18 kJ·mol-1。由于Gibbs自由能的变化ΔGr0 在800 K时从负号变成正号,即当温度上升超过800 K 时,式(4.12)的正向反应Gibbs 自由能从降低变为增加。而热力学均衡告诉我们,一个自发的反应一定向着吉布斯(Gibbs)自由能下降的方向进行。因此当温度超过800 K时,式(4.12)的反应将向着逆方向进行,此后CH3O2⋅的浓度随着温度的上升而迅速下降。我们可以通过式(4.12)的均衡态组分浓度比例来定量阐明这一点。式(4.12)的均衡常数为
在温度范围298.15~1 000 K 内基本保持不变。式(4.12)的正向反应在298.15 K、800 K 和1 000 K 下Gibbs 自由能的变化ΔGr0 分别为-78 kJ·mol-1、-8 kJ·mol-1和18 kJ·mol-1。由于Gibbs自由能的变化ΔGr0 在800 K时从负号变成正号,即当温度上升超过800 K 时,式(4.12)的正向反应Gibbs 自由能从降低变为增加。而热力学均衡告诉我们,一个自发的反应一定向着吉布斯(Gibbs)自由能下降的方向进行。因此当温度超过800 K时,式(4.12)的反应将向着逆方向进行,此后CH3O2⋅的浓度随着温度的上升而迅速下降。我们可以通过式(4.12)的均衡态组分浓度比例来定量阐明这一点。式(4.12)的均衡常数为
在298.15 K、800 K和1 000 K下,Kp分别为5×1013、3和0.1(atm-1)。在800 K和1个大气压下,
如果氧气的摩尔分数为0.2,则氧气的摩尔浓度为[O2]=3×106 cm3·mol-1,代入式(4.19)中,得到均衡态的CH3O2·的浓度与CH3·的浓度比值为![]() ≈0.6。而在1 000 K 时,
≈0.6。而在1 000 K 时,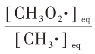 ≈0.02,此时CH3O2·的浓度显著下降。
≈0.02,此时CH3O2·的浓度显著下降。
同样可以通过反应动力学来证明反应式(4.12)在800 K附近时反应的方向会发生逆转。式(4.12)正方向反应代表一个三分子基元反应,其反应率常数为
热力学均衡和反应动力学都表明,式(4.12)~式(4.17)代表的分岔链式反应只有在800 K以下的温度范围内占主导,这个机理被认为是甲烷低温氧化的主要路径。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




