有机化学实验离不开溶剂,溶剂不仅作为反应介质使用,而且在产物的纯化和后处理中也经常使用。市售的有机溶剂有工业纯、化学纯和分析纯等各种规格,纯度愈高,价格愈贵。在有机合成中,常常根据反应的特点和要求,选用适当规格的溶剂,以便能够使反应顺利进行而又符合勤俭节约的原则。某些有机反应(如格林尼亚反应等),对溶剂要求较高,即使微量杂质或水分存在,也会对反应速率、产率和纯度带来一定的影响。由于有机合成中使用溶剂的量都比较大,若仅依靠购买市售纯品,不仅价值较高,有时也不一定能满足反应的要求。因此,了解有机溶剂性质及纯化方法,是十分重要的。有机溶剂的纯化,是有机合成工作的一项基本操作。这里介绍市售的普通溶剂在实验室条件下常用的纯化方法。
1.无水乙醇(absolute ethyl alcohol)
b.p.=78.5℃,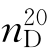 =1.3611,
=1.3611,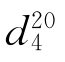 =0.7893。
=0.7893。
市售的无水乙醇一般只能达到99.5%的纯度,在许多反应中需用纯度更高的无水乙醇,经常需自己制备。通常工业用95.5%的乙醇不能直接用蒸馏法制取无水乙醇,因为95.5%的乙醇和4.5%的水形成恒沸点混合物。要把水除去,第一步是加入CaO(生石灰)煮沸回流,使乙醇中的水与生石灰作用生成Ca(OH)2,然后再将无水乙醇蒸出。这样得到的无水乙醇纯度最高约为99.5%。纯度更高的无水乙醇可用金属镁或金属钠进行处理。
(1)无水乙醇(含量99.5%)的制备。
具体操作详见本书实验11。
(2)无水乙醇(含量99.95%)的制备。
①用金属镁制取:在250mL的圆底烧瓶中,放置0.6g干燥纯净的镁条、10mL的99.5%的乙醇。装上回流冷凝管,并在冷凝管上端加一只无水CaCl2干燥管。在沸水浴或用火直接加热使达微沸,移去热源,立刻加入几粒碘片(此时注意不要振荡),顷刻即在碘粒附近发生作用,最后可以达到相当剧烈的程度。有时作用太慢则需加热,如果在加碘之后作用仍不开始,则可再加入数粒碘(一般乙醇与镁的作用是缓慢的,如所用乙醇的含水量超过0.5%,则作用更加困难)。待全部镁作用完毕,加入100mL的99.5%的乙醇和几粒沸石。回流1h,蒸馏,产物收存于玻璃瓶中,用一橡皮塞或磨口塞塞住。
②用金属钠制取:实验装置和实验操作同①。在250mL圆底烧瓶中,放置2g金属钠和100mL纯度至少为99%的乙醇,加入几粒沸石。加热回流30min后,加入4g邻苯二甲酸二乙酯,再回流10min。取下冷凝管,改成蒸馏装置,按收集无水乙醇的要求进行蒸馏。产品储存于带有磨口塞或橡皮塞的容器中。
注意 加入邻苯二甲酸二乙酯的目的,是利用它和NaOH进行如下反应:
因此,消除了NaOH,促使乙醇钠再和水作用,这样制得的乙醇可以达到很高的纯度。
2.无水乙醚(absolute ether)
b.p.=34.5℃,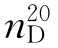 =1.3526,
=1.3526,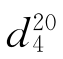 =0.71378。
=0.71378。
普通乙醚中含有一定量的水、乙醇及少量过氧化物等杂质,这对于要求以无水乙醚作溶剂的反应(如格林尼亚反应)来说,不仅影响反应的进行,且易发生危险。试剂级的无水乙醚往往不合要求,且价格较贵,因此,在实验中常需自行制备。制备无水乙醚时,首先要检验有无过氧化物。为此取少量乙醚与等体积的2%的KI溶液,加入几滴稀盐酸一起振摇,若能使淀粉溶液呈紫色或蓝色,即证明有过氧化物存在。除去过氧化物可新配制FeSO4溶液,除水可用浓硫酸。具体操作详见实验12。
3.无水甲醇(absolute methyl alcohol)
b.p.=64.96℃,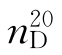 =1.3288,
=1.3288,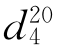 =0.7914。
=0.7914。
市售甲醇系由合成而来,含水量为0.5%~1%。由于甲醇和水不能形成共沸点的混合物,为此可借高效的精馏柱将少量水除去。精制甲醇含有0.02%的丙酮和0.1%的水,一般已可应用。如要制得无水甲醇,可用镁的方法(参见“无水乙醇”的内容)。若含水量低于0.1%,亦可用3A或4A型分子筛干燥。甲醇有毒,处理时应避免吸入其蒸气。
4.苯(benzene)
b.p.=80.1℃,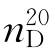 =1.5011,
=1.5011,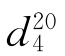 =0.87865。
=0.87865。
普通苯含有少量的水(可达0.02%),由煤焦油加工得来的苯还含有少量噻吩(沸点84℃),不能用分馏或分步结晶等方法分离除去。为制得无水无噻吩的苯,可采用下列方法:在分液漏斗内将普通苯及相当苯体积15%的浓硫酸一起振荡,振荡后将混合物静置,弃去底层的酸液,再加入新的浓硫酸,这样重复操作直至酸层呈现无色或淡黄色,且检验无噻吩为止。分去酸层,苯层依次用水、10%的Na2CO3溶液、水洗涤,用CaCl2干燥,蒸馏,收集80℃的馏分。若要高度干燥,可加入钠丝(参见“无水乙醚”的内容)进一步去水。由石油加工得来的苯,一般可省去除噻吩的步骤。
噻吩的检验如下:取5滴苯放入小试管中,加入5滴浓硫酸及1~2滴1%的α,β-吲哚醌-浓硫酸溶液,振荡片刻。如溶液呈墨绿色或蓝色,表示有噻吩存在。
5.丙酮(acetone)
b.p.=56.2℃,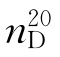 =1.3588,
=1.3588,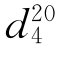 =0.7899。
=0.7899。
普通丙酮中往往含有少量水及甲醇、乙醛等还原性杂质,可用下列方法精制:
(1)在100mL丙酮中加入0.5g的KMnO4回流,以除去还原性杂质。若KMnO4溶液紫色很快消失,需要加入少量KMnO4继续回流,直至紫色不再消失为止。蒸出丙酮,用无水K2CO3或无水CaSO4干燥,过滤,蒸馏收集55.0~56.5℃的馏分。
(2)在100 mL丙酮中加入4 mL的10%的AgNO3溶液及35 mL的0.1mol/L的NaOH溶液,振荡10 min,除去还原性杂质。过滤,滤液用无水CaSO4干燥后,蒸馏收集55.0~56.5℃的馏分。
6.乙酸乙酯(ethyl acetate)
b.p.=77.06℃,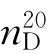 =1.3723,
=1.3723,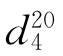 =0.9003。
=0.9003。
市售的乙酸乙酯中含有少量水、乙醇和醋酸,可用下述方法精制:
(1)在100mL乙酸乙酯中加入10mL醋酸酐、1滴浓硫酸,加热回流4h,除去乙醇及水等杂质,然后进行分馏。馏液用2~3g无水K2CO3振荡干燥后蒸馏,最后产物的沸点为77℃,纯度达99.7%。
(2)将乙酸乙酯先用等体积5%的Na2CO3溶液洗涤,再用饱和CaCl2溶液洗涤,然后用无水K2CO3干燥后蒸馏。(https://www.xing528.com)
7.二硫化碳(carbon disulfide)
b.p.=46.25℃,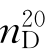 =1.63189,
=1.63189,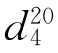 =1.2661。
=1.2661。
CS2为有较高毒性的液体(能使血液和神经中毒),它具有高度的挥发性和易燃性,所以,在使用时必须十分小心,避免接触其蒸气。一般有机合成实验对CS2要求不高,可在普通CS2中加入少量研碎的无水CaCl2,干燥后滤去干燥剂,然后在水浴中蒸馏收集。
若要制得较纯的CS2,则需将试剂级的CS2用0.5%的KMnO4水溶液洗涤3次,除去H2S,再用汞不断振荡除去硫,最后用2.5%的HgSO4溶液洗涤,除去所有恶臭(剩余的H2S),再经CaCl2干燥,蒸馏收集。其纯化过程的反应式如下:
8.氯仿(chloroform)
b.p.=61.7℃,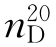 =1.4459,
=1.4459,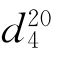 =1.4832。
=1.4832。
普通用的氯仿含有1%的乙醇,这是为了防止氯仿分解为有毒的光气、作为稳定剂加入的。为了除去乙醇,可以将氯仿用一半体积的水振荡数次,然后分出下层氯仿,用无水CaCl2干燥数小时后蒸馏。
另一种精制方法是将氯仿与小量浓硫酸一起振荡2~3次。每1000mL氯仿用浓硫酸50mL。分去酸层以后的氯仿用水洗涤,干燥,然后蒸馏。除去乙醇的无水氯仿应保存于棕色瓶中,并且不要见光,以免分解。
9.石油醚(petroleum)
石油醚为轻质石油产品,是低相对分子质量烃类(主要是戊烷和己烷)的混合物。其沸程为30~150℃,收集的温度区间一般为30℃左右,如有30~60℃、60~90℃、90~120℃等沸程规格的石油醚。石油醚中含有少量不饱和烃,沸点与烷烃相近,用蒸馏法无法分离,必要时可用浓硫酸和KMnO4把它除去。通常将石油醚用其体积1/10的浓硫酸洗涤2~3次,再用10%的硫酸加入KMnO4配成的饱和溶液洗涤,直至水层中的紫色不再消失为止。然后再用水洗,经无水CaCl2干燥后蒸馏。如要绝对干燥的石油醚则加入钠丝(参见“无水乙醚”的内容)。
10.吡啶(pyridine)
b.p.=115.5℃,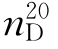 =1.5095,
=1.5095,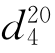 =0.9819。
=0.9819。
分析纯的吡啶含有少量水分,但已可供一般应用。如要制得无水吡啶,可与粒状KOH或NaOH一同回流,然后隔绝潮气蒸出备用。干燥的吡啶吸水性很强,保存时应将容器口用石蜡封好。
11.N,N-二甲基甲酰胺(N,N-dimethyl formamide)
b.p.=149~156℃,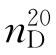 =1.4305,
=1.4305,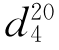 =0.9487。
=0.9487。
N,N-二甲基甲酰胺含有少量水分。在常压蒸馏时有少量分解,产生二甲胺与CO。若有酸或碱存在时,分解加快,所以,在加入固体KOH或NaOH在室温放置数小时后,即有部分分解。最好用CaSO4、MgSO4、BaO、硅胶或分子筛干燥,然后减压蒸馏,收集76℃/4.79kPa(36mmHg)的馏分。如果其中含水较多时,可加入1/10体积的苯,在常压及80℃以下蒸去水和苯,然后用MgSO4或BaO干燥,再进行减压蒸馏。
在N,N-二甲基甲酰胺中如有游离胺存在,可用2,4-二硝基氟苯产生颜色进行检查。
12.四氢呋喃(tetrahydrofuran)
b.p.=67℃,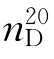 =1.4050,
=1.4050,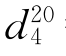 =0.8892。
=0.8892。
四氢呋喃系具乙醚气味的无色透明液体,市售的四氢呋喃常含有少量水分及过氧化物。如要制得无水四氢呋喃,可与氢化锂铝在隔绝潮气下回流(通常1000mL约需2~4g氢化锂铝),除去其中的水和过氧化物,然后在常压下蒸馏,收集66℃的馏分。精制后的液体应在N2气氛中保存,如需较久放置,应加0.025%的4-甲基-2,6-二叔丁基苯酚作抗氧剂。处理四氢呋喃时,应先用小量进行试验,以确定只有少量水和过氧化物、作用不致过于猛烈时方可进行。
四氢呋喃中的过氧化物可用酸化的KI溶液来试验。如过氧化物很多,应另行处理为宜。
13.二甲亚砜(dimethyl sulfone)
b.p.=189℃(m.p.=18.5℃),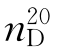 =1.4783,
=1.4783, =1.0954。
=1.0954。
二甲亚砜为无色、无臭、微带苦味的吸湿性液体。常压下加热至沸腾,可部分分解。市售试剂级二甲亚砜的含水量约为1%,通常先减压蒸馏,再用4A型分子筛干燥;或用氢化钙粉末搅拌4~8h,再减压蒸馏收集64~65℃/533Pa(4mmHg)的馏分。蒸馏时,温度不宜高于90℃,否则会发生歧化反应而生成二甲砜和二甲硫醚。二甲亚砜与某些物质混合时,可能发生爆炸,如氢化钠、高碘酸或高氯酸镁等,应加以注意。
14.二氧六环(dioxane)
b.p.=101.5℃(m.p.=12℃),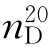 =1.4224,
=1.4224,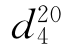 =1.0336。
=1.0336。
二氧六环作用与醚相似,可与水任意混合。普通二氧六环中含有少量二乙醇缩醛与水,久贮的二氧六环还可能含有过氧化物。二氧六环的纯化,一般加入质量分数为10%的盐酸与之回流3h,同时慢慢通入N2,以除去生成的乙醛,冷至室温,加入粒状KOH直至不再溶解。然后分去水层,用粒状KOH干燥后过滤,再加入金属钠加热回流数小时,蒸馏后压入钠丝保存。
15.1,2 二氯乙烷(1,2-dichloro ethane)
b.p.=83.4℃,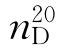 =1.4448,
=1.4448,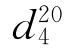 =1.2531。
=1.2531。
1,2-二氯乙烷为无色油状液体,有芳香味。1份1,2-二氯乙烷溶于120份(体积)水中,与之形成恒沸点混合物,沸点为72℃,其中含81.5%的1,2-二氯乙烷。1,2-二氯乙烷可与乙醇、乙醚、氯仿等相混溶。在结晶和提取时是极有用的溶剂,比常用的含氯有机溶剂更为活泼。一般纯化可依次用浓硫酸、水、稀碱溶液和水洗涤,用无水CaCl2干燥或加入P2O5分馏即可。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




