1.酯化反应有什么特点?在实验中采取哪些措施来提高乙酸乙酯的产率?
●答 酯化反应是可逆反应。
本实验采用增加反应物之一乙醇的用量、不断将反应产物乙酸乙酯和水蒸出,使平衡向右移动,以及稍多加催化剂硫酸的用量以除水等措施来提高乙酸乙酯的产率。
2.酯化反应中采用醇过量好,还是采用酸过量好?
●答 酯化反应中使用过量的酸还是过量的醇,主要取决于原料是否易得、价格是否合适,以及过量的原料与产物是否容易分离等因素。例如,制取乙酸乙酯时宜采用乙醇过量,而制取乙酸正丁酯时宜采用乙酸过量。
3.浓硫酸在酯化反应中有何作用?一般硫酸用量为醇用量的3%就可以,为何本实验要稍多加一些?是否是加得越多越好?
●答 浓硫酸在酯化反应中主要起催化作用。催化所需硫酸的量只要醇用量的3%就可以,本实验之所以要稍多加一些,是因为浓硫酸除起催化作用外,还可以吸收反应生成的副产物水,从而促使反应朝生成乙酸乙酯方向进行。但硫酸也不能加得太多,否则加热时浓硫酸的氧化反应加剧,对酯化不利,也不经济。
4.在乙酸乙酯制备中,若温度过高或乙醇-乙酸混合液滴加速度太快,会对反应有何影响?
●答 反应温度过高,会增加副产物乙醚的含量,也会加剧浓硫酸的氧化反应而不利于酯化。
乙醇-乙酸混合液滴加速度太快,会使乙醇和乙酸来不及反应而被蒸馏出。
5.在乙酸乙酯制备中,可能发生哪些副反应?在馏出液中可能有哪些杂质?实验中是怎样除去的?
●答 可能发生的副反应如下:
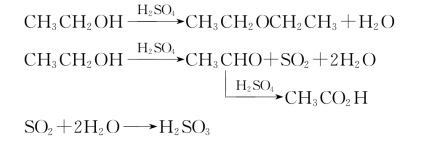
在馏出液中除产品乙酸乙酯外,还有少量未反应的乙醇、乙酸、亚硫酸、乙醚和水等杂质。
加饱和Na2CO3溶液除去酸;加饱和CaCl2溶液除去乙醇;加无水MgSO4除去水;蒸馏时除去前馏分,则可除去乙醚。(https://www.xing528.com)
6.在乙酸乙酯粗产物的精制中,饱和Na2CO3溶液是除酸,饱和CaCl2溶液是除醇。为何在这两步之间要加饱和NaCl溶液洗涤?用水洗涤可以吗?能否用浓NaOH溶液代替饱和Na2CO3溶液洗涤?
●答 当酯层用饱和Na2CO3溶液洗涤后,若紧接着就用饱和CaCl2溶液洗涤,则残留在酯中的Na2CO3就会与CaCl2反应而产生絮状的CaCO3沉淀造成分离的困难,所以,在这两步之间要加饱和NaCl洗涤。一方面可以除去残留在酯中的Na2CO3,另一方面还可以降低酯在水中的溶解度,而且可以防止乳化,有利于分层,便于分离。
这里不能用水代替饱和NaCl溶液洗涤,因为酯在水中的溶解度较大(每17份水溶解1份乙酸乙酯)。
这里也不能用浓的NaOH溶液代替饱和Na2CO3溶液来洗涤,因为酯在强碱溶液中容易发生水解。
7.在制备实验中,常用化学干燥法除去液体有机物中的少量水分,选择干燥剂时应该注意哪些问题?为何本实验不用无水CaCl2干燥乙酸乙酯?
●答 选择干燥剂时应注意的事项如下:
(1)不与被干燥的有机物发生任何化学反应。
(2)不溶解于被干燥的有机物中。
(3)对被干燥的有机物无催化作用。
(4)干燥速度要快,吸水量要大。
由于CaCl2能与醇类、酯类形成分子络合物,因此,不能用CaCl2干燥醇类、酯类。
8.为什么乙酸乙酯粗产物中的杂质未除净或干燥不完全,会影响产率?
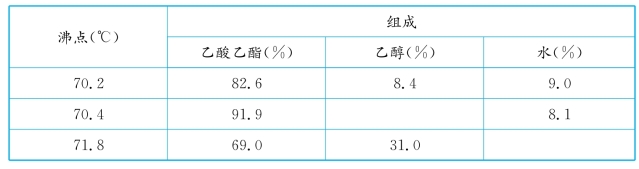
●答 因为乙酸乙酯与乙醇或水会形成二元和三元恒沸物,所以,粗产物中的杂质未除净或干燥不完全时,会使沸点下降而影响产率。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




