一、实验目的
(1)学习用环己醇氧化制备己二酸的原理和方法。
(2)掌握浓缩、过滤、重结晶等操作技能。
二、实验原理
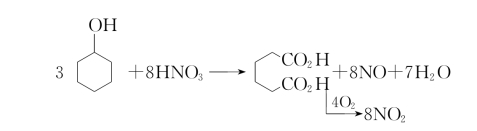
三、仪器与试剂
1.实验仪器
三颈烧瓶(250mL),温度计(0~100℃),恒压漏斗,球形冷凝管,量筒(10mL,50mL),三角漏斗,抽滤瓶,布氏漏斗,小烧杯。
2.实验药品
环己醇2.7mL(2.5g,约0.025mol),50%的硝酸8mL,偏钒酸铵,稀NaOH溶液。
3.实验装置图
实验装置如图3-8所示。
四、实验步骤
(1)用50mL量筒量取8mL的50%的硝酸加入250mL三颈烧瓶中,再加入少许偏钒酸铵,瓶口分别安装温度计、回流冷凝管和恒压漏斗。冷凝管上端接一尾气吸收装置,用碱液吸收反应中产生的NO2和NO气体。
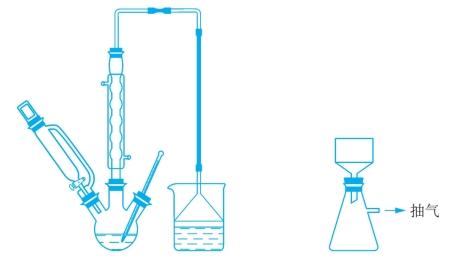
图3-8 己二酸的制备装置图
(2)量取2.7mL的环己醇加入恒压漏斗中,加完后用1.5mL的水洗涤量过环己醇的量筒,并倒入恒压漏斗中。
(3)将三颈烧瓶用酒精灯预热至50℃左右,然后移去热源,先滴入5~6滴环己醇。反应开始后,瓶内反应物温度升高,并有红棕色气体放出。然后,慢慢滴加剩余的环己醇(m.p.=21~24℃),调节滴加速度,保持瓶内温度在55~65℃之间,使反应液处于微沸状态。(https://www.xing528.com)
(4)当温度过高时,用冷水冷却;当温度过低时,用酒精灯加热。
(5)加完(约15min)后继续加热回流10min,直至无红棕色气体(NO2)放出为止。
(6)趁热将反应液倒入100mL烧杯中,冷水浴冷却后抽滤,用10mL冰水洗涤,干燥后,称重,计算产率。
五、注意事项
(1)本装置严禁漏气,用碱液吸收尾气(NO2和NO),最好在通风橱中进行。
(2)环己醇与浓硝酸切勿用同一量筒量取,因二者相遇会发生剧烈反应,甚至发生意外。
(3)环己醇的熔点为24℃,熔融时为黏稠状液体。为了减少转移时的损失,可用少量水冲洗量筒,倒入恒压漏斗中,同时还可降低其熔点,以免堵住漏斗。
六、思考与分析
1.加料时,量过环己醇的量筒能否直接用来量取50%的硝酸?
2.量过环己醇的量筒为何要加少量温水洗涤?并且要将此洗液倒入加料用的恒压漏斗中?
3.用环己醇氧化制备己二酸时,为什么要在回流冷凝管的上端接气体吸收装置?吸收此尾气是用水好,还是用碱液好?
4.为什么有些实验在加入最后一种物料之前,都要先加热前面的物料(如己二酸制备实验中就得先预热到50~60℃)?
5.制备己二酸实验的关键操作是什么?请说明其原因。
6.制备己二酸时,应该如何控制反应温度?
7.用硝酸法制备己二酸时,为什么要用50%的硝酸而不是用71%的浓硝酸?
8.反应完毕后,为什么要趁热倒出反应液?抽滤后得到的滤饼为何要用冰水洗涤?
9.用5.3mL的环己醇加16mL的50%的硝酸制备己二酸,试计算其理论产量(98%的环己醇的比重为0.9624,50%的硝酸的比重为1.31)。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




