一、实验目的
(1)掌握实验室制备乙醚的原理和方法。
(2)掌握低沸点易燃液体蒸馏的操作方法。
二、实验原理
主反应:
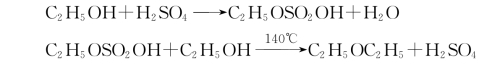
总式:
![]()
副反应:
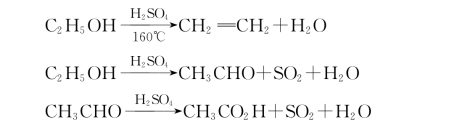
可见反应温度不同,所得产物不同,而且温度越高,浓硫酸的氧化能力就越强,醇被氧化,副反应就加剧。所以,本实验的操作关键是严格控制反应温度在135~145℃之间。
三、仪器与试剂
1.实验仪器
三颈烧瓶(100mL),圆底烧瓶(50mL两个),温度计(0~200℃),滴液漏斗(60mL),蒸馏烧瓶(125mL),锥形瓶,三角漏斗,水浴锅,蒸馏头,直形冷凝管,接引管。
2.实验药品
95%的乙醇38mL(30g,0.63mol),浓硫酸12mL,5%的NaOH溶液8mL,饱和NaCl溶液8mL,饱和CaCl2溶液16mL,无水CaCl2(1.0~2.0)g。
3.实验装置图
实验装置如图3-4所示。
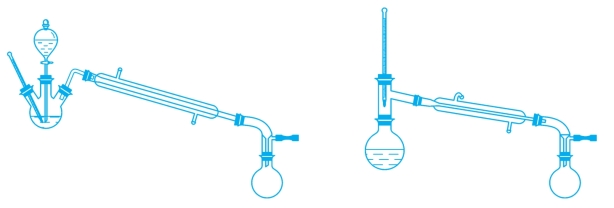
图3-4 乙醚的制备装置图
四、实验步骤
(1)在干燥的三颈烧瓶中放入13mL的95%的乙醇,分批加入12mL的浓硫酸(至少分4次加完),边加边用冰水冷却。(https://www.xing528.com)
(2)在滴液漏斗中放入25mL的95%的乙醇,然后按实验装置图装好仪器,接受瓶置于冰水浴中。
(3)加热,使反应温度比较迅速地上升到135℃。然后慢慢滴加乙醇,控制滴加速度使其与馏出速度相等(约为1~2d/s),并维持反应温度在135~145℃之间。
(4)滴加完毕,继续加热,直至温度上升至160℃时,撤掉热源冷却。
(5)馏出液转入分液漏斗中,依次用8mL的5%的NaOH溶液、8mL的饱和NaCl溶液洗涤,再用16mL的饱和CaCl2溶液分两次洗涤,静置,分液。
(6)有机层转入干燥的锥形瓶,加入1~2g无水CaCl2干燥。
(7)过滤,将滤液转入圆底烧瓶,加入沸石。安装蒸馏装置,在热水浴(60℃)中蒸馏,收集33~38℃的馏分,称重,计算产率。
(纯乙醚:b.p.=34.5℃,ρ=0.714,折光率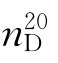 =1.3562)
=1.3562)
五、注意事项
(1)加浓硫酸时应分批加入,边加边振摇,并用冰水冷却。
(2)温度计和滴液漏斗必须插入反应液面以下,距瓶底约0.5~1cm。
(3)保持滴加速度和馏出速度大致相等(1~2d/s)。
(4)制备时蒸馏烧瓶用冰水冷却,并且其支管接一根橡皮管通入下水道;蒸馏时接受瓶用冰水冷却,接液管支管接上一根装有无水CaCl2的普通干燥管。
(5)乙醚易燃,沸点低,严加注意在蒸馏乙醚时,附近不能有火源,装置不能漏气。
(6)蒸馏乙醚时不能蒸干,这是因为乙醚会和空气中的氧气反应生成过氧化物,过氧化物受热分解容易爆炸。
六、思考与分析
1.实验室使用或蒸馏乙醚时,应该注意哪些问题?
2.在制备乙醚时,滴液漏斗的下端若不浸入反应液液面以下,会有什么影响?如果滴液漏斗的下端较短、不能浸入反应液液面下,应该怎么办?
3.在制备乙醚和蒸馏乙醚时,温度计被安装的位置是否相同?为什么?
4.在制备乙醚时,反应温度已高于乙醇的沸点,为什么乙醇不易被蒸馏出?
5.制备乙醚时,为何要控制滴加乙醇的速度?怎样滴加比较合适?
6.在粗制乙醚中有哪些杂质?它们是怎样形成的?实验中可以采取哪些措施将它们一一除去?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




