1.简述萃取的一般原理。
●答 萃取是利用物质在两种不互溶(或微溶)溶剂中的溶解度或分配比不同,来达到分离、提纯或纯化目的的一种操作。
2.如何选择萃取剂?
●答 根据分配定律,用萃取剂从水相中萃取有机物,选择作为萃取剂的有机溶剂时,既要考虑对被萃取物质溶解度大,又要顾及萃取后易于与该物质分离。因此,所选溶剂的沸点最好低一点。一般水溶性较小(极性较小)的物质可用石油醚萃取,水溶性较大(极性较大)的物质可用乙醚萃取,水溶性更大(极性更大)的物质可用乙酸乙酯萃取。
另一类是利用萃取剂能与被萃取有机物起化学反应而达到分离的目的。常用的这类萃取剂有5%的NaOH、5%的Na2CO3或NaHCO3水溶液、稀盐酸和浓硫酸等。碱性萃取剂可以从有机相中萃取出有机酸,或除去溶于有机相的酸性杂质;酸性萃取剂则可以从有机相中萃取出有机碱,或除去溶于有机相的碱性杂质;浓硫酸则可以从饱和烃、卤代烃中除去不饱和烃、醇或醚等。
3.为了提高萃取效率,用同量的溶剂一次萃取好,还是多次萃取好?
●答 根据分配定律,要节省溶剂又提高萃取效率,用同量的溶剂一次萃取不如多次萃取效果好。因为多次萃取后,溶液中所剩下的溶质
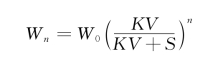
由于上式中KV/(KV+S)恒小于1,因此,n越大,Wn就越小,即:同量溶剂分多次萃取,比一次萃取效果好。但n太大时,则每次所用萃取剂的量S对萃取效率的影响几乎抵销,萃取率增加甚微。通常只萃取3~5次就可以。由于有机溶剂或多或少溶于水,因此,第一次萃取时使用的溶剂量常较以后几次多一些。
4.萃取和洗涤有何区别和联系?
●答 萃取是有机实验中用来提取或纯化有机物的常用操作之一。从混合物中提取所需要的物质,通常称为萃取(或抽提);而从混合物中除去杂质,通常称为洗涤。无论萃取或者洗涤,它们在原理上相同,只是目的不同。萃取操作通常需要比较剧烈的振荡,而洗涤只需要振荡几下就可以。
5.在有机化学实验中,分液漏斗是常规仪器。它有哪些用途?
●答 分液漏斗主要用于:
(1)分离两种分层但不起化学反应的液体。
(2)从溶液中萃取某种成分。
(3)用水或酸或碱洗涤某种产品。
(4)还可以代替滴液漏斗滴加液态物料。
6.简述分液漏斗的使用方法。
●答 使用分液漏斗前应注意以下两点:
(1)检查分液漏斗的玻塞和活塞有没有用橡皮筋绑好。
(2)检查玻塞和活塞是否配套、紧密,是否涂上凡士林。
在活塞表面涂凡士林的方法如下:取下活塞,用纸或干布擦净活塞及活塞孔道,用手蘸取少许凡士林,先在活塞近把手的一端,抹上一薄层凡士林(注意不要抹在活塞孔中),再在活塞孔道两边,也抹上一圈薄薄的凡士林。套上活塞,逆时针旋转直至透明为止。注意玻塞不能涂凡士林。
使用分液漏斗时应注意以下5点:
(1)不能把活塞上附有凡士林、橡皮筋的分液漏斗放进烘箱内烘烤。
(2)不能用手拿分液漏斗的下端。
(3)不能用手拿住分液漏斗进行分离液体。
(4)玻塞开启后,才能旋开活塞。
(5)上层液体只能从分液漏斗上口倒出。
分液漏斗使用后应注意以下两点:
(1)应用水冲洗干净。
(2)玻塞和活塞要用薄纸包好或垫上小纸条塞回去,以防黏住(特别是用过碱后)。
7.滴液漏斗和分液漏斗在应用上有何异同?
●答 滴液漏斗形状与分液漏斗相似(有球形、梨形、筒形),但主要用来滴加物料。用滴液漏斗加料,易于控制滴加速度,也便于观察,而用分液漏斗加料时就不具备此优点。分液漏斗可以用来萃取和洗涤产品,而用滴液漏斗就不好操作。滴液漏斗在使用时应注意的事项与分液漏斗相同。(https://www.xing528.com)
8.萃取时分液漏斗应该如何操作?
●答 萃取时分液漏斗的具体操作如下:
(1)先将分液漏斗置于铁架台的铁圈中,关闭活塞,向分液漏斗中加入液体,然后盖紧玻塞。
(2)取下分液漏斗振摇,使两层液体充分接触,并在振摇过程中不时放气,以平衡内外压力。振摇时,右手握住漏斗上口径部,并用食指和中指夹住或掌心顶住玻塞,以防玻塞松脱。左手托住分液漏斗,大拇指、食指按住处于上方的活塞把手,漏斗颈向上倾斜30~40°。两手振摇几分钟后,把漏斗颈朝上,旋开活塞放气,使内外气压平衡。当漏斗内有低沸点的有机溶剂时,或用碱洗涤酸性物质时,更不允许忽视放气。
(3)关闭活塞,再振摇,如此反复操作多次。
(4)振摇一段时间后,将分液漏斗放回铁圈中静置。
(5)待两层液体界面清晰时,开启玻塞,并把分液漏斗下端靠贴在接受器壁上,缓缓旋开活塞放出下层液体(放液应先快后慢,当界面临近活塞时,关闭活塞,稍加振摇,使黏附在漏斗壁上的液体下沉。静置片刻,下层液体会增多,再将下层液体慢慢放掉)。当最后一点液体刚通过活塞孔时,关闭活塞。
(6)待颈部液体放完后,将上层液体从上口倒入另一容器内。
注意 无论是萃取或是洗涤,上、下层液体都要保留至实验结束。否则,一旦出现操作失误,就无法补救。
9.萃取时常会出现乳化现象,这是怎么产生的?用什么方法可以破坏乳化液?
●答 产生乳化的原因如下:
(1)当溶液呈碱性时。
(2)存在少量轻质沉淀。
(3)溶剂间部分溶解。
(4)两液相的相对密度相差太小。
破坏乳化的方法如下:
(1)较长时间的静置。
(2)若溶液呈碱性,可加少量稀酸。
(3)加少量的电解质(如食盐),利用盐析原理破坏乳化。
(4)有时可加少量乙醇或其他第三种溶剂以增大水相的比重。
此外,还可以改变操作方法:用右手按住分液漏斗上端的玻塞,左手挡住下端的活塞,平放漏斗,作前后振摇数次。然后,斜置漏斗使下端朝上,放开活塞,放气,静置一段时间后使其分层。
10.有哪些影响萃取效率的因素?
●答 影响萃取效率的因素如下:①萃取剂的选择与用量;②萃取次数的多少;③振摇是否充分;④分离是否彻底。
11.有一组同学用乙醚萃取水中的醋酸(VH2O∶VHOAC=19∶1),结果如表2-3所示。回答下列问题:
(1)通过计算完成表2-3。
●答 计算结果如下表所示。
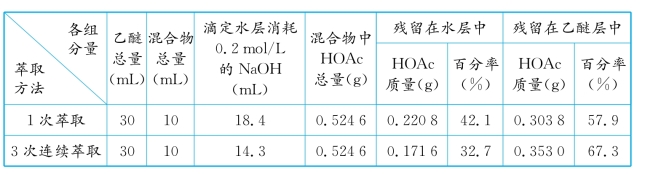
(2)由计算结果可以得出什么结论?
●答 从计算结果可见,用同量的萃取剂,分多次萃取要比一次效果好。
(3)欲将萃取后的乙醚-醋酸分离,可以采取什么方法?(醋酸的比重为1.0492;醋酸的沸点为118.0℃;乙醚的沸点为34.6℃。)
●答 由于乙醚的沸点与醋酸的沸点相差较大,故可通过常压蒸馏使它们分离。蒸出乙醚后,蒸馏烧瓶中剩下的就是醋酸。
但应注意的是:①乙醚是低沸点易燃物,所用热源应该是热水浴或低温电热套;②应该用带支的接液管或带支的接受器,支管口接橡皮管通入水槽或室外;③接受器应置于冰水浴中冷却;④蒸馏时,应熄灭邻近的明火。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




