1.干燥剂的选择
常用干燥剂的种类很多,选用时必须注意下列3点:
(1)干燥剂与被干燥物不发生化学变化。
(2)干燥剂应不溶于有机液体中,且使用后易与被干燥物完全分离。
(3)干燥剂的干燥速度快,吸水量大,价格便宜。
2.干燥剂的吸水容量和干燥效能
吸水容量是指单位重量干燥剂吸水量的多少,干燥效能是指达到平衡时液体被干燥的程度。对于形成水合物的无机盐干燥剂,常用吸水后结晶水的蒸气压来表示其干燥效能。蒸气压越小,相应干燥剂的干燥效能也就越好。例如,无水Na2SO4可形成Na2SO4·10H2O,即1g的Na2SO4最多能吸1.27g的水,其吸水容量为1.27,但其水合物的水蒸气压也较大(25℃时为0.26kPa)。CaCl2能形成CaCl2·6H2O,其吸水容量为0.97,此水合物在25℃时水蒸气压为0.04kPa。因此,无水Na2SO4的吸水量较大,但干燥效能弱,而无水CaCl2的吸水容量虽然较小,但干燥效能强。干燥操作时,应根据除去水分的具体要求而选择合适的干燥剂。有时对含水较多的体系,常先用吸水量大的干燥剂干燥,然后再用干燥效能强的干燥剂。通常这类干燥剂形成水化物需要一定的平衡时间,所以,加入干燥剂后必须放置一段时间才能达到脱水效果。
常用干燥剂的性能与适用范围如表1-5所示。
表1-5 常用干燥剂的性能与适用范围
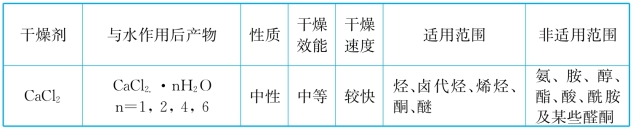
续表
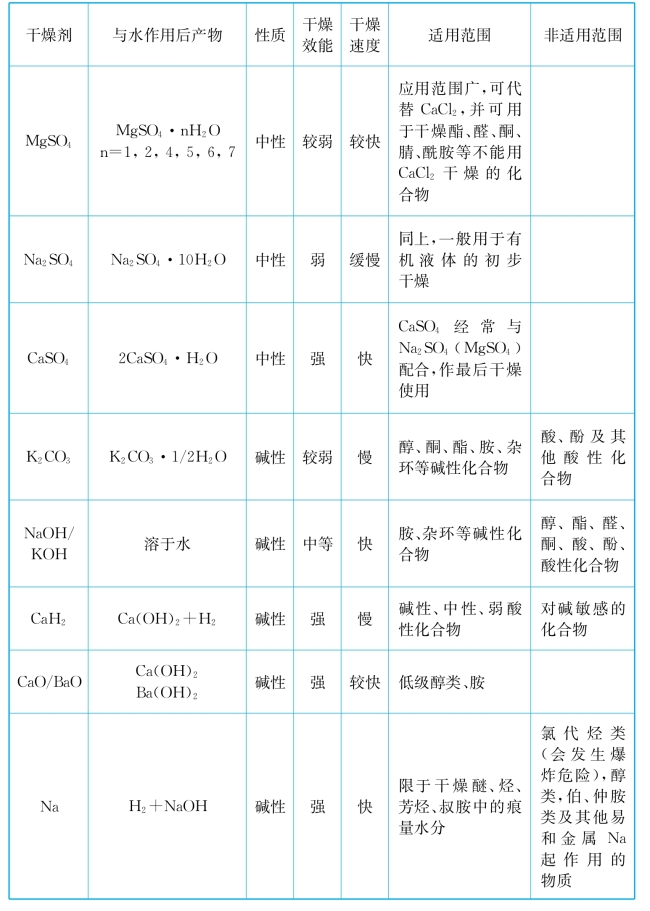 (https://www.xing528.com)
(https://www.xing528.com)
续表
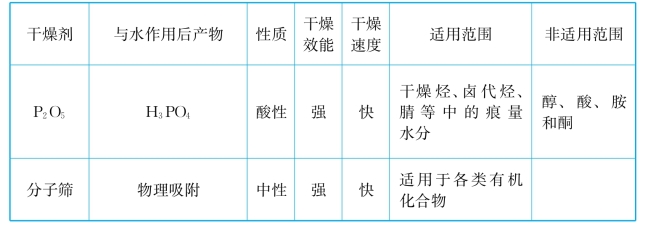
3.干燥剂的用量
掌握好干燥剂的用量十分重要。若用量不足,则不可能达到干燥的目的;若用量太多,则会由于干燥剂的吸附而造成液体的损失。以乙醚为例,水在乙醚中的溶解度在室温时为1%~1.5%,若用无水CaCl2来干燥100mL含水的乙醚时,全部转变成CaCl2·6H2O,其吸水容量为0.97,也就是说,1g的无水CaCl2大约可吸收0.97g的水,这样,无水CaCl2的理论用量至少为1g,而实际上其用量远远超过1g,这是因为醚层中还有悬浮的微细水滴,其次形成高水合物的时间很长,往往不可能达到应有的吸水容量,故实际投入的无水CaCl2的量是大大过量的,常需用7~10g的无水CaCl2。操作时,一般投入少量干燥剂到液体中,进行振摇,如出现干燥剂附着器壁或相互黏结时,则说明干燥剂用量不够,应再添加干燥剂;如投入干燥剂后出现水相,必须用吸管把水吸出,然后再添加新的干燥剂。
干燥前,液体呈浑浊状,经干燥后变成澄清,这可简单地作为水分基本除去的标志。一般干燥剂的用量为每10mL液体约需0.5~1g。由于含水量不等、干燥剂质量的差异、干燥剂的颗粒大小和干燥时的温度不同等因素,较难规定具体数量,上述数量仅供参考。
4.液态有机化合物干燥的操作
液态有机化合物的干燥操作一般在干燥的锥形瓶中进行。把按照条件选定的干燥剂投入液体里,塞紧(用金属钠作干燥剂时则例外,此时塞中应插入一个无水CaCl2管,使H2放空而水气不致进入),振荡片刻,静置一段时间,使所有的水分全被吸去。如果水分太多,或干燥剂用量太少,致使部分干燥剂溶解于水时,可将干燥剂滤出,用吸管吸出水层,再加入新的干燥剂,放置一定时间,并时时加以振摇,再通过过滤将液体与干燥剂分离,进行蒸馏精制。
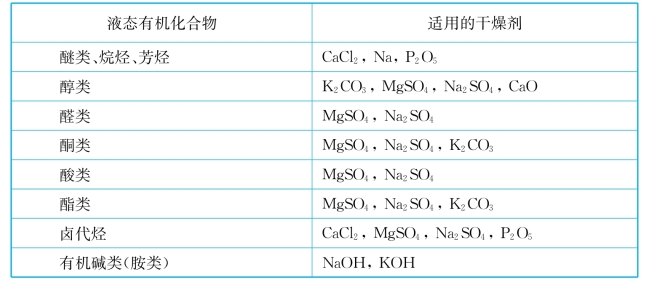
各类液态有机化合物的适用干燥剂如表1-6所示。
表1-6 各类液态有机化合物的适用干燥剂
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




