由于海岸带特殊的地理位置和环境,海岸带动物蛋白质和多肽无论是在氨基酸组成上还是在氨基酸序列上,均与陆生动物和深海动物蛋白有很大的不同。根据结构决定性质的原理,可以推测海岸带动物蛋白及多肽可表现出不同的性质和生理活性,这将大大有利于其在食品、化妆品、医药、生物材料等领域的应用。目前已有多种海岸带动物蛋白质及多肽在人们的生活中得到了应用,如胶原多肽已被开发成多种保健食品,得到了消费者的广泛认可;还有一些肽类毒素被开发成神经系统、心血管系统疾病治疗的特效药。本节将对目前研究深入、应用广泛的海岸带动物蛋白及多肽进行系统介绍。
一、动物活性蛋白质
目前已从海岸带多种动物中获得具有不同生理活性的蛋白质,主要是胶原蛋白和一些糖蛋白。如已对草鱼(Zhang等,2007)、日本鲽鱼和琥珀鱼(Nishimoto等,2005;Nishimoto等,2004)、竹荚鱼鳞(Thuy等,2014)、史氏鲟鱼皮(Wang等,2014a)、鲶鱼皮(Singh等,2011)、旗鱼皮(Tamilmozhi等,2013)、扇贝外套膜(Shen等,2007)、鱿鱼表皮(Veeruraj等,2015)、海蜇(Zhang等,2014)等胶原蛋白进行了大量研究;对海蜇、文蛤、皱纹盘鲍、马氏珍珠贝糖蛋白也进行了一些研究。针对目前的研究现状,后续内容将从来源、结构、生理活性、应用等方面对海岸带动物活性蛋白进行介绍。
(一)胶原蛋白
胶原蛋白是动物组织中的一类结构蛋白,约占总蛋白量的1/3,广泛分布于动物的皮肤、骨骼、软骨、结缔组织、腱、角膜、内脏细胞间质、肌腔、韧带、巩膜等部位(蒋挺大,2006)。正是由于它的存在,动物组织才具有一定的结构和张力强度、拉力、黏弹性等机械力学性质,达到支撑器官、保护机体的功能。胶原蛋白在食品、化妆品、生物材料、组织工程等领域均有非常广泛的应用。变性胶原蛋白,俗称明胶,可作为稳定剂、增稠剂、黏合剂和发泡剂应用于食品生产,提高食品的弹性、黏度和稳定性等(Montero&Gómez-Guillén,2000)。它还是化妆品中一种具有良好保湿性的天然材料(Swatschek等,2002)。胶原蛋白具有良好的生物相容性和可降解性,有利于细胞附着、增殖和分化,可应用于生物材料和组织工程领域。
传统意义上,胶原蛋白主要来源于猪和牛等陆生哺乳动物。但是近年来,由于疯牛病、口蹄疫的频发以及宗教原因,水生生物胶原蛋白逐渐受到人们的关注。海岸带鱼类胶原蛋白也是水生生物胶原蛋白中的一类。由于海岸带鱼类的生活环境与陆生动物和深海动物均不同,所以海岸带鱼类胶原蛋白是一类既不同于陆生哺乳动物胶原蛋白,也不同于深海鱼类胶原蛋白的一类蛋白质,在结构和性质上具有若干特异性,大大增加了人们的研究兴趣。
1.来源
鱼类是一个品种多样、资源丰富的物种,它们几乎栖居于地球上所有的水生环境——从淡水的湖泊、河流到咸水的大海和大洋。根据已故加拿大学者Nelson(1994)的统计,全球现生种鱼类占已命名脊椎动物一半以上,且新种鱼类不断被发现。此处所说的海岸带鱼类是除深海鱼类(鳕鱼、鲨鱼、金枪鱼、鮟鱇鱼、鳗鱼等)以外的所有鱼类,包括浅海鱼类、淡水鱼类、海水淡水交汇鱼类,洄游鱼类也包括在内。鱼类食用价值极高,营养丰富,鱼肉富含动物蛋白质和磷脂等,易被人体消化吸收,并且具有较好的医疗保健作用和较高的药用价值。胶原蛋白主要存在于鱼皮、鱼骨、鱼鳞、鱼鳍和鱼鳔等部位。传统加工上这些部位大多被丢弃,造成环境污染和资源的浪费。现在,人们已经认识到在这些下脚料中含有丰富的胶原蛋白。如罗非鱼皮粗蛋白含量高达33.14%,其中胶原蛋白含量为27.8%,占粗蛋白的83.9%(叶小燕等,2008);林琳(2006)测定发现鱿鱼皮和鲤鱼皮胶原蛋白含量分别占总蛋白含量的74.7%和70.2%。目前鱼类加工下脚料是重要的胶原蛋白来源。近年来,科研工作者对许多鱼类胶原蛋白的结构、功能、构效关系和应用进行了全面研究,取得了一定的研究成果。
无脊椎动物也是胶原蛋白重要的来源。无脊椎动物种类繁多,生活范围极广,在海水、淡水和陆地均有生活,主要包括章鱼、乌贼、枪乌贼、鲍鱼、贝类、海参和海蜇等(图4-3)。枪乌贼表皮和海参体壁经切片和Van-Gieson染色后胶原纤维分布见图4-4(a)和(b),可以发现其中均含有大量的红色胶原纤维。由无脊椎动物制备的胶原蛋白在结构和性质上不仅与陆生哺乳动物胶原蛋白有差异,而且与鱼类来源的胶原蛋白也不同。对于这些物种来源的胶原蛋白的结构、性质、性能将在后续的介绍中详细说明。

图4-3 部分无脊椎动物的外观形态
(a)鲍鱼 (b)珍珠贝 (c)枪乌贼 (d)海参 (e)海蜇
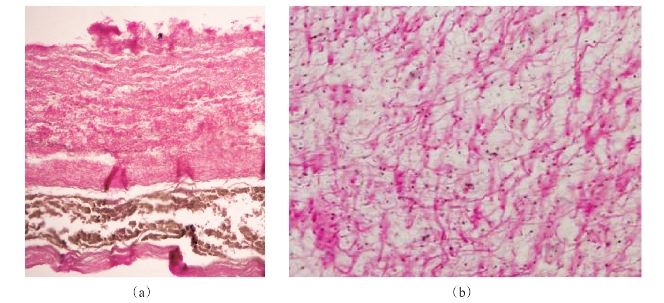
图4-4 胶原纤维分布
(a)枪乌贼表皮(b)海参体壁
Van-Gieson染色(×20)(Yan等,2009;侯虎等,2013)
2.制备、分离及纯化
(1)制备方法:胶原蛋白是一种纤维状蛋白,溶解性较差。1900年法国研究人员发现胶原蛋白可溶于稀醋酸,之后,经过人们的不断研究,发现胶原蛋白在多种不同的pH和盐浓度的提取介质中均可溶解。目前,胶原蛋白的制备技术已日趋成熟,现有技术已能够适应不同原料胶原的制备。迄今为止,依据提取介质的不同,胶原蛋白的提取方法可分为以下五类,即酸提取法、碱提取法、酶解提取法、中性盐提取法以及热水提取法等。基本原理均是改变胶原蛋白所在的外界环境,使胶原蛋白与其他蛋白质分离开来(毕琳,2006;闫鸣艳,2009)。
①酸提取法。酸提取法是利用一定浓度的酸溶液提取胶原蛋白,主要采用低离子浓度酸性条件破坏分子间的盐键和希夫碱,引起纤维膨胀、溶解。采用酸提取法提取的胶原蛋白通常称为酸溶性胶原蛋白(Acid-solubilized Collagen,ASC)。酸提取法主要是将没有交联的胶原蛋白分子完全溶解出来,同时也可以溶解含有醛胺类交联键的胶原纤维(余海等,2000)。作为提取介质使用的酸主要包括醋酸、盐酸、柠檬酸、乳酸和甲酸等。叶韬等用柠檬酸、乙酸和乳酸提取罗非鱼骨胶原蛋白,使用pH为2.6的乳酸为介质时,胶原蛋白的提取率最高,其次是pH为2.0的乙酸介质,柠檬酸的提取率最低(叶韬等,2015)。目前,酸提取法是使用比较多的制备胶原蛋白的方法,该法能够最大限度地保持胶原蛋白的天然结构。
②碱提取法。碱提取法是利用碱在一定的外界环境条件下提取胶原蛋白。然而,在碱性条件下处理,易造成胶原蛋白的肽键水解。若水解严重,则会产生DL-型氨基酸消旋混合物,其中D-型氨基酸若高过L-型氨基酸,则会抑制L-型氨基酸的吸收,有些D-型氨基酸有毒,甚至具有致癌、致畸和致突变作用(毕琳,2006)。因此,迄今为止,有关使用该法提取胶原蛋白的报道较少。温慧芳等(2007)采用Ca(OH)2溶液提取鮰鱼皮胶原蛋白,最高提取率可达79.67%。
③酶解提取法。酶解提取法即是利用中性蛋白酶、木瓜蛋白酶、胰蛋白酶和胃蛋白酶等各种蛋白酶在一定的外界环境条件下提取胶原蛋白,这是目前胶原蛋白提取方法中使用最广泛的方法,用该法提取的胶原蛋白通常称为酶促溶性胶原蛋白(Pepsinsolubilized Collagen,PSC)。其中,胃蛋白酶是最常用的蛋白酶。用该酶提取胶原蛋白具有水解反应快、无环境污染、提取的胶原蛋白纯度高、溶解性好、理化性质稳定等特点。在提取过程中,胃蛋白酶催化胶原蛋白非螺旋区的端肽,但是对螺旋区没有作用,这样胶原蛋白仍然保持完整的三螺旋结构,但抗原性却降低了,这也是酶促溶性胶原蛋白和酸溶性胶原蛋白的主要区别,因此用酶解提取法制备的胶原蛋白更适合于作为医用生物材料。王川等(2007)比较研究了采用胰蛋白酶、木瓜蛋白酶和胃蛋白酶从猪皮中提取胶原蛋白,发现采用胰蛋白酶提取胶原蛋白得率最高,但结构破坏较为严重,用胃蛋白酶提取的胶原蛋白的结构保存最为完整,但是得率最低。对于水产胶原蛋白的提取,胃蛋白酶法也得到广泛的认可,国内外研究报道也很多,如草鱼皮(Zhang等,2007)、鱿鱼表皮(Veeruraj等,2015)、旗鱼皮(Tamilmozhi等,2013)等胶原蛋白均可用胃蛋白酶法提取。
④中性盐提取法。中性盐提取法是利用氯化钠、氯化钾、乙酸钠、盐酸-三羟甲基氨基甲烷等各种不同的盐在一定的外界环境条件下提取盐溶性胶原蛋白。在中性条件下,采用盐浓度为0.15~1.00mol/L提取胶原蛋白比较合适,如果盐浓度太低,胶原蛋白是不易溶解的。Kolodziejska等(1999)研究了采用浓度为5%~15%的NaCl溶液在0℃下提取了鱿鱼皮胶原蛋白的方法,确定了一个提取无色无味可溶性胶原蛋白的工艺流程。中性盐法提取胶原蛋白的研究较少,通常情况下,该法主要用于对提取的胶原蛋白进行盐析处理,以沉淀出不同类型的胶原蛋白(Nagai&Suzuki,2000),采用的中性盐主要是氯化钠和硫酸铵。Shen等(2007)通过NaCl分级盐析的方法得到了扇贝外套膜胶原蛋白的主要成分和微量成分,经鉴定类似于哺乳动物的Ⅰ型和Ⅴ型胶原蛋白。还有研究通过硫酸铵分级沉淀法成功将日本鲽鱼和日本琥珀鱼Ⅰ型和Ⅴ型胶原蛋白分离开来(Nishimoto等,2005;Nishimoto等,2004)。
⑤热水提取法。胶原蛋白不溶于冷水,但是在热水中溶解度明显提高。利用这一性质可以得到水溶性胶原蛋白,但是用该法得到的胶原蛋白天然结构已被破坏,所得胶原蛋白一般被称为明胶。潘杨(2008)采用80℃的水提温度、水提时间5h、水提2次的方法提取了鲢鱼鱼鳞明胶,所得明胶纯度较高,品质良好,明胶强度达到1609.4g,黏度达到20.58mPa·s。肖枫等(2013)采用超声辅助热水法提取黄河鲤鱼鱼鳞明胶,其最佳工艺参数为,提取温度70℃,超声时间100min,超声功率300W,液料比10∶1(ml/g),在此条件下明胶得率达64.18%。
在实际过程中,胶原蛋白的提取大多是多种方法相结合。基本步骤是把动物组织浸泡在合适的溶剂中,经过一定时间后离心除去不溶性组分,加入中性盐使蛋白沉淀出来,最后通过离心、透析除盐、冷冻干燥等方法得到胶原蛋白。利用该方法已成功得到罗非鱼、草鱼、鲤鱼、尼罗河鲈鱼、斑点叉尾鮰鱼等鱼胶原蛋白。Tang等(2015)制备罗非鱼、草鱼和鲤鱼胶原蛋白的具体方法如下:将鱼皮用10%正丁醇脱脂36h,每12h更换一次溶液,料液比为1∶10;脱脂鱼皮在浓度为0.1mol/L的NaOH水溶液中浸泡36h(1∶10W/W)以除去非胶原成分,每12h更换一次溶液,然后水洗至中性;加入浓度为0.5mol/L的醋酸溶液(1∶30W/W)匀浆,4℃磁力搅拌萃取48h,10000r/min离心30min,收集沉淀,上清液即为酸溶性胶原蛋白(Acid-soluble collagen,ASC)。在上清液中加入NaCl至最终C(NaCl)=0.9mol/L,离心,收集沉淀溶于0.5mol/L醋酸溶液中,用0.1mol/L醋酸溶液透析1d,再用蒸馏水透析2d,冻干得鱼皮酸溶性胶原蛋白。将所得沉淀继续用浓度为0.5mol/L的醋酸溶液4℃下提取48h,同时加入0.5%的胃蛋白酶,经离心、透析、冻干得鱼皮酶促溶性胶原蛋白(Pepsin-soluble collagen, PSC)。具体制备工艺流程如图4-5。

图4-5 鱼皮胶原蛋白的酸提取法和酶提取法制备工艺流程
(Tang等,2015)
(2)分离纯化方法:要开发高附加值的胶原蛋白产品,深入了解胶原蛋白的特性,必然会涉及胶原蛋白的分离纯化工作,最终目标是提高胶原蛋白的纯度,使之满足不同领域的要求。胶原蛋白所含有的杂质主要包括两部分:一部分是在粗提过程中,部分胶原的三螺旋结构被破坏而产生的小分子;另一部分是其中可能混有与其有特异亲和性的酸性糖蛋白和蛋白聚糖等杂质。胶原蛋白分离纯化的方法主要基于蛋白质在溶解度、带电荷性、相对分子质量大小、吸附性质、亲和特异性等方面的差异而选择的。目前最常用的方法是透析和超滤、色谱法和电泳技术等。
①透析与超滤。胶原蛋白在提取的过程中需要用到盐析的方法,因而在其中会引入大量的盐离子。为了提高胶原蛋白的品质,必须将其中大量的盐离子除去,采用透析的方法可达到此目的。透析是将胶原蛋白溶液装在半透膜的透析袋里,放在蒸馏水或其他介质中,其中的无机盐等小分子通过透析袋扩散入介质中而除去。在由鱼皮、鱼鳞等制备胶原蛋白的过程中多用到透析的方法进行脱盐(图4-6)。

图4-6 胶原蛋白透析处理
(中国科学院海岸带研究所生物学与生物资源利用重点实验室)
超滤是基于筛分原理即膜孔尺寸的大小对不同大小物质进行分离、浓缩的方法(金桂芬,2008)。由于操作简便、环境温和、容易保持生物大分子的活性等特点,所以在蛋白质分离方面具有独特的优势。石红旗(2006)用超滤的方法分离浓缩了海蜇胶原蛋白,得到分子量在10万~30万的胶原蛋白,截留率为95%~98%;该方法还可有效回收蛋白酶,使反应体系循环利用。金桂芬(2008)探讨了超滤时的操作压力和时间对超滤膜渗透通量、透过液pH、透过液电导率、截流量的影响,以此为基础构建了数学模型,用于指导海蜇胶原蛋白的超滤纯化。
②色谱法。用于胶原蛋白分离纯化的色谱方法主要包括离子交换色谱法、凝胶色谱法和高效液相色谱法。离子交换色谱法是利用胶原蛋白与离子交换剂的静电作用,以适当的溶剂作为洗脱液,使离子交换剂表面的可交换离子与带相同电荷的胶原蛋白交换,从而进行分离。常用于胶原蛋白纯化的离子交换剂有弱酸性的羧甲基纤维素(CM-纤维素)和弱碱性的二乙基氨基乙基纤维素(DEAE-纤维素)。前者为阳离子交换剂,后者为阴离子交换剂。胶原蛋白分子是两性聚电解质,在等电点处分子的净电荷为0,与交换剂之间没有电荷相互作用。当体系的pH在其等电点以上时,分子带负电荷,可结合在阳离子交换剂上;当体系的pH在其等电点以下时,分子带正电荷,可结合在阴离子交换剂上。对离子交换剂结合力最小的蛋白质,首先由层析柱中洗脱出来。在胶原蛋白的研究中,DEAE-纤维素柱色谱是除去胶原中所混杂的其他蛋白多糖的有效方法;CM-纤维素柱色谱则可以用于不同的胶原类型及其组成的多肽链的分离。Sato(2003)使用DEAE-纤维素柱和Bakerbond WP-CSX柱纯化猪肠内结缔组织Ⅴ型胶原蛋白。Kimura(1981)用CM-纤维素柱和Sepharose CL-4B凝胶柱纯化得到了章鱼皮胶原蛋白α1和α2亚基。
凝胶色谱法是体积排阻色谱中典型的一种,主要是依据多孔的载体(常用葡聚糖凝胶和琼脂糖凝胶)对不同体积、不同形状和不同分子量的物质排阻能力不同,从而使混合物达到分离的目的(蒋挺大,2006)。不同分子量的蛋白质混合物借助重力通过层析柱时,比“网孔”大的蛋白质分子不能进入凝胶颗粒的网格内,被排阻在凝胶颗粒之外,随着洗脱剂通过凝胶粒外围而流出;比“网孔”小的分子则扩散进入凝胶粒内部,然后再可逆地扩散出来通过下层凝胶。凝胶过滤色谱是对胶原蛋白进行分级和测定胶原蛋白分子量及其分布的良好方法。崔凤霞等(2007)采用Sephacryl S-300HR凝胶柱分离了海参体壁胶原蛋白的α亚基,确定该胶原蛋白由三个相同的α亚基组成。
若对胶原蛋白纯度要求非常高,多使用高效液相色谱法,但是目前在胶原蛋白的分离、纯化方面使用不多。王琳等(2004)通过高效液相色谱法分离得到了高纯度且具有良好生物安全性的猪皮Ⅰ型胶原蛋白。
③电泳法。胶原蛋白的分离纯化还可使用电泳法,主要是聚丙烯酰胺凝胶电泳法。该方法具有较高的分辨率和灵活性,因而在蛋白质分离纯化中较常使用。基本原理是,聚丙烯酰胺凝胶是由单体丙烯酰胺和少量交联剂甲叉双丙烯酰胺在催化剂作用下,聚合交联而成的具有三维网状结构的凝胶。凝胶的孔径可以通过调控单体和交联剂的浓度来实现,以迎合不同分离的需要(张洪渊,2006)。电泳法多用于胶原蛋白亚基的分离,之后可通过蛋白酶法回收,用于进行肽质量指纹图谱等分析。图4-7为利用SDS-PAGE电泳法分离了罗非鱼皮胶原蛋白的α和β亚基,并且可以清楚地看出亚基是否发生了降解。从图中可以明显地看出,酶促溶性胶原蛋白和35℃、45℃热水提取的罗非鱼皮胶原蛋白发生了部分降解。

图4-7 罗非鱼皮胶原蛋白SDS-PAGE电泳图
(Yan等,2015)
1.蛋白标准 2.45℃热水提取胶原蛋白 3.35℃热水提取胶原蛋白
4.25℃热水提取胶原蛋白 5.酶促溶性胶原蛋白 6.酸溶性胶原蛋白
3.分类
胶原蛋白是细胞外基质的重要组成部分。随着分子生物学、生物化学和细胞生物学等不同学科的发展,现在已经肯定胶原蛋白并不是一个蛋白质的总称,而是富有多样性和组织分布特异性的,是与各组织、器官机能密切相关的功能性蛋白(李昀,2005)。迄今为止,已发现了27种不同类型的胶原蛋白(Pace等,2003),彼此间从分子遗传学到分子结构均不相同,其主要类型及分布如表4-2。不同类型胶原蛋白的主要区别在于分子中非螺旋部位的范围和分布,这决定整体蛋白质的易变性和生物物理特性。
按照功能可将胶原蛋白分为两组,第一组是成纤维胶原,包括Ⅰ,Ⅱ,Ⅲ,Ⅴ,Ⅺ,ⅩⅩⅣ和ⅩⅩⅦ型胶原,占胶原家族的90%;其余是第二组,为非成纤维胶原。不同类型的胶原蛋白在动物组织中发挥的作用是不同的,其中Ⅰ型胶原在动物体内含量最高,是主要的胶原蛋白类型,占胶原总量的80%以上。通常所说的胶原的结构、性质、功能等均是针对Ⅰ型胶原来说的。单个的Ⅰ型胶原分子分子量约为28.5万,宽1.5nm,长约300nm,由三条多肽链组成(王碧等,2001)。它是一种成纤维胶原,能促进细胞的活化和增殖,是皮肤、骨骼的重要组成部分,若缺失易导致皮肤松弛、骨骼力学性能差等多方面问题。
表4-2 不同类型胶原蛋白的组成及组织分布(Gelse等,2003)

现在研究发现水产的胶原蛋白多为Ⅰ型和Ⅴ型胶原蛋白(Yata等,2001),其中Ⅰ型被认为是主要的胶原蛋白,Ⅴ型为微量胶原蛋白。Ⅴ型胶原蛋白分布在细胞周围及Ⅰ型胶原蛋白的周围,似乎担负黏接作用,已从数种鱼类肌肉中分离出来,是一种含量只有Ⅰ型胶原蛋白数量的百分之几的微量成分(鸿巢章二,1992)。Nishimoto等(2004)对日本琥珀鱼皮酶促溶胶原蛋白通过硫酸铵分级沉淀后得到两部分物质,经鉴定分别为Ⅰ型和Ⅴ型胶原蛋白。另外,在日本比目鱼皮(Nishimoto等,2005)、扇贝外套膜(Shen等,2007)、史氏鲟鱼皮(Wang,等,2014)等胶原蛋白中都存在Ⅰ型和Ⅴ型。此外,海岸带动物组织中也存在一些其他类型的胶原蛋白,特别是一些非脊椎动物组织。Mizuta等研究发现海鞘肌内层中含有AS-Ⅰ和AS-Ⅱ型胶原蛋白,分别类似于脊椎动物的Ⅰ型和Ⅴ型胶原蛋白(Mizuta等,2002a)。
不同类型的胶原蛋白均是由单个亚基组成,称之为α亚基。目前,水产胶原蛋白的亚基组成研究主要集中于Ⅰ型胶原蛋白的研究上。就研究结果来说,不同来源的Ⅰ型胶原蛋白的亚基组成也是不同的。大多数的硬骨鱼类胶原蛋白含有三条不同的α链,即由三条异种α链形成的单一型杂分子α1α2α3组成(Kimura,1992),而非(α1)2α2,这不同于哺乳动物胶原蛋白仅含有两条α链(Liu等,2007)。对于无脊椎动物胶原蛋白,如章鱼皮(Kimura等,1981)及海胆(Omura等,1996)胶原蛋白的亚基组成均为(α1)2α2,与陆生哺乳动物类似。此外,一些胶原蛋白中还可能存在α4及α5等亚基,如面蜇中胶层胶原蛋白由四个亚基组成,即α1α2α3α4(Nagai等,2000)。
4.组成和结构
(1)组成:蛋白质的基本组成单位是氨基酸。像所有的蛋白质一样,胶原蛋白分子也是由氨基酸单元相互连接而成的,氨基酸组成有如下特征(蒋挺大,2006):
①甘氨酸残基几乎占总氨基酸残基的1/3,即每隔两个氨基酸残基(X-Y)即有一个甘氨酸残基,所以其肽链可用(Gly-X-Y)n来表示。
②胶原蛋白中缺乏色氨酸和胱氨酸,所以它在营养上为不完全蛋白质,但也有文献上列出的胶原蛋白氨基酸组成并不缺少这种氨基酸,只是量少而已。
③胶原蛋白中存在羟赖氨酸和羟脯氨酸,通常,在其他蛋白质中不存在羟赖氨酸,也很少有羟脯氨酸的存在。其中羟脯氨酸不是以现成的形式参与胶原的生物合成的,而是由已经合成的胶原肽链中的脯氨酸经羟化酶作用转化而来的。
④绝大多数蛋白质中脯氨酸含量很少,胶原蛋白中脯氨酸及羟脯氨酸的含量是各种蛋白质中最高的。正是由于这两种氨基酸的存在,所以胶原蛋白具有微弹性和很高的拉伸强度。
⑤海岸带动物胶原蛋白的羟脯氨酸的含量比陆地动物低得多,但是比深海动物高。
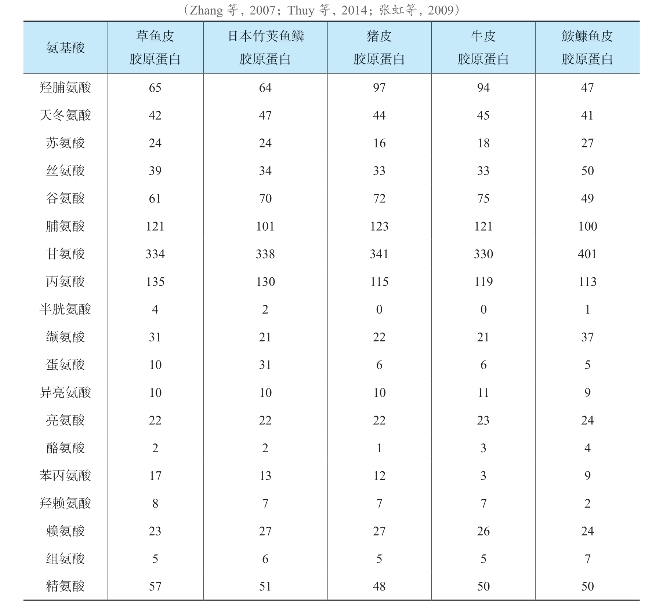
其中,①~④为胶原蛋白氨基酸组成的共同特点,⑤为海岸带动物胶原蛋白氨基酸组成的独有特点。表4-3为通过氨基酸分析仪测定的几种胶原蛋白的氨基酸组成,从中可以明显地看出海岸带动物胶原蛋白的上述氨基酸组成特征。
表4-3 几种胶原蛋白氨基酸组成
在这里需要特别指出的是,羟脯氨酸可以作为胶原蛋白的特征氨基酸,通常原料中胶原蛋白含量的测定即是通过测定羟脯氨酸的含量来实现的。具体测定方法如下(Reddy&Enwemeka, 1996;林琳,2006;闫鸣艳,2009):
1)实验试剂的配制:
a 醋酸-柠檬酸缓冲液(pH6.5):取5g柠檬酸、1.2ml冰醋酸、12g醋酸钠和3.4g氢氧化钠,在蒸馏水中溶解后定容至100ml,调整pH至6.5。
b 3.5mol/L高氯酸溶液:取70%的高氯酸溶液27ml,用蒸馏水定容至100ml。
c 10%对二甲基氨基苯甲醛(P-DMAB)溶液:将10g对二甲基氨基苯甲醛用异丙醇溶解后定容至100ml。
d 氯胺T试剂:将1.4g氯胺T、30ml异丙醇、50ml醋酸-柠檬酸缓冲液和20ml蒸馏水,氯胺T溶解完全后混合均匀。
2)羟脯氨酸标准曲线的绘制:精确称取羟脯氨酸标准品0.100g,用0.001mol/L的盐酸溶解,配制成1mg/ml的羟脯氨酸贮备液,冰箱中保存备用。利用羟脯氨酸贮备液配制不同浓度的羟脯氨酸标准溶液,各取1ml,以0.001mol/L的盐酸溶液作为空白液,在标准溶液和空白液中分别加入2ml氯胺T溶液,混匀后在室温(25℃)下静置20min,然后加入2ml高氯酸溶液,混匀,室温下静置5min,最后加入对二甲基氨基苯甲醛溶液2ml,混匀,在60℃水浴中保温20min进行显色反应,随后置于冷水中冷却。以空白液调零,测定560nm处的吸光度。以吸光度为纵坐标、羟脯氨酸浓度为横坐标绘制标准曲线,确定回归方程。
3)样品中羟脯氨酸含量的测定:取一定量的待测样品置于安瓿瓶中,加入6mol/L盐酸1ml,用酒精喷灯封口后于130℃下水解3h。取出冷却,用蒸馏水定容至10ml,滤纸过滤,取1ml样品溶液按羟脯氨酸标准曲线的测定方法测定待测样品的吸光度。由标准曲线换算出样品液中羟脯氨酸含量,乘以换算系数即得胶原蛋白的含量。一般来说,换算系数依据原料的不同而不同,对于鱿鱼皮、鲤鱼皮和罗非鱼皮,换算系数分别为14.12,9.75和14.70;通常在不确定换算系数的情况下,其值取11.1。
(2)结构:胶原蛋白是一种白色、透明、无分支的原纤维,分子量约为30万。它是由三条左手螺旋的α链缠绕形成的右手螺旋结构(图4-8),正是这一独特结构促使胶原蛋白发挥人体生理功能的。通常构成胶原蛋白的α链包括N-端肽(11~19个氨基酸残基)、三股螺旋区(1014~1029个氨基酸残基)和C-端肽(11~17个氨基酸残基)(Gelse等,2003;崔凤霞,2007)。
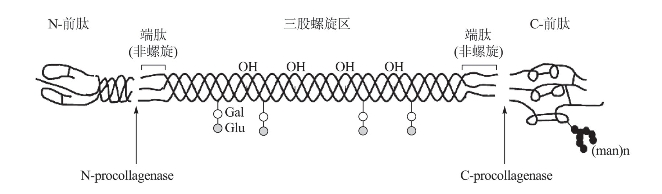
图4-8 胶原蛋白三螺旋结构(Gelse等,2003)
1969年,国际纯粹化学与应用化学联合委员会(IUPAC)决定,将蛋白质的分子结构分为一级、二级、三级和四级(图4-9)。蛋白质的一级结构揭示其中含有多少种氨基酸以及这些氨基酸是怎样排列构成多肽链的。它是由蛋白质基因DNA中的核苷酸序列决定的,因此一级结构是蛋白质分子的基本结构,也是分子生物学研究的重要内容。胶原蛋白一级结构具有不同于其他蛋白质的特点,其最显著的特点是三螺旋结构区域有甘氨酰-脯氨酰-羟脯氨酰、甘氨酰-脯氨酰-Y和甘氨酰-X-Y(X、Y代表除甘氨酰和脯氨酰以外的其他任何氨基酸残基)三肽重复序列存在。这种三肽重复序列决定了胶原蛋白具有“草绳状”三股螺旋结构。

图4-9 胶原蛋白的四级结构示意图(贾鹏翔,2006)
每一种蛋白质分子都有自己特有的氨基酸组成和排列顺序,这种氨基酸排列顺序决定了它特定的空间结构,也就是蛋白质的一级结构决定了它的二级、三级等高级结构(Anfinsen,1973)。胶原蛋白的二级结构是指多肽主链骨架中的若干肽段所形成的规则的空间排列。它是由三条左手螺旋肽链组成的三股螺旋结构,即超螺旋体,其螺距为0.95nm,每一螺圈含有3.3个氨基酸残基;沿着螺旋中心轴,相邻残基间距离为0.29nm(Eyre,1980)。这种超螺旋体与α-螺旋体是不同的。理想的α-螺旋体中,每圈螺旋含有3.6个氨基酸残基(n=0.36),螺距为0.54nm;沿着螺旋中心轴,相邻残基间距离为0.15nm(闫鸣艳,2009)。胶原蛋白的这种超螺旋体二级结构与其一级结构是密切相关的。多肽链中每三个氨基酸残基就有一个要经过三股螺旋中央区,此处空间非常狭窄,只有分子量最小的氨基酸——甘氨酸才适合此位置,这就充分解释了胶原蛋白氨基酸组成中每隔两个氨基酸残基就出现一个甘氨酸的特点。此外,胶原蛋白的三条α-肽链是交错排列的,使得甘氨酸、X和Y残基位于同一水平面上,借助于甘氨酸残基中的N-H基团与相邻肽链上的X残基上的O-H基团形成牢固的氢键,稳定了三螺旋结构(蒋挺大,2006)。
胶原蛋白的三级结构是指胶原蛋白形成胶原微纤维时相互之间的三维空间关系,直径约1.5nm的胶原分子并行排列,通过共价交联形成了胶原微纤维(贾鹏翔,2006)。微纤维规则平行排列成束,首尾错位1/4,通过共价键搭接交联,并进一步聚集成束,形成了胶原纤维,这就是胶原蛋白的四级结构,其对于胶原分子的大小、形状、生物功能等起着决定性的作用。胶原蛋白结构的多样性和复杂性,决定了其在许多领域的重要地位和良好的应用前景。

图4-10 枪乌贼表皮胶原蛋白红外光谱(Yan等,2009)
目前对于水产胶原蛋白结构也进行了一些研究,红外光谱和圆二色谱都可用来分析胶原蛋白的二级结构。图4-10为枪乌贼表皮胶原蛋白红外光谱(Yan等,2009),这是一个典型的Ⅰ型胶原蛋白红外光谱图。一般而言,酰胺A的吸收波数通常在3400~3440cm-1,它是由N-H伸缩振动产生的;但是,当N-H基团参与氢键的形成时,其伸缩振动会向低频率移动,通常在3300cm-1左右(Li等,2004)。枪乌贼表皮胶原蛋白酰胺A的吸收波数为3224cm-1,充分表明了分子中存在氢键。酰胺B谱带主要是由分子中CH2基团的不对称伸缩振动产生的(Muyonga等,2004a),其吸收波数位于2924cm-1。酰胺Ⅰ带是由蛋白质多肽骨架的C=O伸缩振动产生的,通常不受肽链侧基影响,振动频率取决于肽链构型(易继兵等,2012),为蛋白质二级结构变化的敏感区,常被用于蛋白质的二级结构分析,其特征吸收波数通常在1625~1690cm-1(段蕊等,2008)。枪乌贼表皮胶原蛋白酰胺Ⅰ带的吸收波数在1652cm-1,符合酰胺Ⅰ带的出峰位置。酰胺Ⅱ带也不易受肽链侧基影响,但是其对胶原蛋白的三螺旋结构不如酰胺Ⅰ带敏感。枪乌贼表皮胶原蛋白酰胺Ⅱ带的特征吸收波数位于1533cm-1,符合胶原蛋白酰胺Ⅱ带的吸收波数在1500~1600cm-1的范围内。此外,红外图谱显示胶原蛋白在1237cm-1(酰胺Ⅲ带)和1496cm-1间有吸收带存在,表明该胶原蛋白具有良好的天然三螺旋结构。
胶原纤维结构可通过多种方法研究,其中扫描电镜、原子力显微镜和透射电镜是使用最普遍的方法。图4-11(a)为用扫描电镜观察到的罗非鱼皮胶原纤维的结构,可以看出这是一种丝状纤维。图4-11(b)(c)为用原子力显微镜观察到的罗非鱼皮胶原纤维的结构,可以发现与扫描电镜观察的结果是不同的,丝状纤维表现周期性的条带结构。经分析其条带周期为68nm,这与已报道的陆生动物胶原纤维的明暗条带周期为67nm比较相近(Andrew,1961),但是与狭鳕鱼皮胶原纤维明暗条带的周期为53nm有差异(闫鸣艳,2009)。

图4-11 罗非鱼皮胶原纤维的结构(Yan等,2015)
(a)扫描电镜图像(b)(c)原子力显微镜图像
5.理化性质
(1)热稳定性:一般来说,蛋白质对温度变化非常敏感,胶原蛋白也不例外。胶原蛋白的性质是否稳定,是否正常保持三螺旋结构都与温度有着密切的联系。胶原蛋白的热稳定性通常用热变性温度(denaturatation temperature,Td)来表征,定义为50%胶原蛋白分子发生变性的温度。胶原蛋白的变性主要是指由氢键断裂导致的三螺旋结构解开,形成单链无规则的线团结构,在红外光谱上主要表现为酰胺A、Ⅰ、Ⅱ和Ⅲ峰强度的降低,并且酰胺Ⅰ谱带变窄(Muyonga等,2004b),进而发生理化性质的改变,包括黏度下降、沉降速度增加、浮力上升、紫外吸收增加等。胶原蛋白一旦变性,便会形成明胶,因此胶原蛋白的溶解度增高,黏度下降,这与普通蛋白质变性后发生凝固的性质恰好相反(永井裕,1992)。胶原蛋白的热变性温度多采用不同温度下胶原蛋白溶液的黏度变化来测定(陆璐,2006)。以罗非鱼皮胶原蛋白为例,具体测定方法如下(Yan等,2008):
将含10ml的0.02%胶原蛋白的0.1mol/L醋酸溶液的乌氏黏度计浸入到水浴锅中,从20℃逐渐升高温度至50℃,在每个测定温度保持30min,使得胶原蛋白溶液温度与水浴温度平衡,测定溶液通过毛细管所用的时间,重复测试3次。
假设溶液的密度和溶剂的密度相同,则
![]()
其中,t是样品溶液流出的时间,t0是溶剂流出的时间。
以Fractional viscosity(分数黏度)=![]() 与温度作胶原蛋白热变性曲线,Fractional viscosity=0.5时所对应的温度即为热变性温度(Td)。
与温度作胶原蛋白热变性曲线,Fractional viscosity=0.5时所对应的温度即为热变性温度(Td)。
罗非鱼皮胶原蛋白的热变性曲线如图4-12,则其热变性温度(Td)为29.6℃。
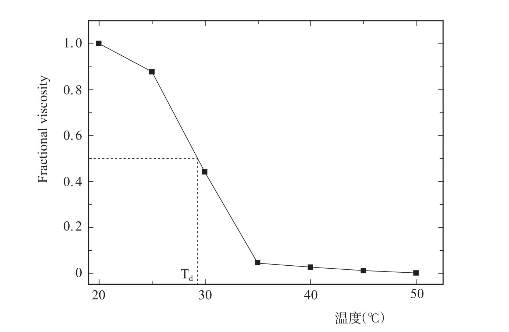
图4-12 罗非鱼皮胶原蛋白的热变性曲线
胶原蛋白的热稳定性与其亚氨酸含量密切相关,通常亚氨酸含量越高,胶原蛋白越稳定,这主要是脯氨酸和羟脯氨酸的吡咯环对胶原蛋白三级结构的影响。Ikoma等实验的CD谱图显示,胶原蛋白的热变性温度随着亚氨酸残基数量的减少而降低(Ikoma等,2003)。脯氨酸和赖氨酸的水合程度对胶原蛋白的热稳定性也有明显的影响。在具有相似的氨基酸组成的条件下,水合程度越大,则热稳定性越高(Muyonga等,2004a)。例如,哺乳动物胶原蛋白通常在39℃变性,在缺乏脯氨酸羟化酶条件下合成的胶原蛋白则在24℃变性,原因主要是羟脯氨酸可以稳定胶原蛋白的三股螺旋结构;羟赖氨酸有利于胶原蛋白交联的形成和稳定,从而形成复杂的疏水键(Senaratne等,2006)。研究表明草鱼皮(Zhang等,2007)、罗非鱼皮、黄河鲤鱼鳞(肖枫,2014)、海蜇(庄永亮,2009)和史氏鲟鱼皮(Wang等,2014a)胶原蛋白的热变性温度分别为28.4,29.6,31.8,28.8和32.5℃,均低于猪皮胶原蛋白的热变性温度(37℃),这主要是与胶原蛋白的亚氨基酸含量低有关。
此外,一些研究还涉及胶原蛋白的热稳定性与动物的生活环境有关,如生活在海岸带的鱼类胶原蛋白的热变性温度要高于生活在深海的鱼类胶原蛋白,实际上这还是由胶原蛋白的亚氨基酸含量决定的。
(2)自聚集性:自聚集也称为自组装,是天然胶原蛋白的重要性质之一,即具有完整三螺旋结构的胶原分子单体通过分子间的有序排列,形成具有交错条纹结构(D周期)的胶原纤维(图4-13)(赵燕,2014a;Kyle等,2009)。大约在50年前,科学家首次发现溶液中的胶原蛋白在中性、室温条件下能够发生聚集形成纤维,此后胶原蛋白的自聚集性的研究逐渐受到重视,Gross和Jackson还分别观察到胶原蛋白聚集形成凝胶的现象(Silver等,2003)。
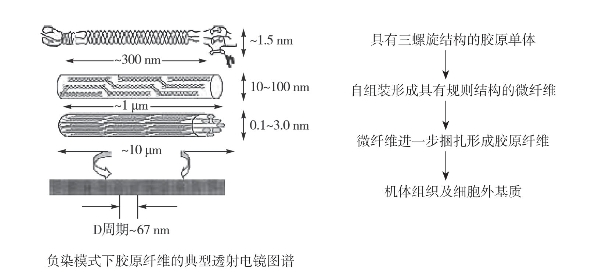
图4-13 天然胶原蛋白分子自聚集示意图(赵燕,2014a)

图4-14 青蛙皮酸溶性胶原蛋白的自聚集动力学曲线
(Sai和Babu,2001)
自聚集温度为35℃(a)和37℃(b)
到目前为止,已对海岸带动物胶原蛋白自聚集特性进行了一些研究。如Sai等研究了青蛙皮酸溶性和酶促溶性胶原蛋白的自聚集和解聚特性,结果表明在0.2mol/L的磷酸缓冲液(pH为7.4)中,两种胶原蛋白在35℃和37℃均可发生自聚集,其自聚集动力学曲线(图4-14)类似于哺乳动物胶原蛋白的聚集动力学曲线,具体过程分为起始阶段和生长阶段。在起始阶段,溶液浊度没有明显变化,表明没有大的胶原蛋白聚集体形成,该阶段可能是胶原蛋白的一个结构变化的过程(Li等,2007a);随后,溶液浊度明显增加直至稳定,表明胶原蛋白聚集体逐步形成。将酸溶性和酶促溶性胶原蛋白在低温下进行解聚实验发现,酶促溶性胶原蛋白解聚现象明显,酸溶性胶原蛋白解聚现象不明显(Sai和Babu,2001)。在鱿鱼软骨(Sivakumar和Chandrakasan,1998)、草鱼皮(赵燕,2014a)和鱼鳞(梁艳萍等,2011)、乌鳢鱼皮(赵燕等,2014b)、鳙鱼皮(姚攀,2013)、海蜇(Hoyer等,2014)等胶原蛋白上均观察到类似的自聚集动力学曲线。自聚集对于胶原蛋白生物学性能的改善具有明显的促进作用。Pati等(2012)研究表明,南亚野鲮和卡特拉魮鱼鳞胶原蛋白在自聚集过程中经碳化二亚胺/N-羟基琥珀酰亚胺交联,胶原蛋白的稳定性明显提高;赵燕等(2014a)的研究也表明草鱼皮胶原蛋白经纤维重组后,其热稳定性也得到明显提升。类似研究成果对于弥补海岸带动物胶原蛋白性能的不足是非常有利的,也使此类胶原蛋白在医用生物材料和组织工程领域具有非常广阔的的应用前景。但是目前对于海岸带动物胶原蛋白自聚集性的研究远远不够。大部分研究还停留在对胶原蛋白自聚集过程的基础研究阶段,只有少部分研究关注胶原蛋白自聚集体的性质和性能方面。如姚攀(2013)对鳙鱼皮酸溶性和酶促溶性胶原蛋白的体外细胞培养实验,发现这两种胶原蛋白均具有良好的生物相容性,具备在生物医学材料中应用的潜在价值。今后关于海岸带动物胶原蛋白自聚集性的研究应集中于胶原蛋白自聚集体生物学性能方面,为此类胶原蛋白应用领域的拓展提供基础和依据。
(3)凝胶性:凝胶性是胶原蛋白的重要性质之一。胶原蛋白分子表面有许多极性侧基,如氨基、酰胺基、羧基、羟基等,都能与水分子以氢键结合,于是胶原分子周围形成了一层水分子膜,这样胶原即发生了膨胀,随着时间的延长,膨胀的胶原蛋白可进一步吸水,通常能够结合自身重量10倍以上的水,形成凝胶(易继兵,2011)。研究表明,未变性胶原蛋白和变性胶原蛋白(明胶)均具有良好的凝胶化作用。未变性胶原蛋白,即具有三螺旋结构的胶原蛋白,能够自聚集形成水凝胶(图4-15),其内部是纤维状结构,类似结构在草鱼和乌鳢鱼皮(赵燕,2014b;汪海波等,2012;钟朝辉等,2007)胶原蛋白中也可以观察到。胶原蛋白凝胶在细胞培养、组织构建、创伤修复、药物载体等方面具有广泛的应用,但是目前对海岸带动物胶原蛋白凝胶在类似方面的研究非常少,亟须加强该方面的研究,以拓展海岸带胶原蛋白的应用领域。

图4-15 罗非鱼皮胶原蛋白自聚集水凝胶图像
(中国科学院海岸带研究所生物学与生物资源利用重点实验室)
(a)表观图像(b)扫描电镜图像
目前对于海岸带动物明胶的凝胶性已进行了较多的研究。研究均表明海岸带明胶与陆生哺乳动物明胶相比,其临界凝胶浓度较高,凝胶点和溶胶点较低,并且凝胶强度较差,大大限制了其应用领域;但是与深海动物明胶相比,其凝胶强度较高,因此海岸带明胶具有一定的应用前景。近年来,海岸带明胶凝胶的改性研究随之发展起来,目前已研究了一些改性的方法。一是物理方法,如热处理法、辐射法、光氢化法和热脱氢法等;二是化学方法,如利用金属离子、戊二醛、京尼平、碳化二亚胺(EDC)/N-羟基琥珀酰亚胺(NHS)、转谷氨酰胺酶进行交联,通过壳聚糖、海藻酸钠、卡拉胶进行共混等。物理改性法虽然可以有限避免外源有毒物质的介入,但是改性条件不易控制,交联度不均匀,一般不作为主要的方法来使用(杜田明等,2015);化学方法由于改性效果好,现在被广泛使用,但是有时候会引入外源有毒物质,因此在明胶改性方面需依照需要选择合适的方法。现在多通过改性方法来改善海岸带动物明胶的凝胶性能以促进其应用。Sarabia等(2000)通过添加盐离子来提高鲽鱼皮凝胶的黏弹性。Temdee通过加入腰果树皮等一些植物提取物来提高墨鱼皮明胶的凝胶性(Temdee和Benjakul,2014)。
(4)其他理化性质:众所周知,蛋白质具有其本身的功能性质,如水合性、乳化性、溶解性、起泡性等,胶原蛋白也不例外。对胶原蛋白的溶解性、吸水性、乳化性等功能特性的研究是胶原蛋白在食品、化妆品等领域应用的重要基础。目前对海岸带胶原蛋白也进行了一些研究,其中溶解性是研究最多的性质。胶原蛋白的溶解性实际上是其中的氢键与水之间发生作用,一般随着外界条件如温度、离子强度、pH的变化而发生变化。Singh等(2011)研究鲶鱼皮胶原蛋白溶解性,发现该胶原蛋白在pH1~4时溶解度比较大,之后显著降低,在pH5~10时溶解度只有最大溶解度的10%~20%,胶原蛋白这种随pH变化而变化的溶解性与其等电点密切相关。同时NaCl浓度对鲶鱼皮胶原蛋白也有显著影响,在NaCl浓度小于等于2%时,胶原蛋白溶解度比较大而且比较稳定,但是当NaCl浓度大于2%时,溶解度明显下降。这是因为盐离子通常以两种不同的方式影响胶原蛋白的稳定性。在低浓度时,钠离子可与胶原蛋白结合,使其所带正电荷增加,蛋白质分子间相互排斥,分散性好,表现为溶解度较大;但是在较高的NaCl浓度时,盐离子与周围水分子结合形成水化膜,使蛋白质发生盐析效应而析出,导致溶解度降低(Nalinanon等,2007;闫鸣艳,2009)。类似的溶解性在河豚鱼皮(Huang等,2011)、竹荚鱼鳞(Thuy,2014)等胶原蛋白中均可观察到。对于海岸带胶原蛋白其他性质的方面也发现一些研究。钱曼等分别用热水法和酶解法提取了草鱼鱼鳞胶原蛋白,研究发现酶解法提取的胶原蛋白的黏度、吸水性和起泡性均优于热水法提取的,但保水性、乳化性和乳化稳定性及泡沫稳定性却不及热水法提取的胶原蛋白(钱曼等,2007)。涂宗财等(2015)研究了鳙鱼鱼鳞明胶的泡沫性能,发现明胶泡沫随着时间的延长逐渐增大,且形状由最初的球形逐渐转变为多边形;在浓度为0.2%时,泡沫粒径最小,起泡能力最强,泡沫稳定性最高。
6.应用
胶原蛋白是一种天然安全的生物大分子,具有良好的可降解性和生物安全性,这是其他高分子物质无可比拟的特性,因此在食品和生物医学领域具有广泛的应用。
(1)在食品领域的应用:大分子胶原蛋白在食品领域的应用大多数情况下是以明胶的形式来发挥作用的。明胶在食品领域的应用非常广泛,全世界生产的明胶有一半以上应用在食品方面。它可作为增塑剂、胶凝剂、稳定剂、乳化剂、增稠剂、发泡剂、黏合剂、澄清剂等应用于糖果、冷冻食品、饮料、肉制品、乳制品、啤酒、面包等食品上。目前海岸带胶原蛋白食品还非常少,但是相关研究已开展起来,相信在不久的将来即会有产品面市。如利用鲢鱼鱼鳞明胶来制作果冻,所得产品组织状态、色泽、口感、风味方面均好于市售明胶制作的果冻(潘杨,2008);利用罗非鱼鱼鳞胶原蛋白为原料开发凝冻休闲食品,产品不仅风味独特、爽口、营养全面,而且具有一定的保健功能(程雨晴等,2014)。陈小雷(2013)将用热水法提取的鮰鱼皮明胶添加到鱼肠中,通过对鱼肠的凝胶强度、TPA和保水性测定,发现鮰鱼皮明胶用于鱼肠内不会明显影响其口感和质地,并且在凝胶强度和保水性方面与市面上卡拉胶的作用类似。此外,明胶对人体还具有一定的保健功能,如阿胶的补血功能。实际上,海岸带明胶也具有类似的功效。研究显示罗非鱼皮明胶具有较好的抗贫血活性,优于深海鱼类——狭鳕鱼皮明胶(杨霞,2013)。
胶原蛋白还可以应用于食品包装材料。它是制作人工肠衣的理想原料,在热处理过程中,随着水分和油脂的蒸发和熔化,胶原蛋白肠衣几乎和肉的收缩率一致;胶原蛋白还可以制成可食性蛋白膜,用作糖果、果脯和糕点的内包装膜以及肉类保鲜膜(万春燕等,2008)。目前利用海岸带动物胶原蛋白为原料制备可食性包装膜的研究比较多。Tang等(2015)以罗非鱼皮、草鱼皮和鲤鱼皮酸溶性胶原蛋白为原料制备膜材料,其中罗非鱼皮胶原蛋白膜的抗张强度为51.24MPa,远高于其他两种膜。卢黄华等(2011)利用倾注法以草鱼鱼鳞胶原蛋白和壳聚糖为原料制备蛋白膜,在成膜温度45℃、pH5、胶原与壳聚糖配比6∶4的适宜条件下,膜的抗张强度为61.27MPa,断裂伸长率为5.17%。由于海岸带动物的生活环境,利用海岸带动物胶原蛋白制备的可食性包装膜材料在性能上要优于深海动物胶原蛋白。陈丽(2009)研究结果表明,狭鳕鱼皮明胶膜的抗张强度为13.65MPa,加入壳聚糖后膜的抗张强度最大可达25MPa,远低于Tang(2015)和卢黄华(2011)文中提到的胶原蛋白膜的强度。随着人们环保意识的增强,塑料食品包装材料必将被新型的纸包装袋和可食性包装材料所代替,这也是世界范围内的大趋势(汤克勇,2012),因此海岸带胶原蛋白在食品包装材料上的应用前景非常广阔。
(2)在生物医学领域的应用:胶原蛋白具有较高的生物相容性、低免疫性、良好的生物降解性等优点,这是合成高分子材料无法比拟的性能优势,使得它在生物医学领域具有广阔的应用前景。胶原蛋白在医学上的应用可以追溯到公元175年,Galen医生首次将胶原蛋白作为可吸收的肠衣缝合线来使用(闫鸣艳,2009)。到目前为止,胶原蛋白已可以制成烧伤敷料、止血材料、药物载体、心脏瓣膜、血管、食管和气管的替代材料、手术缝合线等多种医用生物材料,应用在多个医学领域(表4-4)。
表4-4 胶原蛋白在生物医学领域的应用(韩倩倩等,2012)


图4-16 罗非鱼皮胶原蛋白海绵
(a)表观图像 (b)横面扫描电镜图像 (c)切面扫描电镜图像
目前,应用海岸带胶原蛋白制备医用生物材料已逐渐受到了重视,相关研究也开展起来了。中国科学院海岸带研究所生物学与生物资源利用重点实验室应用罗非鱼皮胶原蛋白为原料制备了胶原蛋白海绵(图4-16),其内部是多孔状结构,非常有利于海绵吸收血液,达到止血效果。汪海波等(2013)研究了交联方法对草鱼皮胶原蛋白海绵性能的影响,结果表明戊二醛和EDC/NHS交联能有效提高胶原蛋白海绵材料的性能,而热交联和紫外交联对材料性能的改善作用非常有限。徐志霞(2014)研究表明,EDC/ NHS交联鱿鱼皮胶原蛋白医用材料能够有效地缩短出血时间,减少出血量,达到快速止血的效果,并且优于市售明胶海绵。方成等(2014)通过SD大鼠体内植入实验,研究了草鱼皮胶原蛋白海绵的组织相容性,结果如图4-17。可以看出对照组[见图4-17(a)]仅见局部肌纤维分离缝隙,未见炎性细胞浸润;FA组[见图4-17(b)]材料边缘模糊,大量炎性细胞分布;FP组[见图4-17(c)]材料边缘完整,有炎症反应细胞浸润;PP组[见图4-17(d)]材料纤维结构失去,局部炎性细胞浸润,因此可以认为鱼皮酶溶性胶原蛋白海绵具有较大组织相容优势。此外,Hoyer等(2014)通过自聚集和EDC交联构建了海蜇胶原蛋白支架(图4-18),该支架的孔隙率为98.2%,经反复压缩仍然是稳定的,并且该材料没有细胞毒性。总之,海岸带胶原蛋白医用生物材料的研究已成为热点,目前已取得了一些鼓舞人心的结果,经过进一步深入细致的研究,该类胶原蛋白材料必将在人类生活中发挥重要作用。
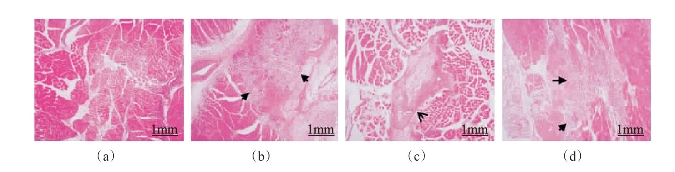
图4-17 草鱼皮胶原蛋白海绵植入大鼠长收肌1周后植入部位切片HE染色(方成等,2014) 指示材料边缘,
指示材料边缘, 指示炎性细胞浸润边缘;炎性细胞浸润面积FA组与FP、PP组具有显著性差异(a)空白 (b)鱼皮酸溶性胶原蛋白(FA)(c)鱼皮酶溶性胶原蛋白(FP)(d)猪皮酶溶性胶原蛋白(PP)
指示炎性细胞浸润边缘;炎性细胞浸润面积FA组与FP、PP组具有显著性差异(a)空白 (b)鱼皮酸溶性胶原蛋白(FA)(c)鱼皮酶溶性胶原蛋白(FP)(d)猪皮酶溶性胶原蛋白(PP)

图4-18 海蜇胶原蛋白软骨支架(Hoyer等,2014)
(a)表观结构 (b)扫描电镜结构
(二)糖蛋白
糖蛋白是由糖链和多肽链以多种形式共价修饰而形成的一类重要生理活性物质。肽链部分在糖蛋白执行生理功能时发挥重要作用,糖链部分可影响蛋白质的折叠和整体构象,进一步影响糖蛋白的结构和生理活性。糖蛋白不仅具有凝集素、结构蛋白、酶贮藏蛋白等方面的作用,而且具有抗氧化、抗疲劳、抗肿瘤、增强免疫力、降血脂等众多生理功能。目前对海岸带动物糖蛋白的研究已逐渐受到重视。其来源包括贝类、海蜇、刺参、乌贼、鱼卵等海岸带动物,研究主要集中于这些海岸带动物糖蛋白的分离纯化、结构表征及生理活性等方面,类似研究为其应用提供了基础和依据。
1.贝类糖蛋白
(1)来源:贝类属软体动物门中的瓣鳃纲(或双壳纲),因一般体外披有1~2块贝壳,故得名,常见的牡蛎、蛤、蛏、蚌等均属于此类。贝类含有多糖、蛋白质、牛磺酸、氨基酸、维生素等多种活性成分,具有抗疲劳、抗氧化、保护肝脏、抗肝炎病毒、抗肿瘤、抗动脉粥样硬化等生理功能(黎丽等,2014)。近年来,贝类糖蛋白的研究逐渐受到重视,它也是在海岸带动物糖蛋白中研究最为广泛的一类。科研人员已对牡蛎、河蚬、菲律宾蛤仔、文蛤、栉孔扇贝、皱纹盘鲍等来源糖蛋白的提取、分离纯化、结构特征、生理活性等开展了一系列分析和研究。
(2)制备、分离及纯化:糖蛋白是一类结合蛋白,兼有蛋白质和多糖的某些性质,大多可溶于水及稀盐、稀酸和稀碱溶液中,因此可根据需要采用不同的溶剂提取分离(尹德胜等,2009)。糖蛋白的提取方法大致可分为水提法、酸碱溶液提取法和盐提取法。一般来说,水提法具有条件温和、对产物结构和生物活性影响低的优点,但是其得率较低,并且需要多次浸提;酸碱溶液提取法虽然提取率高,但是易因溶剂过酸或过碱而导致糖蛋白结构破坏、生物活性丧失;糖蛋白在盐溶液中溶解度相对较高,并且稀盐法提取能够较好地保持糖蛋白的稳定性(戴宏杰,2015)。总体上来说,这三种方法在贝类糖蛋白的制备上均有应用。以水为浸提剂能够提取波纹巴非蛤糖蛋白,其最适条件为料水比是1∶10,80℃水浴浸提60min,60℃旋转蒸发浓缩,然后用饱和度为20%和40%的硫酸铵分级分离得到两个主要级分,总糖与可溶性蛋白含量分别为19.5%、30.7%和23.6%、20.9%(范秀萍等,2008a)。尹德胜探讨了用盐酸溶液提取牡蛎壳糖蛋白的工艺,结果表明盐酸酸度为pH5.0、反应温度60℃、时间为160min(尹德胜,2009)。对于珠母贝全脏器糖蛋白,可用1.0mol/L的NaCl溶液在65℃条件下浸提60min,然后经透析浓缩、醇沉即可得到,所得糖蛋白总糖和总蛋白含量为7.49%和25.33%(范秀萍等,2007);利用0.5mol/L的NaCl溶液在75℃水浴中浸提85min,能够提取尖紫蛤全脏器糖蛋白,总糖和蛋白含量分别为15.27%和4.42%(刘倩等,2011)。此外,在水提法和盐提法的基础上,还可以通过超声波辅助提取的方法来提取贝类糖蛋白。胡雪琼等(2009)研究了超声波辅助盐提取法来提取牡蛎糖蛋白的工艺,最适条件为NaCl浓度2.0mol/L、料液比1∶12、超声功率600W、处理时间40min,在此条件下糖蛋白提取率为75.89mg/g,比传统方法提高了22.22%。
若要进一步对糖蛋白进行分离纯化,须依据糖蛋白的具体性质和研究目的来确定。对于贝类糖蛋白,目前多通过阴离子交换柱和凝胶柱层析法以及高效液相色谱法进行分离纯化。目前,使用最多的是DEAE-52纤维素柱层析和Sephadex葡聚糖凝胶柱层析。徐明生等(2008)采用超声波辅助提取的方法提取得到了河蚬糖蛋白粗提物;然后上DEAE-52纤维素柱层析,用NaCl溶液洗脱,收集蛋白和多糖重叠的洗脱峰[图4-19(a)],透析后冷冻干燥;接下来将收集的糖蛋白溶液上Sephadex G-25葡聚糖凝胶柱层析,继续收集蛋白和多糖重叠的洗脱峰[见图4-19(b)],冻干;最后上反相高效液相色谱进行分离纯化,得到一个单一的峰[见图4-19(c)],说明所得河蚬糖蛋白纯度较高。包郁明等(2012)通过DEAE-52纤维素柱层析、Sephadex G-100凝胶柱层析,分离纯化了皱纹盘鲍脏器糖蛋白,总糖和总蛋白含量分别为12.4%和76.6%,SDS-PAGE电泳鉴定其分子量为7.37万。利用DEAE-52纤维素柱和Sephadex葡聚糖凝胶柱层析还成功分离纯化了菲律宾蛤仔脏器(吴红棉等,2008)、管角螺肌肉(傅余强等,2002)、牡蛎肉(汪秋宽等,2007)、牡蛎体液(刘文等,2013)、牡蛎内脏(Ogamo等,1976)等贝类糖蛋白。

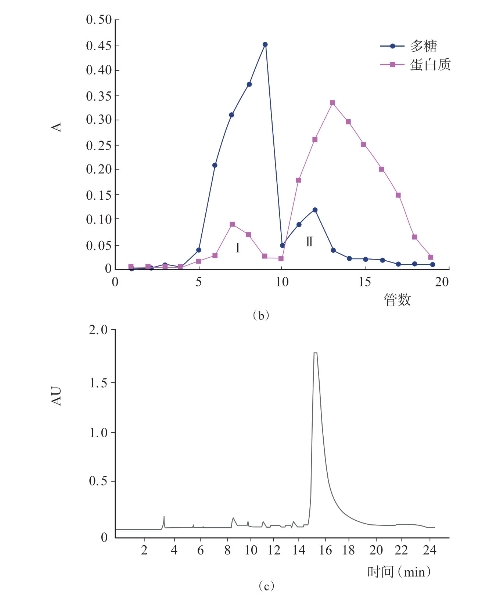
图4-19 河蚬糖蛋白分离纯化(徐明生,2008)
(a)DEAE-52纤维素柱层析 (b)Sephadex G-25葡聚糖凝胶柱层析 (c)高效液相色谱图
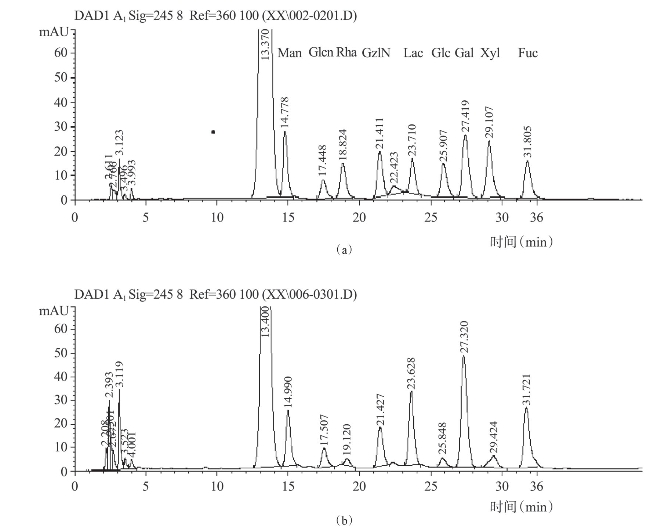
图4-20 皱纹盘鲍糖蛋白单糖组成的HPLC图谱(包郁明,2012)
(a)单糖标准品(b)皱纹盘鲍糖蛋白
(3)组成和结构:糖蛋白是蛋白质和糖基共价结合而成的复合物,因此在研究糖蛋白的组成和结构方面多从蛋白链和糖链两部分来分析。目前对于糖蛋白结构分析多集中于糖肽结构的顺序、连接方式以及参与连接的氨基酸残基,由于分析手段的缺乏,完整糖蛋白结构的确定仍是研究的“瓶颈”问题。因此,对于贝类糖蛋白组成和结构的研究主要集中于总糖和蛋白含量、单糖组成、氨基酸组成、连接方式等方面。包郁明(2012)详细研究了皱纹盘鲍脏器糖蛋白的组成和结构。首先,应用福林酚法测定了糖蛋白中总蛋白含量为75.34%,利用硫酸-苯酚法测定的总糖含量为12.74%。其次,氨基酸分析表明,该糖蛋白中缬氨酸含量最高,含量为9.96%,其次为谷氨酸、甘氨酸、天冬氨酸、亮氨酸、苏氨酸;应用液相色谱测定的单糖组成(图4-20)表明该糖蛋白各单糖组成比例为:Man∶Glcn∶Rha∶GalN∶Glc∶Gal∶Xyl∶Fuc=12.51∶14.91∶2.70∶13.11∶4.00∶23.47∶ 4.00∶25.30,其中岩藻糖、半乳糖、氨基葡萄糖占63.68%,为单糖的主要组成部分。最后,测定了糖蛋白的红外光谱(图4-21),发现糖蛋白中存在1071.22cm-1的吸收峰,表明其中的糖苷键类型为吡喃型,同时存在1232.09cm-1吸收峰,表明多肽链主要以β-构型存在;应用β-消除反应确定了糖肽键的类型,如图4-22,可以看出在反应前后,240nm处紫外吸收增强,说明β-消除反应已经发生,表明皱纹盘鲍糖蛋白中存在O-糖肽键。刘文等(2013)从牡蛎体液中分离纯化了一种糖蛋白,经研究发现其中肽链主要以α-螺旋构型存在,糖肽键为N-糖苷键。徐明生等(2008)分离纯化了一种河蚬酸性糖蛋白,其总糖和蛋白含量分别为5.18%和94.74%,相对分子量19030,该糖蛋白中存在O-糖肽链,含有吡喃糖β-型糖苷键。此外,还有一些研究是通过cDNA序列来推断贝类糖蛋白结构的。如Samata等(2008)通过该方法推断出了岩牡蛎壳5.2万糖蛋白的结构;Sarashina等(2001)推断出了扇贝壳一种酸性糖蛋白的结构。总体上来说,目前对于贝类糖蛋白组成和结构的研究还不够深入,对糖蛋白结构进一步研究需加强,但这依赖于先进的分析手段的发展。(https://www.xing528.com)
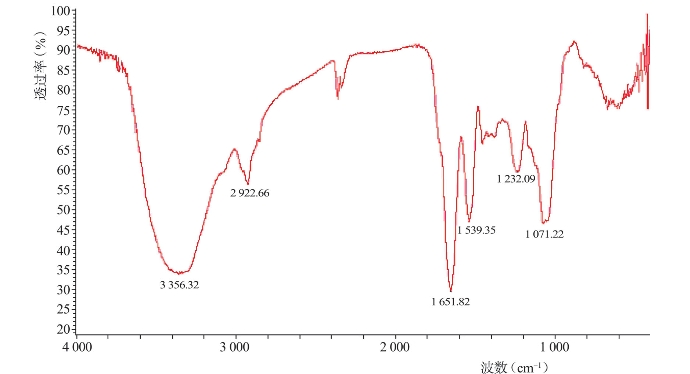
图4-21 皱纹盘鲍糖蛋白红外光谱图(包郁明,2012)
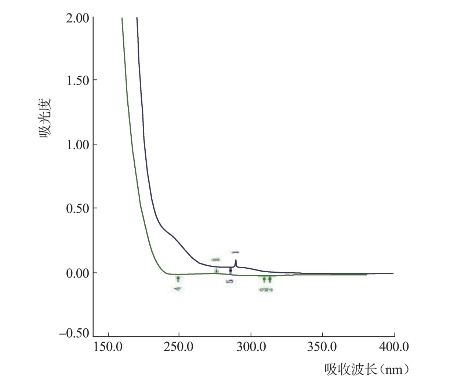
图4-22 β-消除反应前后皱纹盘鲍糖蛋白紫外光谱图的变化
(包郁明,2012)
(4)生理活性:糖蛋白生理活性是其应用的基础和依据,是研究人员的关注点。目前对于贝类糖蛋白生理活性也进行了一些研究,主要集中于抗氧化、抗肿瘤、免疫调节活性以及细胞凋亡作用等方面。
①抗氧化活性。自由基是人类生命活动中生化反应的中间产物,可加快机体衰老,并与癌症、心血管疾病的发生密切相关。近年来,许多学者研究发现多种糖蛋白能够有效清除自由基,表现一定的抗氧化活性(王倩等,2012)。贝类糖蛋白也表现类似的生理活性,如波纹巴非蛤(范秀萍,2008a)、近江牡蛎(黄来珍等,2011)和马氏珍珠贝(李雨哲等,2011)糖蛋白均表现清除自由基活性。对不同方式提取的近江牡蛎糖蛋白的体外抗氧化活性的研究发现(黄来珍等,2011),提取方式能够影响到糖蛋白的抗氧化活性;研究结果表明超声辅助盐液浸提的牡蛎糖蛋白清除羟自由基、超氧阴离子自由基及DPPH自由基能力比水浸提和盐液浸提的糖蛋白的能力强。糖蛋白清除自由基活性主要与分子中还原性羟基、双键有关,因此超声辅助盐液浸提的近江牡蛎糖蛋白表现较好的清除自由基活性可能与超声波影响到了糖蛋白的组成和结构有关。李雨哲(2011)研究了马氏珍珠贝糖蛋白的抗氧化活性,通过氧化自由基吸收能力测定法(ORAC法)研究发现,该糖蛋白具有较高的抗氧化活性;模拟酸性饮料的杀菌处理方式(pH4.0的缓冲液在90℃加热10min)能够显著提高其抗氧化活性,但是模拟罐头的杀菌方式(121℃处理30min)使其抗氧化能力下降;金属离子对该糖蛋白抗氧化活性的影响也是不同的,Ca2+、Zn2+和EDTA会显著降低其抗氧化活性,Mn2+能提高它的抗氧化活性,Mg2+对抗氧化活性的影响不大。总体上来说,目前对贝类糖蛋白抗氧化活性的研究非常不充分,大多停留在体外活性评价阶段,由于体内环境与体外环境差别很大,许多体外有效地抗氧化剂在体内并表现不出应有的效果。因此,后续研究应多关注糖蛋白的体内抗氧化活性,以进一步全面评估贝类糖蛋白的抗氧化活性。
②抗肿瘤活性。一些研究表明,贝类糖蛋白具有一定的抗肿瘤活性。菲律宾蛤仔肉糖蛋白对DU-145细胞具有明显增殖抑制作用(郁迪等,2011)。尖紫蛤全脏器糖蛋白对鼻咽癌CNE-2Z细胞的生长表现抑制作用(刘倩,2011)。栉孔扇贝糖蛋白能显著抑制移植性小鼠S180肉瘤的生长,最高抑瘤率可达47.29%,但对小鼠脾脏重量没有显著影响(顾谦群等,1998)。该糖蛋白的抑瘤率比日本报道的虾夷扇贝糖蛋白的抑瘤率略低,研究者认为这可能主要与糖蛋白中糖链的差异有关,该糖蛋白的组成单糖为D-葡萄糖醛酸、D-葡萄糖、D-半乳糖、D-甘露糖、D-木糖、L-岩藻糖、L-鼠李糖,虾夷扇贝糖蛋白的组成单糖为N-乙基葡萄糖胺、N-乙基半乳糖胺、L-岩藻糖、D-半乳糖、D-甘露糖和D-葡萄糖。海湾扇贝裙边糖蛋白(梁秋元,2012)和管角螺肌肉中性糖蛋白(傅余强,2002)对小鼠S180肿瘤均有明显的抑制作用。吴杰连(2006)对文蛤糖蛋白的抗肿瘤作用进行了比较全面的研究,发现该糖蛋白对人肺癌(A549)、卵巢癌(HO8910)、宫颈癌(Hela)、鼻咽癌(KB)、肝癌(SMMC-7721)、鼠源性癌细胞(B16)、S180肉瘤、Heps瘤生长均有很强的抑制作用,但对正常脾淋巴细胞无抑制作用,表明文蛤糖蛋白对癌细胞具有特异性,能够选择性地杀伤肿瘤细胞,但不影响正常细胞的生长。
从目前的研究成果来看,贝类糖蛋白的抗肿瘤活性可能主要与其诱导肿瘤细胞的凋亡有关。浓度为10μg/ml、20μg/ml和40μg/ml河蚬糖蛋白作用于人肝癌细胞BEL740后,流式细胞仪结果显示在DNA直方图上出现明显的亚“G1”凋亡峰,并且该糖蛋白主要阻滞细胞于G0-G1期,对G2-M期和S期亦有一定影响(祝雯等,2004)。吴杰连(2006)研究了文蛤糖蛋白的抗肿瘤机制,发现其能够显著诱导肿瘤细胞凋亡,可见细胞皱缩变小,胞浆致密,核固缩,活细胞数减少,细胞膜破损等;流式细胞仪分析显示糖蛋白作用后,细胞在G0-G1间明显出现一个凋亡峰,细胞周期被停滞在S期的关键点上。文蛤糖蛋白诱导肿瘤细胞凋亡的机制是通过影响促进细胞凋亡基因和抗凋亡基因的表达来实现的。另外,实验结果还表明,文蛤糖蛋白能够增强机体的抗氧化能力,这也可能是糖蛋白抑制肿瘤细胞生长的机制。
总体上来说,目前对贝类糖蛋白抗肿瘤活性的研究不够深入,也不够全面。我国贝类资源丰富、种类繁多,对于其他种类贝类糖蛋白的纯化工艺、组成和结构以及抗肿瘤机制的研究亟须加强。
③免疫调节活性。机体的免疫调节功能是衡量机体是否健康的重要指标。研究表明,贝类糖蛋白具有一定的增强免疫力功能。杜华英等研究表明,河蚬糖蛋白具有促进脾淋巴细胞增殖和提高巨噬细胞吞噬能力的作用,并表现一定的剂量效应关系(杜华英等,2012)。梁秋元(2012)研究表明,海湾扇贝裙边糖蛋白具有免疫调节活性,主要表现在增强机体细胞免疫及体液免疫功能方面。包郁明(2012)通过连续皮下注射氢化可的松建立小鼠免疫机能低下模型,研究了皱纹盘鲍脏器糖蛋白对小鼠免疫机能的调节作用,结果表明该糖蛋白能显著提高免疫低下小鼠的细胞免疫和非特异性免疫功能,但不能逆转氢化可的松引起的免疫器官萎缩。
2.水母糖蛋白

图4-23 水母的外观形态
(a)海月水母 (b)白色霞水母 (c)发形霞水母 (d)海蜇
(1)来源:水母,海洋无脊椎动物,隶属腔肠动物门钵水母纲,在我国种类多、分布很广。在我国海域已记录的水母占全球已记录种类的40%左右(孙毅,2014),常见的主要有海月水母、白色霞水母、发形霞水母和海蜇等(图4-23)(阮增良等,2013)。就水母糖蛋白来说,已有研究主要集中于海蜇和霞水母糖蛋白上。海蜇是一种保健价值和药用价值都很高的药食同源的大型水母,体内含有大量的蛋白质、矿质元素、不饱和脂肪酸、维生素和多糖等物质。自海蜇资源衰退以来,霞水母已成为大型水母的优势种,资源相当丰富。霞水母中含有大量的水分,其固形物和糖复合物中粗蛋白含量分别为88.5%和82.7%,含糖量分别为6.25%和13.3%(林丹,2008)。
(2)制备、分离及纯化:目前对于水母糖蛋白的提取方法主要有酶法、稀盐法和超声辅助法等。范秀萍等(2008b)研究了枯草杆菌中性蛋白酶和胰蛋白酶酶解制备海蜇皮糖蛋白的工艺,采用枯草杆菌中性蛋白酶制备的工艺条件为:料液比1∶0.5、加酶量0.2%(质量分数)、50℃下水解3h,所得糖蛋白提取率为4.13%,总糖和总蛋白含量分别为34.12%和36.56%;采用胰蛋白酶制备的工艺条件为:料液比1∶0.5、加酶量0.3%(质量分数)、酶解温度50℃、水解时间4h,在该条件下糖蛋白提取率为6.25%,总糖和总蛋白含量分别为48.21%和28.65%。刘志龙(2013)采用0.5mol/L的氯化钠溶液结合乙醇醇沉的方法提取了海蜇糖蛋白,经分析得率为1.8%,纯度为98.25%,总糖含量和总蛋白含量分别为11.87%和87.74%。任国艳(2008)分别通过盐提取法和超声辅助盐提取法提供了海蜇口腕部糖蛋白,盐提取法最佳条件是用pH7.26的磷酸盐缓冲液、料液比1∶4、提取时间为7h,目标糖蛋白得率为5.45%;超声辅助提取法的最佳条件是超声处理时间为15min、超声功率300W、提取时间为60min,目标糖蛋白得率为9.14%。由此可以看出,超声辅助的方法明显提高了糖蛋白的得率,为工业化生产提供了新技术。
糖蛋白的分离纯化是研究的关键步骤,直接关系到后续研究的可行性和可信度。一般来说糖蛋白的分离纯化主要采用柱层析的方法,常用的有纤维素阴离子交换柱层析法、凝胶柱层析法、亲和柱层析法等。研究人员(任国艳等,2009a)对海蜇头糖蛋白的分离纯化工艺进行了探讨。首先用乙醇分级沉淀糖蛋白粗品,当乙醇百分含量为60%~80%时,目标产物含糖量较高,用于后续进一步纯化。其次,应用Sp Sephadex C-25阳离子交换柱层析分离,结果如图4-24,可以看出经NaCl溶液梯度洗脱后可得到5个峰,其中第三个峰是最大的峰,根据峰面积所占比例为65.24%,其中既含有蛋白又含有糖,将其命名为JGP-Ⅲ用于后续研究。最后,将JGP-Ⅲ采用Sephacryl S-300HR柱层析进一步纯化(图4-25),得到一个主峰,收集该峰,样品透析冻干后得到白色絮状糖蛋白;采用高效液相色谱鉴定,得到一个单一对称峰(图4-26),表明目标糖蛋白为均一组分。

图4-24 海蜇头糖蛋白的Sp Sephadex C-25阳离子交换柱(26mm×500mm)层析洗脱图谱
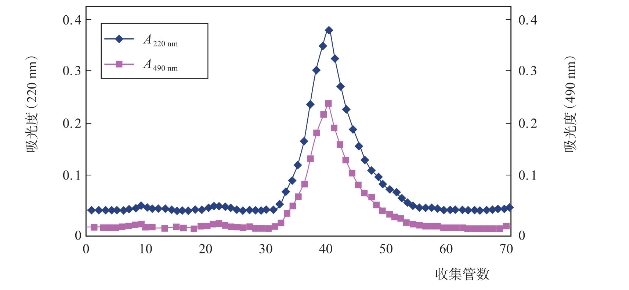
图4-25 JGP-Ⅲ在Sephacryl S-300HR柱(16mm×600mm)层析上的洗脱图谱
图4-26 JGP-Ⅲ的高效液相图谱
(3)组成和结构:目前对于水母糖蛋白组成和结构的研究与贝类糖蛋白类似,还停留在氨基酸组成分析、多糖组成分析和连接方式方面。任国艳等(2009b)对分离纯化的一种海蜇头糖蛋白的组成和结构进行了分析。该糖蛋白含有12.61%总糖、74.34%总蛋白、8.47%氨基糖、0.84%糖醛酸、1.06%硫酸根、0.92%唾液酸;单糖组成主要有氨基葡萄糖、氨基半乳糖、葡萄糖、甘露糖、岩藻糖和鼠李糖;氨基酸分析表明,甘氨酸含量最高,其次为缬氨酸、谷氨酸、丙氨酸、脯氨酸、天门冬氨酸等,缺乏色氨酸和组氨酸。梁旺春(2013)通过β-消除反应和PNGase F酶酶解反应研究了海蜇糖蛋白的糖苷键类型,结果如图4-27和4-28。通过β-消除反应能够鉴定糖蛋白是否存在O-连接糖苷键,通常O-连接糖苷键发生β-消除反应后易断裂,N-连接糖苷键比较稳定。因此,若糖蛋白中存在O-连接糖苷键,则发生β-消除反应后在240nm处吸收增强。从图4-27可以看出,发生β-消除反应后,溶液在240nm吸光度明显增强,表明海蜇糖蛋白中存在O-连接糖苷键。图4-28为经PNGase F酶作用后糖蛋白的电泳图,可以看出经PNGase F糖苷酶酶解作用后,糖蛋白的分子量明显降低了,说明PNGase F酶对糖蛋白发生了作用,将N-连接寡糖酶解下来,从而表现为分子量下降,充分表明了糖蛋白中存在N-连接糖苷键。因此,β-消除反应和PNGase F酶酶解反应结果表明,海蜇糖蛋白中既存在O-连接糖苷键,又存在N-连接糖苷键。日本研究人员Masuda等(2007)从野村水母、海月水母、咖啡金水母、海蜇和方指水母中分离到了一种糖蛋白,经基质辅助激光解吸电离飞行时间质谱(MALDI-TOFMS)研究发现,该糖蛋白具有8个氨基酸的串联重复序列,在其中的两个苏氨酸参加可能被N-乙酰-D-半乳糖胺糖基化,此糖蛋白与人类的黏液素类似,具有潜在的应用潜力。
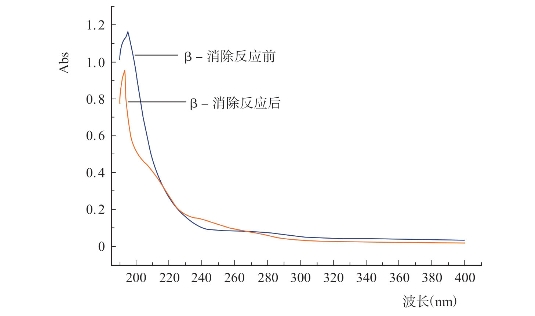
图4-27 海蜇糖蛋白β-消除反应前后紫外吸收光谱图(梁旺春,2013)
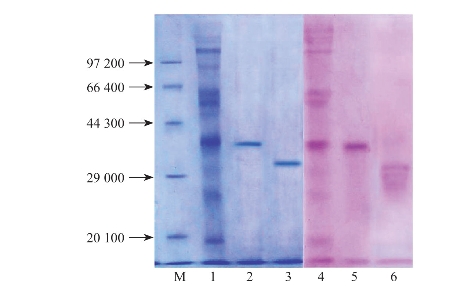
图4-28 海蜇糖蛋白SDS-PAGE电泳及PAS染色结果(梁旺春,2013)
M.蛋白质标准品 泳道1.粗品蛋白质考马斯亮蓝染色 泳道2.JGP-Ⅲ-Ⅱ考马斯亮蓝染色泳道3.JGP-Ⅲ-Ⅱ经过PNGase F酶酶解后考马斯亮蓝染色 泳道4.粗品糖蛋白PAS染色泳道5.JGP-Ⅲ-ⅡPAS染色 泳道6.JGP-Ⅲ-Ⅱ经过PNGase F酶酶解后PAS染色
(4)生理活性:目前关于水母糖蛋白生理活性的研究主要集中在免疫调节活性和抗疲劳、抗凝血等方面。研究表明,海蜇糖蛋白具有很好的免疫调节作用,具体表现为提高免疫低下小鼠的脾脏指数和胸腺指数,提高小鼠腹腔巨噬细胞能力,提高免疫低下小鼠的T细胞免疫水平,促进小鼠脾脏淋巴细胞的增殖活性,提高免疫低下小鼠的体液免疫功能等(任国艳,2008)。进一步对海蜇糖蛋白免疫调节机制的研究发现,海蜇糖蛋白可显著上调Th1类细胞因子mRNA表达量,显著下调Th2类和Th17类细胞因子mRNA表达量,因此推测其免疫调节功能可能是通过促进Th1类细胞因子的分泌以及抑制Th2类和Th17类细胞因子的分化实现的(邵征,2014)。林丹(2008)研究表明,霞水母糖蛋白能够在一定程度上延长小鼠的负重游泳时间、增加肝糖原含量、降低血清尿素氮以及血乳酸含量,因而表现抗疲劳作用;此外,发现霞水母糖蛋白还具有抗凝血作用,可能是通过抑制内源性凝血途径和外源性凝血途径共同实现的。
(三)其他海岸带动物糖蛋白
1.来源
目前对于其他来源的海岸带动物糖蛋白,如刺参水煮液、虎斑乌贼肌肉、鱼卵、缠卵腺等糖蛋白均有一定的研究。刺参是我国山东、辽宁和河北沿海一带珍贵而独特的海珍品,在其深加工过程中,会产生大量的水煮液,这些水煮液含有丰富的营养成分,长久以来未得到充分利用,若能够加以利用,不仅减少了环境污染和资源浪费,而且能够变废为宝,增加产品附加值(陈宁等,2015)。虎斑乌贼[图4-29(a)]是暖水性物种,主要分布在南海、大洋洲、菲律宾群岛、马来群岛、印度近海及红海海域。研究发现养殖和野生虎斑乌贼肌肉总蛋白含量分别为20.24%和20.15%,高于日本枪乌贼(9.29%)、拟目乌贼(14.8%)和曼氏无针乌贼(14.28%)(戴宏杰,2015)。鱼卵[图4-29(b)]是水产品加工的副产物之一,研究发现其中的蛋白质含量比鱼肉蛋白质含量要高(贺敏,2014)。缠卵腺也是水产品加工的副产物之一,主要存在于头足类,与其生殖活动密切相关,目前也有一些文献注重对鱿鱼缠卵腺糖蛋白进行研究。

图4-29 虎斑乌贼和鱼卵(引自百度)
2.制备、分离及纯化
文献中对于虎斑乌贼肌肉、鱼卵、缠卵腺等糖蛋白的制备工艺仍然采用的是水提法、稀酸碱提取法和稀盐提取法。夏光华等(2014)采用水提法从鲫鱼卵中分离了水溶性糖蛋白。王倩等(2014a)采用响应面优化了鱿鱼缠卵腺糖蛋白的提取工艺,确定了其最佳工艺条件为,采用0.37mol/L的NaOH溶液在25℃下提取3.5h,该条件下提取率为12.79%,糖蛋白总糖和总蛋白含量分别为75.2%和22.7%,硫酸根为3.0%,所得糖蛋白是一种硫酸化的黏蛋白。戴宏杰(2015)采用稀盐法提取了虎斑乌贼肌肉糖蛋白,经响应面法优化确定了最佳工艺参数是:NaCl浓度3.8%、料液比20.78ml/g、提取时间1.48h、提取温度为66.03℃,该条件下糖蛋白得率为7.93%。对于这些糖蛋白的分离纯化也是采用的柱层析法。如研究人员采用QFF阴离子交换柱和S-200凝胶柱分离纯化了鲫鱼卵唾液酸糖蛋白,经高效液相凝胶色谱鉴定纯度为94.76%(夏光华,2014)。戴宏杰(2015)依次通过Sevage法脱除游离蛋白、硫酸铵分级沉淀、DEAE-52纤维素离子交换柱和Sephadex G-100分子筛柱层析得到了两种虎斑乌贼肌肉糖蛋白,高效液相凝胶色谱和SDS-PAGE电泳表明这两种多糖均为单一组分,纯度达到了电泳纯。
3.组成和结构
文献中对于刺参水煮液、虎斑乌贼肌肉、鱼卵、缠卵腺等糖蛋白组成和结构的分析与贝类糖蛋白和水母糖蛋白类似,也主要集中于氨基酸组成、单糖组成及连接方式方面。陈宁等(2015)对所得刺参水煮液糖蛋白的氨基酸进行了分析,其中含有18种氨基酸,8种是人体必需氨基酸,占氨基酸总量的38.38%;对其氨基酸营养价值评价表明,该糖蛋白与人体蛋白质氨基酸模式相比,组成较为均衡,且含量丰富,是高生物价蛋白质;PMP柱前衍生高效液相色谱法测定单糖组成分析表明,刺参水煮液糖蛋白含有氨基葡萄糖、甘露糖、氨基半乳糖、葡萄糖、半乳糖、岩藻糖等6种单糖。夏光华等(2014)对纯化得到的鲫鱼卵唾液酸糖蛋白的化学组成进行了分析,该糖蛋白的蛋白质含量为14.33%、己糖含量为62.81%、N-乙酰神经氨酸含量为19.72%,糖基部分由甘露糖、葡萄糖胺、半乳糖胺组成,物质的量比为7.61∶6.70∶1.00。戴宏杰(2015)通过β-消除反应确定了虎斑乌贼肌肉糖蛋白有O-糖肽键的存在,红外光谱表明其糖苷键类型为吡喃型。
4.生理活性
目前对于刺参水煮液、虎斑乌贼肌肉、鱼卵、缠卵腺等糖蛋白生理活性的研究主要集中在对骨质疏松症的改善作用方面,对于糖蛋白的抗氧化作用、抗疲劳作用以及免疫调节作用也有提及。骨质疏松是由于体内骨吸收强于骨形成而导致的慢性进行性疾病(Alcantara等,2011),这主要与骨重建过程中成骨细胞介导的骨生成和破骨细胞介导的骨吸收之间的平衡失调有关(Kaku等,2014)。王珊珊等(2014)通过切除大鼠双侧卵巢的方法建立了骨质疏松症大鼠模型,研究了鲫鱼卵唾液酸糖蛋白对骨质疏松症的改善作用。结果表明,鲫鱼卵唾液酸糖蛋白能够显著调节骨质疏松症大鼠骨代谢,抑制高骨转换速率,防止骨丢失。为了进一步研究鲫鱼卵唾液酸糖蛋白对骨质疏松症的改善作用,研究者探讨了其对成骨细胞和破骨细胞分化的调控作用。研究表明,鲫鱼卵唾液酸糖蛋白可能是通过提高OPG/RANKL的比值水平,达到促进成骨细胞的分化及骨形成的功能;抑制破骨细胞分化的作用可能是通过抑制NF-κB/MAPK/NFATc1通路基因的表达来实现的(贺敏,2014)。周晓春(2015)的研究表明,鲫鱼卵唾液酸糖蛋白能显著升高免疫低下小鼠血清溶血素水平,增强脾淋巴细胞增殖活力以及腹腔巨噬细胞吞噬能力,改善碳廓清能力并提高血清IFN-γ/IL-4水平,充分说明该糖蛋白具有良好的免疫调节能力。此外,还有一些研究表明,虎斑乌贼肌肉糖蛋白具有一定的抗氧化能力(戴宏杰,2015),鱿鱼缠卵腺MUCIN型糖蛋白具有较好的抗疲劳作用(王倩等,2014b)。
二、动物活性多肽
多肽是由多种氨基酸按照一定的顺序通过肽键结合而成的化合物,其分子结构介于氨基酸和蛋白质之间。目前由于各种简便、快速的多肽合成方法的发展,多肽研究发展非常迅速。我国科学家在多肽研究上也做出了卓越贡献,1965年首次完成了牛结晶胰岛素多肽类生物活性物质的合成(乔潇等,2015)。多肽具有溶解性好、免疫原性低、生物活性高等优点,因此可广泛应用于食品、化妆品、生物医药等领域。国际上的多肽类制品主要包括两大类:一类是多肽药品和试剂,另一类是以多肽功能因子的保健食品或普通食品和化妆品(孔令明等,2009)。海岸带动物多肽来源非常广泛,包括鱼类、贝类、海参、海蜇、海绵、海鞘、虾蟹等。其中,海岸带鱼类是获得生物活性肽非常重要的一类海岸带生物。王克坚等(2011)先后从我国重要海水养殖鱼类(大黄鱼、鲈鱼、广盐性罗非鱼等)中获得多个抗菌肽hepcidin基因,通过基因工程制备纯化后得到抗菌肽hepcidin,在实验动物鼠上进行急性毒性实验和遗传毒性实验,证明hepcidin无毒性;鱼蛋白酶解也是获得活性肽的一个常用途径,如从罗非鱼皮明胶酶解物可获得两个具有抗氧化活性的多肽,经鉴定分子量为317.33和645.21,氨基酸序列分别为Glu-Gly-Leu和Tyr-Gly-Asp-Glu-Tyr(Zhang等,2012)。贝类也是获得活性肽的一类很重要的海岸带动物,近年来,先后从翡翠贻贝、牡蛎、扇贝、波纹巴非蛤、紫贻贝中获得不同生理活性的多肽,包括抗肿瘤活性、血管紧张素转移酶抑制活性、抗氧化活性、抗菌抗病毒活性等(郑文文等,2011)。虾蟹是获得活性肽的又一类海岸带动物,目前从中也获得了种类繁多、活性多样的多肽。如从中国毛虾中可获得流感病毒神经氨酸酶抑制活性肽(王海涛等,2013)、血管紧张素转移酶抑制肽等活性肽(Cao等,2010);凡纳滨对虾虾头自溶获得降血压肽(朱国萍,2010);从青蟹、三疣梭子蟹中得到抗菌肽(郑兆祥,2012)等。此外,从海参、海蛇、海兔、海绵等海岸带动物中均可得到活性肽。从海地瓜(Acaudina molpadioidea)体壁酶解物中分离得到一种活性肽,具有良好的抑制血管紧张素转移酶活性(Zhao等,2009);海兔毒素是由4个氨基酸组成的线性缩肽类天然细胞毒性蛋白,具有很好的抗癌活性,目前已进入临床研究阶段(曹王丽等,2011)。针对海岸带生物活性肽来源广泛的特点,本文将以其来源为分类标准,分别介绍活性肽的来源、制备工艺、组成和结构、生理活性、应用等。
(一)胶原多肽
胶原多肽是胶原蛋白或明胶经蛋白酶等降解处理后得到的产物。它不具有胶原蛋白或明胶的特性,但是具有溶解性好、易消化吸收、生物活性高等优点,可作为活性成分广泛应用于食品、化妆品等领域。此处,我们提到了胶原蛋白、明胶和胶原多肽,这三种物质是既有联系又有不同的,图4-30是三者之间的关系图。通常胶原蛋白是具有三螺旋结构的,分子量可达到30万,但是水溶性很差;胶原蛋白若经过加热处理即可变为明胶,其中的三螺旋结构已被破坏,分子量为几万到几十万,明胶加热即溶于水;明胶进一步经蛋白酶定向酶解可得到胶原多肽,分子量为几百到几千,多肽水溶性很好,在冷水中即可溶解。胶原多肽也被称之为水解胶原蛋白、胶原蛋白水解物、胶原蛋白肽等,目前对其命名并没有统一的标准。

图4-30 胶原蛋白-明胶-胶原多肽关系图(周雪松,2013)
自1979年日本学者大岛等确认明胶来源的多肽具有抑制血压作用以来,大量研究表明胶原多肽具有多方面的生理功能,如抗氧化功能、护肤功能、增强骨密度功能、免疫调节活性、保护胃黏膜及抗溃疡作用等(郭瑶等,2006)。近年来,水生生物胶原多肽,其中包括海岸带动物胶原多肽,由于来源丰富、安全性高等优点受到广泛关注,目前市场上的胶原蛋白很大一部分是海岸带动物胶原多肽。
1.来源
海岸带动物胶原多肽的来源与海岸带动物胶原蛋白的来源类似,大多来源于水产品加工下脚料,如鱼类、贝类、海参、枪乌贼等的下脚料。此外,还发现少数研究对可口革囊星虫、多棘海盘车和黄海海燕胶原多肽进行了探讨。可口革囊星虫(Phascolosoma esculenta)隶属于星虫动物门,为我国土著种,主要栖息于潮间带、高潮区的泥滩内(周化斌,2006),具有丰富的营养成分和多种生理功能,不仅可以食用,而且还可以药用。多棘海盘车[图4-31(a)]为我国常见的海洋无脊椎动物,是中国北方最常见的海星之一,具有食用价值,其体壁含有丰富的胶原蛋白(耿浩等,2011)。黄海海燕[图4-31(b)]属海星纲有棘目海燕科,俗称海星,含有蛋白质、氨基酸、不饱和脂肪酸、微量元素和维生素等成分(李裕博等,2015)。它们是肉食动物,以扇贝、鲍鱼、海胆等为食,会对我国沿海经济水产养殖造成危害,通常海燕捕获后会作为废弃物被丢弃造成环境污染和资源的浪费(赵鑫等,2014)。

图4-31 多棘海盘车(a)和黄海海燕(b)外观形态(李裕博等,2015)
2.制备、分离及纯化
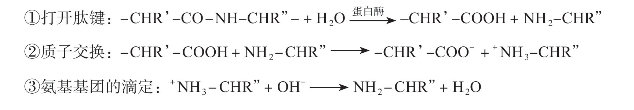
(1)制备方法:对于海岸带动物胶原多肽的制备主要采用的是蛋白酶酶解的方法。该方法主要是通过中性蛋白酶、碱性蛋白酶、胰蛋白酶、菠萝蛋白酶、木瓜蛋白酶、酸性蛋白酶、胃蛋白酶、风味蛋白酶、复合蛋白酶等商业用酶,在适宜条件下定向酶解胶原或明胶,把具有生理活性的肽片段释放出来,然后经过离心、除盐等方法即可得到胶原多肽。用该方法制备的胶原多肽一般不会导致营养成分的损失,也不会产生毒理上的问题,同时该方法能在温和的条件下进行,且易于控制水解进程,因而能够较好地满足多肽的生产需求。蛋白质酶解的过程如下(Calderon等,2000;庄永亮,2009):
目前市场上的蛋白酶种类繁多,并且酶的专一性决定了其只作用于特定的肽键,因此蛋白酶种类的确定是制备胶原多肽的关键步骤。它不仅影响最后产品的得率、风味和生理功能,而且也是实现工业化生产的决定性因素。通常,由不同的蛋白酶酶解得到的胶原多肽的分子量分布和生理活性均是不同的。任婷婷等(2010)探讨了不同蛋白酶于各自最适条件下对海参胶原水解度的影响,结果表明木瓜蛋白酶酶解海参胶原所得产物的水解度最大,为14.32%;胰蛋白酶水解所得产物的水解度最小,仅为6.00%。许丹等(2012)探讨了碱性蛋白酶、木瓜蛋白酶、胰蛋白酶和复合蛋白酶在最适宜条件下对鱿鱼皮胶原蛋白酶解效果的影响,结果表明胰蛋白酶的水解度最高(18.0%),产物的羟自由基清除率也比较高(67.5%);碱性蛋白酶产物的羟自由基的清除率最高(70.9%),但是水解度并不高(11.9%)。吴靖娜(2012)等以血管紧张素转移酶(ACE)抑制率和水解度为指标对罗非鱼鱼鳞明胶水解用酶进行了筛选,结果如表4-6,可以看出复合蛋白酶的水解度最高,酶解产物对ACE抑制效果也最好。此处所说的复合蛋白酶是由多种蛋白酶组成的,针对的酶切位点较多,因此通常能够得到水解度更高、活性更好的产物。虽然目前市场上也有商业用复合蛋白酶,但这种蛋白酶通常酶解效果还是有限的,在实际生产中通常将多种单酶复配成复合酶进行酶解。庄永亮(2009)探讨了海蜇胶原多肽单酶和复合酶酶解条件,结果表明胰蛋白酶最佳酶解条件为pH7.8、酶解温度为48.8℃、加酶量为3.5%,此时酶解物的羟自由基抑制率为71.87%,水解度为14.69%;碱性蛋白酶酶解条件为pH9.1、酶解温度为47.3℃、加酶量为2.8%,所得产物的羟自由基清除率为79.07%,水解度为17.89;复合酶的最佳水解条件为碱性蛋白酶和胰蛋白酶混合水解,温度48℃,加酶量分别为2.8%和3.5%,pH9.1,水解时间3h,该条件下水解产物的羟自由基抑制率为94.24%,水解度为24.32%。可以看出采用复配的蛋白酶酶解明胶,能够得到更好的酶解效果。目前除了采用商业酶对胶原进行酶解外,研究者也在不断开发新的蛋白酶用于胶原多肽的制备,以提高多肽的品质和生理活性。Khantaphant等(2008)从金线鱼幽门垂提取到一种蛋白酶,将其用于金线鱼皮明胶的酶解过程中,所得产物表现出较好的抗氧化活性。Karnjanapratum等(2014)从木瓜乳中分离到一种甘氨酰肽链内切酶,采用该酶酶解制备罗非鱼皮胶原多肽,多肽不仅表现较好的ABTS自由基清除活性,而且具有较好的口味。此外,酶解条件对产物的得率、品质和生物学功能影响也非常大,主要包括加酶量、酶解温度、酶解时间、pH和料液比等因素。因此,我们在对明胶酶解工艺进行探讨时,除了会考虑蛋白酶的选择外,也会将上述几个因素考虑在内。
表4-5 不同蛋白酶于最适条件下酶解罗非鱼鱼鳞明胶的酶解效果比较

发酵法也可用到胶原多肽的制备中。刘唤明等(2012)通过枯草芽孢杆菌发酵生产了罗非鱼皮胶原多肽,最佳发酵工艺为鱼皮含量3%,装液量90ml/250ml,接种量5%,接种时间14h,发酵时间52h,在此工艺下水解度高达36.88%,高于酶解法得到的水解度。因此可推断发酵法在胶原多肽的制备中具有一定的发展潜力。
明胶在酶解过程中非常容易产生苦味肽,是产品伴有苦味,这些苦味肽与胶原多肽的分子量类似,这使其去除成为多肽加工业的难题。因此,酶解液的脱腥脱苦处理是一个至关重要的问题,直接决定了多肽的品质。通常多肽的脱腥脱苦方法包括吸附法、包埋法、微生物发酵法等。这些方法能够脱去酶解液中的苦味肽,同时也会除去其中的部分胶原多肽,在实际应用中需要对条件进行控制。鉏晓艳等(2014)以多肽损失率为指标,确定采用β-环糊精包埋法对草鱼鱼鳞胶原多肽进行脱腥脱苦工艺研究,最佳包埋条件为:添加量4%、水浴温度70℃、水浴时间40min,此条件下脱腥脱色效果最好,多肽回收率为92.21%。刘培勇(2012)采用活性炭吸附法结合酵母发酵法对鲟鱼皮水解液进行脱腥处理,可得到澄清、浅黄色的无腥味且有淡淡香味的水解液。
酶解过程中通常会加入酸碱来调节pH,进而给酶解液带来大量的盐分,这些盐若不加以去除,会导致产品中灰分指标偏高,最终影响到产品品质。酶解液脱盐方法包括透析、超滤或纳滤、大孔树脂等方法。林谢凤等(2015)研究了纳滤膜对罗非鱼鳞胶原多肽脱盐性能的影响,结果表明700U的卷式纳滤膜能有效去除多肽液中的无机盐,浓度从13.9g/L降到0.04g/L。夏光华(2013a)等报道指出,采用DA201-C大孔吸附树脂对罗非鱼皮胶原多肽进行处理后,多肽回收率为81.16%,脱盐率为97.13%。
(2)分离纯化方法:一般来说,胶原或明胶经蛋白酶定向酶解后的产物为多肽混合物,为了多肽品质的提高及科研工作的需要,需对其进行分离纯化。胶原多肽的分离纯化方法主要包括超滤技术、色谱分离技术等,通过对酶解产物分离纯化能够得到所需要的目标肽段。
超滤技术是以选择性透过膜为分离介质,以静压差为推动力,利用机械筛分的原理,将原料中的溶剂和小于滤膜孔的小分子溶质透过膜成为滤出液或透过液,而大分子物质被截留,从而将不同分子量的多肽进行分离(穆利霞等,2013)。实验装置示意图如图4-32。它具有设备简单、常温操作、处理量大、处理时间短、无相变及化学变化、选择性高及能耗低等优点。但是超滤技术对多肽的分离度并不是太高,只适用于分子量相差比较大的多肽的分离。近年来,该技术广泛应用于胶原多肽的分离纯化过程中,其在胶原多肽的工业生产中也被广泛应用,大大提高了多肽的品质。刘亮等(2013)首先采用3000U的聚砜卷式超滤膜(底物浓度20g/L、pH7.0、压力0.2MPa、温度20℃)对鲟鱼胶原多肽进行精制,然后用纳滤膜(底物浓度25g/L、pH7.0、压力0.5MPa、温度20℃)进行脱盐处理,最后所得产物的蛋白得率为80%,脱盐率95.9%,短肽回收率96.2%,其中分子量1000以下的含量高达97.89%。郭洪辉等(2015)分别采用截留分子量5000U的超滤膜和纳滤膜对鱼皮胶原多肽进行分离,所得多肽分子量集中分布在100~1000之间。

图4-32 实验室超滤分离装置示意图(刘亮等,2013)
1.原料液槽 2.输液泵 3.压力表 4.超滤组件 5.流量计 6.循环阀 7.浓液阀 8.流量计阀
若需要将胶原多肽进行进一步分离纯化,可采用色谱分离技术。该技术是广泛应用于多糖、蛋白质及小分子次生代谢产物的一种分离技术,根据分离原理可分为离子交换色谱、凝胶过滤色谱、亲和色谱、吸附色谱等。目前在胶原多肽分离中应用最多的是凝胶过滤色谱和离子交换色谱技术。若对胶原多肽纯度要求更高的话,需结合高效液相色谱技术。Sun等(2013)依次采用SP-Sephadex C-25离子交换色谱、Sephadex G-25凝胶过滤色谱和反相高效液相色谱ZorbaxC18(9.4mm×250mm)从罗非鱼皮胶原多肽(分子量<2000)中分离到一个抗氧化肽,氨基酸序列为Leu-Ser-Gly-Tyr-Gly-Pro(592.26),对羟自由基的IC50为22.47μg/ml。Zhang等(2012)采用类似的方法从罗非鱼皮明胶酶解物中分离到两个抗氧化肽,氨基酸序列分别为Glu-Gly-Leu(317.33)和Tyr-Gly-Asp-Glu-Tyr(645.21),二者对羟自由基的IC50分别为4.61μg/ml和6.45μg/ml。Zhao等(2007)依次采用SP-Sephadex C-25离子交换色谱、Sephadex G-15凝胶过滤色谱和反相高效液相色谱Zorbax C18(1.0mm×250mm)从海参胶原酶解物中分离到一个分子量为840的ACE酶抑制肽,氨基酸序列为Glu-Asp-Pro-Gly-Ala,IC50为14.2μg/ml。
以鱼皮为例,胶原多肽的生产工艺流程如图4-33。其中的胶原多肽即是市场上经常见到的胶原蛋白产品,纯化的胶原多肽多用于多肽序列的分析。
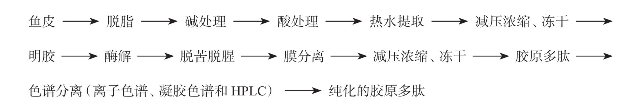
图4-33 鱼皮胶原多肽制备工艺流程(董玉婷等,2006)
3.组成和结构
胶原多肽也是由氨基酸组成的,目前对其组成和结构研究主要集中在分子量分布、氨基酸组成和序列等方面。
胶原多肽的分子量分布多采用高效液相色谱法进行测定。庄永亮(2009)以凝胶色谱柱(TSK gel 3000PWXL 300mm×7.8mm)为洗脱柱,以乙腈/水/三氟乙酸(50/50/0.1,V/V)为流动相,在波长220nm下测定了不同酶解方法所得海蜇胶原多肽的分子量分布。测定过程中首先通过标准品:细胞色素C(分子量12500)、胰岛素(分子量5734)、维生素B12(分子量1355)、马尿酸(分子量429.5)、谷胱甘肽(分子量309.5)做出相对分子量与出峰时间的标准曲线,然后记录样品的出峰时间,从标准曲线上即可得出样品的相对分子量。结果如图4-34。不同酶解方法所得海蜇胶原多肽的液相色谱图中均有4个连续的洗脱峰,表明多肽的分子量分布是连续的;不同酶解方法所得胶原多肽的分子量分布是不同的,胰蛋白酶和碱性蛋白酶分别单独水解时多肽的平均分子量是2000,二者混合使用时平均分子量为700,表明复合酶解法更容易得到小的肽段。
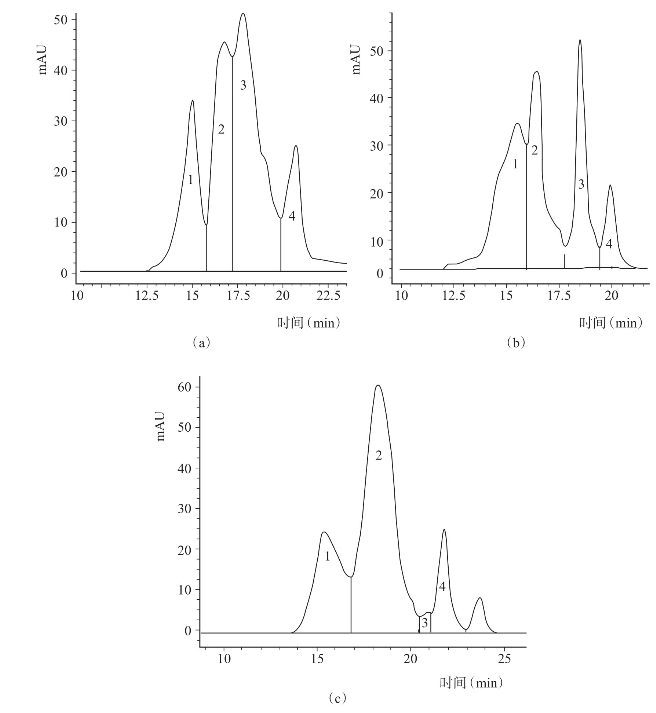
图4-34 不同酶解方法所得海蜇胶原多肽高效液相色谱图
(a)胰蛋白酶水解(b)碱性蛋白酶水解(c)碱性蛋白酶和胰蛋白酶混合水解
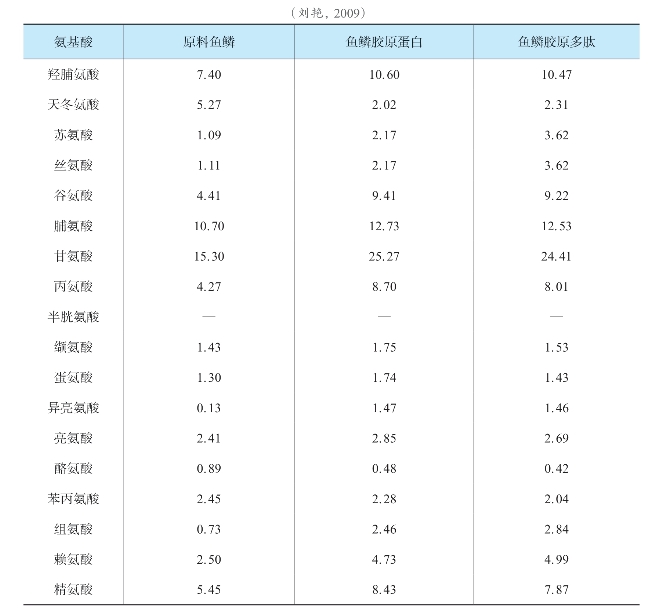
胶原多肽的氨基酸组成分析与胶原蛋白的类似,也是应用氨基酸分析仪确定其中的氨基酸种类和含量。刘艳(2009)测定的草鱼鱼鳞胶原多肽的氨基酸组成如表4-6。可以看出草鱼鱼鳞胶原多肽氨基酸组成与胶原蛋白组成类似,甘氨酸含量约为25%,羟脯氨酸含量为10.6%,脯氨酸含量为12.7%,符合Ⅰ型胶原蛋白的特征。Zhao等(2007)从海地瓜酶解液中分离得到的一种抑制ACE酶活性的胶原多肽,氨基酸分析表明Glu,Asp,Pro,Gly和Ala是主要氨基酸,占总氨基酸的91.97%。其中Glu含量最高,为26.27%,这可能是该多肽具有抑制ACE酶活性的重要原因;Gly含量为21.35%,比较符合Ⅰ型胶原蛋白的特征。因此,一般来说胶原多肽的氨基酸组成还是具有某些胶原蛋白氨基酸组成的特点的。
表4-6 草鱼鱼鳞胶原多肽氨基酸组成(%)
注:—表示未检出
通俗一点讲,氨基酸序列就是蛋白质的一级结构,可见氨基酸序列对蛋白质的重要性,通过氨基酸序列可推断蛋白质的结构和生理功能。对于蛋白质氨基酸序列的测定通常采用质谱法,包括串联飞行时间质谱(MALDI-TOF/TOF-MS)、电喷雾四极杆飞行时间质谱(ESI-Q-TOF-MS)、电喷雾离子阱质谱(ESIIT-MS)和傅立叶变换离子回旋共振质谱(FTICR-MS)(贾韦韬等,2007)。Zhang等(2012)采用电喷雾四极杆飞行时间质谱分析了罗非鱼皮胶原抗氧化肽的氨基酸序列。图4-35为所得质谱图。结合数据库分析表明多肽的氨基酸系列分别为Glu-Gly-Leu和Tyr-Gly-Asp-Glu-Tyr。马鲛鱼皮(Khiari等,2014)、日本比目鱼皮(Himaya等,2012)、鱿鱼被膜(Alemán等,2011a)、黑乳海参(陈娟娟,2013)、鮰鱼皮(张效荣,2013)等胶原多肽均可通过此方法测定出氨基酸序列。
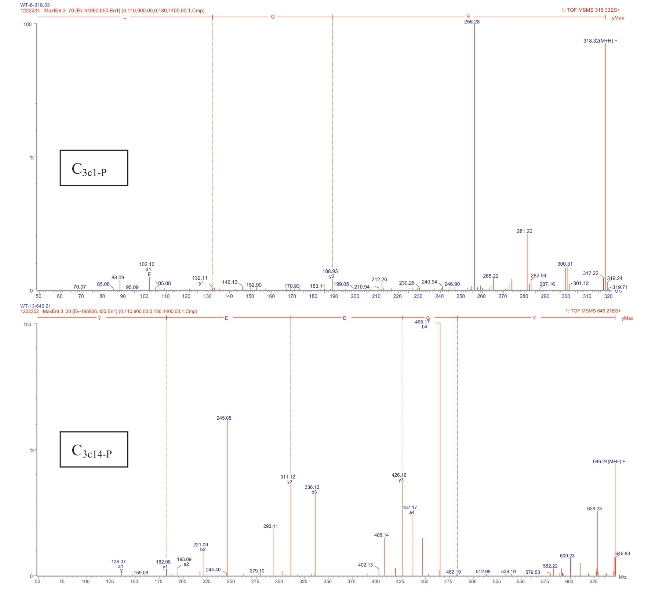
图4-35 罗非鱼皮胶原抗氧化肽ESI-Q-TOF-MS图谱
(Zhang等,2012)
4.生理活性
Ohara等(2007)研究表明,鱼类来源的胶原多肽比猪皮来源的口服吸收利用率高,因此近年来,鱼源胶原多肽逐渐受到人们的关注,已成为食品领域和医药领域的研究热点。胶原多肽若要在食品和医药领域得到广泛应用,其生理活性如何是一个至关重要的问题,因此胶原多肽的生理活性研究一直是多肽领域研究的一个非常活跃的方向。实际上,不仅鱼类含有胶原蛋白,其他海岸带动物如海蜇、海参、柔鱼、枪乌贼等都含有丰富的胶原蛋白,因此本部分内容将主要针对海岸带动物胶原多肽的生理活性进行详细探讨。
(1)抗氧化活性:人体内有多种自由基,过多的自由基可损伤机体内生物大分子,进而影响细胞正常的结构和功能,对人体危害非常大。研究表明,胶原多肽具有很好的抗氧化活性。在鮟鱇鱼皮(马华威等,2014)、鲍鱼内脏(朱芳骞,2012)、海参(赵芹,2008;崔凤霞,2007)、海蜇(丁进锋等,2012;Ding等,2011)、鲢鱼鱼鳞(陈日春,2013a)、罗非鱼皮(夏光华等,2012;Vo等,2011;Choonpicharn等,2015)、柔鱼鱼皮(陈小娥等,2010)、鱿鱼皮(Giménez等,2009a;Mendis等,2005;Alemán等,2011b)、军曹鱼皮(Yang等,2008)、金线鱼皮(Khantaphant等,2008)、日本比目鱼皮(Himaya等,2012)等中发现的胶原多肽均表现良好的抗氧化活性。马华威(2014)等选取铁离子还原体系和O2-、DPPH、·OH自由基清除体系评估了鮟鱇鱼皮胶原多肽的体外抗氧化效果,发现该胶原多肽对·OH自由基清除能力高于茶多酚、BHA和抗坏血酸,对DPPH自由基的清除能力好于BHA;进一步的D-半乳糖诱导的亚急性衰老小鼠实验表明,该胶原多肽(分子量<2000)能够显著提高皮肤中SOD、GSH-Px、CAT活性,抑制MDA的生成;体外和体内实验均证实了鮟鱇鱼皮胶原多肽的抗氧化活性。陈日春等(2013b)也通过体外自由基体系和体内动物实验,证实了鲢鱼鱼鳞胶原多肽的抗氧化活性。Vo等(2011)的研究表明,从罗非鱼明胶水解物中分离到的一种降压肽,能够降低小鼠胶质细胞中自由基诱导的细胞和DNA损伤。
目前,对于胶原多肽的抗氧化活性的具体的构效关系还不是十分清楚,但是发现其与多肽的分子量分布、氨基酸组成和序列等密切相关。Yang等(2008)通过蛋白酶酶解法获得军曹鱼皮明胶水解物,分子量分布在6500~7000,经超滤后分离出<3000的多肽,发现其抗氧化活性得到了明显提高,充分说明了多肽分子量分布对其抗氧化活性影响显著,并且分子量越低的多肽越容易表现较好的抗氧化活性(Li等,2013)。氨基酸组成对多肽抗氧化活性的影响也是非常显著的。前人研究结果表明,芳香族氨基酸(苯丙氨酸、酪氨酸和色氨酸)由于分子中含有酚羟基,容易表现较好的清除自由基活性,其他的氨基酸如组氨酸、脯氨酸、丙氨酸、亮氨酸和缬氨酸等对多肽的抗氧化活性的发挥也有一定贡献。Mendis等(2005)从巨型鱿鱼皮明胶水解物中分离到两个抗氧化肽,氨基酸序列分别为Phe-Asp-Ser-Gly-Pro-Ala-Gly-Val-Leu(880.18)和Asn-Gly-Pro-Leu-Gln-Ala-Gly-Gln-Pro-Gly-Glu-Arg(1241.59)。可以看出,两个多肽中均含有较多的抗氧化氨基酸,如Pro,Phe,Ala,Val,Leu。氨基酸序列在多肽抗氧化活性中也发挥着重要作用。一般来说,N端或C端存在含苯环的氨基酸残基或亮氨酸残基,则多肽易表现较好的抗氧化活性;Gly-Leu,Gly-Pro序列的存在也能促使多肽表较好的抗氧化活性。张玉峰(2013)从罗非鱼皮明胶酶解物中分离到两个抗氧化肽,氨基酸序列分别为Glu-Gly-Leu和Tyr-Gly-Asp-Glu-Tyr,可见这两个多肽在氨基酸序列上符合上述特征。
(2)降血压活性:高血压是一种对人类危害极大的疾病,潜伏期很长,早期一般没有不适症状,极容易被忽视。目前我国已成为世界第一大高血压患病率国家,患者已达1.6亿人,其危害仅次于肿瘤。因此治疗和防治高血压病是当今社会普遍关注的热点课题(赵元晖,2006)。研究发现胶原多肽具有良好的降血压活性。林琳等(2010)采用两肾一夹型建立肾血管性高血压大鼠模型,研究了鱿鱼皮胶原多肽(分子量<2000)的降血压活性,结果表明该胶原多肽能够显著降低模型大鼠的动脉血压和血浆中的血管紧张素Ⅱ的水平,表现出较好的降血压效果。宋华曾等(2014)通过原发性高血压大鼠研究了鮰鱼皮胶原多肽(分子量<3000)的降血压效果,结果表明300mg/kg·bw剂量的多肽灌胃2h后,大鼠血压由27kPa(206mmHg)降到21kPa(159mmHg);大鼠经长期灌胃10d后,血压一直保持在20kPa(155mmHg)左右;同时,该胶原多肽对正常大鼠的降血压作用不显著。
胶原多肽的降血压活性可能主要与其抑制血管紧张素转移酶(ACE酶)的活性有关。ACE酶是一种含锌二肽羧基肽酶,能将血管紧张素Ⅰ(AngⅠ)转换为血管紧张素Ⅱ(AngⅡ),同时降解缓激肽使之失活,具有升高血压的作用(韩佳冬等,2012)。因此,抑制ACE酶活性即可达到降血压的目的。在红非鲫鱼皮(曾名勇等,2007)、鮰鱼皮(张效荣,2013)、海地瓜(赵元晖,2006)、罗非鱼皮(Choonpicharn,2015)和鱼鳞(吴靖娜等,2012)、鱿鱼皮(Lin等,2012;Alemán等,2011a)明胶酶解物中都发现了具有抑制ACE酶活性的胶原多肽。赵元晖(2006)在海地瓜明胶酶解物中得到一个ACE酶抑制肽,分子量分布在410~950之间,IC50为0.0142mg/ml。张效荣(2013)从鮰鱼皮明胶酶解物中分离得到了两个ACE酶抑制肽,分别为FTHNGYLNA(817.37)和SNTRVSAHKHCGSYLIIN(1797.95),IC50分别为0.3041mg/ml和0.8064mg/ml。Vo等(2011)纯化到一个罗非鱼ACE酶抑制胶原多肽,其氨基酸序列为DPALATEPDPMPF(1382),IC50为62.2μmol/L。
(3)护肤活性:众所周知,胶原蛋白是皮肤的重要组成部分,研究发现由其酶解得到的胶原多肽具有很好的护肤活性,主要表现为抑制酪氨酸酶活性、延缓衰老等。
酪氨酸酶是以Cu2+为活性中心的金属酶,与皮肤中的黑色素合成密切相关。它是黑色素生物合成的关键酶和限速酶,不仅决定黑色素合成的速度,而且是黑色素细胞分化成熟的特征性标志(庄永亮,2009)。因此,抑制黑色素生成最常见和最有效的方法就是抑制酪氨酸酶活性。研究表明,黄河鲤鱼鳞(肖枫,2014)、海蜇(Zhuang等,2009a)、日本刺参(王奕等,2007a)等胶原多肽均具有很好的抑制酪氨酸酶的活性。对于胶原多肽对酪氨酸酶活性的抑制机理可以从酪氨酸酶催化形成黑色素的过程来解释。一方面,在酪氨酸氧化形成黑色素的反应中,必须有氧自由基的参与,氧自由基引发反应后经酪氨酸酶催化,酪氨酸被逐步氧化,最终产生黑色素(Yamamura等,2002)。另一方面,酪氨酸酶需要磷酸化才能表现出氧化催化的功能,这需要蛋白激酶A的结合亚基与cAMP结合才能实现。cAMP是细胞内重要的第一信使,起着将细胞外刺激信号转化为细胞内各种生理活动的媒介作用(庄永亮,2009)。肖枫(2014)以小鼠B16黑色素瘤细胞为模型研究了黄河鲤鱼鳞胶原多肽(分子量<1000)的酪氨酸酶抑制活性,结果表明该胶原多肽能够显著降低细胞中酪氨酸酶活性,同时增加细胞中GSH含量及降低GSSG含量,并降低cAMP的含量,推测黄河鲤鱼鳞胶原多肽对酪氨酸酶抑制活性是通过清除氧自由基和降低细胞第一信使——cAMP来实现的。
随着年龄的增长,人体合成胶原的能力逐渐降低,造成胶原流失,这样真皮层的胶原纤维网络结果发生变形、断裂,导致皮肤出现松弛、皱纹等老化现象(尹利端等,2013)。研究表明,胶原多肽具有很好的延缓皮肤衰老的活性。王奕(2007b)以紫外线诱导的光老化小鼠为模型研究了日本刺参胶原多肽和鱿鱼皮胶原多肽对皮肤的保护作用,结果表明这两种多肽均能显著清除体内羟自由基和超氧阴离子自由基,提高SOD,GSH-Px,CAT活性,降低MDA含量,显著提高皮肤中总羟脯氨酸含量,并能有效改善小鼠皮肤胶原纤维的受损程度(图4-36)。还有一些研究(陶宇,2012;Zhuang等,2009b)针对沙海蜇胶原多肽对紫外线诱导的光老化小鼠皮肤的保护作用进行了探讨,结果表明沙海蜇胶原多肽也能够抑制紫外线照射引起的小鼠皮肤胶原蛋白和水分的流失,提高皮肤组织中抗氧化酶SOD,GSH-Px,CAT的活性,有效改善紫外线照射引起的小鼠皮肤组织紊乱,从而对小鼠皮肤表现很好的保护作用。陈俊等(2015)研究表明,罗非鱼皮胶原酶解物能够通过促进人皮肤角质细胞的增殖来达到延缓皮肤衰老的作用。

图4-36 光老化小鼠皮肤组织的VanGieson染色图片(×200)
(引自王奕,2007)
(a)正常对照组,小鼠皮肤真皮层胶原纤维为红色,分布均匀,方向大致与皮肤表面平行,呈波浪状 (b)模型对照组,胶原纤维明显减少,且排列紊乱,出现断裂、破碎、卷曲扭结、聚集成团现象 (c)日本刺参胶原多肽低剂量组(25mg/ kg·bw),胶原纤维明显多于模型组,但排列不规则 (d)日本刺参胶原多肽中剂量组(50mg/kg·bw),胶原纤维排列变得规整,可见新生纤维和残存纤维之间的明确分界 (e)日本刺参胶原多肽高剂量组(100mg/kg·bw),胶原纤维分布均匀,排列规则,与正常对照组接近 (f)鱿鱼皮胶原多肽低剂量组(25mg/kg·bw),胶原纤维稀疏,有断裂、破碎现象 (g)鱿鱼皮胶原多肽中剂量组(50mg/kg·bw),胶原纤维断裂、破碎、稀疏现象有所改善,可见完整的波浪状纤维 (h)鱿鱼皮胶原多肽高剂量组(100mg/kg·bw),胶原纤维分布均匀,排列规则,少有断裂、破碎,未出现卷曲扭结,与正常组接近
此外,胶原多肽的护肤作用还表现在改善皮肤水分性能、促进皮肤伤口愈合等方面。王宁等(2015)以罗非鱼皮胶原低聚肽和透明质酸复配成了一种口服保健食品,对其改善女性皮肤水分性能进行了研究。结果表明,年龄30~50岁的女性每天口服2.5g,连续30d,皮肤水分性能有显著的改善作用,皮肤含水量由试验前的8.90%±1.11%提高到12.34%±2.23%。祝婧(2014)研究表明,海鲈鱼胶原多肽能够促进伤口肉芽组织的形成,加速胶原形成,减少炎症反应,从而加速皮肤伤口的愈合,其机制可能是通过上调促血管生成因子胰岛素样生长因子-l(IGF-l)和成纤维细胞生长因子-2(FGF-2)的水平,从而提高小鼠皮肤伤口的愈合速度和愈合质量。
(4)免疫调节活性:免疫器官是免疫细胞分化和增殖的场所,包括骨髓、胸腺、脾脏、淋巴结等器官(曾丽等,2013)。其中胸腺在免疫系统中占有极其重要的地位,它是T细胞分化和发育成熟的主要场所;脾是机体最大的外周免疫器官,是机体进行免疫应答的主要场所(戎汩,2012)。通常二者重量指数可客观地反映机体免疫器官的运行状况。免疫细胞是指参与免疫应答或与免疫应答相关的细胞,包括粒细胞、单核巨噬细胞、NK细胞、T细胞、B细胞等。研究表明,胶原多肽具有一定的免疫调节活性。王凤林等(2011)采用环磷酰胺为免疫抑制剂获得了免疫功能低下的小鼠模型,经灌胃暹罗鳄鱼鳞胶原多肽后,小鼠T淋巴细胞的增殖活性和NK细胞的杀伤活性得到明显增强,并呈剂量依赖性。丁进锋等(2011)研究表明,高剂量海蜇胶原多肽(100mg/kg·bw)能明显提高小鼠碳廓清指数、吞噬指数和脾脏指数,并促进T淋巴细胞的增殖。此外,霞水母(Deng等,2009)和鲶鱼皮(马俪珍等,2008)胶原多肽均具有免疫调节活性。
(5)其他生理活性:胶原多肽的生理活性多种多样,针对海岸带动物胶原多肽的生理活性还包括与金属离子的螯合作用、对肝损伤的保护作用、抗疲劳和对类风湿性关节炎的抑制作用等。研究表明,罗非鱼皮胶原多肽能够与钙离子发生螯合反应形成稳定的螯合物,螯合率最高可到78.04%(夏光华等,2013),这种胶原多肽具有一定的补钙作用,对于骨质疏松症的改善是非常有利的。酒精性肝损伤是一种较为普遍的世界性疾病。李林格等(2014)研究表明,大鲵皮胶原多肽具有保护酒精诱导的小鼠肝损伤的作用,具体表现为抑制乙醇诱导产生的血清中谷草转氨酶(AST)和谷丙转氨酶(ALT)活性,抑制肝组织中SOD活性下降及MDA含量升高;从组织病理也可以看出,胶原多肽组肝细胞排列规则、肝索清晰。林丹等(2010)研究发现,霞水母胶原多肽能够改善机体能量代谢,加速肝糖原分解供能,减少蛋白质和含氮化合物的分解,从而表现一定的抗疲劳作用。此外,许丹的研究表明,鱿鱼皮胶原多肽能够抑制类风湿性关节炎成纤维样滑膜细胞的增殖,从而表现一定的对类风湿性关节炎的抑制作用(许丹,2012)。
总之,目前对胶原多肽生理活性的研究很多,但是大部分研究集中在深海动物胶原多肽上,如鳕鱼等。目前,也开展了一些关于海岸带动物胶原多肽的研究,但是对其部分生理活性的研究并不全面,也不深入,如增强骨密度、对肝损伤的保护作用、抗疲劳和对类风湿性关节炎的抑制作用等。今后应对海岸带动物胶原多肽的这些生理活性进行系统研究,以促进该类多肽在实际生活中的应用。
5.应用
(1)在食品领域的应用:胶原多肽不含有色氨酸,从氨基酸组成上来看它是一种不完全蛋白质,无法提供人体必需氨基酸。但是胶原多肽具有抗氧化、降血压、护肤、免疫调节等众多的生理功能,以及高度可溶性、稳定性、易吸收性等性质,这些特性决定了胶原多肽可以作为活性成分添加到食品中,赋予食品一定的功效。目前市场上的水生生物胶原多肽食品已有很多,功效主要集中在护肤和补钙两方面,这些胶原多肽一部分来源于鳕鱼、三文鱼等深海鱼类的鱼皮,另一部分主要来源于一些海岸带动物,其中罗非鱼皮、鱼鳞是来源最为广泛的。“百福美”系列产品所用的胶原多肽即来源于罗非鱼皮、鱼鳞。
此外,一些研究还对海岸带动物胶原多肽在水产品、肉制品和食品包装膜上的应用进行了探讨。Nikoo等(2015)研究表明,史氏鲟鱼皮明胶酶解物能够延缓鱼肉中脂质和蛋白的过氧化,并表现抗冻效应。还有研究表明,乌贼皮明胶水解物能够抑制土耳其香肠中的脂质过氧化(Jridi等,2014)。Giménez等(2009b)研究表明,鱿鱼皮明胶水解物可添加到明胶膜中,以提高其抗氧化性能;Nuanmano等(2015)研究发现,罗非鱼皮明胶酶解物可作为鱼肌纤维蛋白膜的增塑剂,提高膜的力学性能。这些研究均表明,海岸带动物胶原多肽在水产品和肉制品的保藏上以及食品蛋白包装膜上具有一定的应用前景,但是目前市场上并没有类似产品,因此后续应针对这两方面的应用进行深入研究。
(2)在化妆品领域的应用:胶原多肽在化妆品中具有非常广泛的应用,美国CTFA化妆品原料手册录用的天然物质和《功能性化妆品原料》中,都有胶原蛋白或其水解产物(裘炳毅,1997;张铭让等,2000)。胶原多肽在化妆品的功效概括起来包括营养性、修复性、保湿性、配伍性、亲和性等。目前,对于海岸带动物胶原多肽在化妆品中的应用也有一些研究报道。刘艳(2009)将草鱼鳞胶原多肽添加到护肤霜中,发现多肽添加量越大膏体越细腻,同时起泡性也越强,添加量≥0.5%时,护肤霜膏体中形成较多的细小气泡,且需要很长时间才能慢慢消除;以0.5%的胶原多肽制备的护肤霜具有良好的耐热、耐寒性能,离心测试也未出现分层。刘克海等(2008)将鱿鱼皮胶原多肽添加到营养保湿乳中,经检验乳液卫生、感官和理化指标均符合中华人民共和国轻工行业有关标准。目前,在化妆品中应用最为广泛的一类海岸带动物胶原多肽就是罗非鱼皮、鱼鳞胶原多肽,法国、意大利和其他一些欧洲国家生产的化妆品和香水均添加了该类多肽。
一般来说,化妆品中胶原多肽分子量范围是1000~5000,最佳范围是700~1000,目前市场上的胶原多肽分子量大部分在3000左右(郭兆峰等,2010),与化妆品中的要求还有差距。今后应多开发化妆品用胶原多肽,并对其透皮吸收性和护肤生理活性有一个全面的研究,以便于胶原多肽更好地在化妆品中发挥功效。
(二)动物来源的肽类化合物
自1980年Ireland等从海鞘中发现具有抗肿瘤活性的环肽Ulithiacyclamide以来,不断有环肽从此类海洋生物中发现。最令人瞩目的是从加利福尼亚海域及加勒比海中群体海鞘Trididemnum solidum中分离出的3种环肽类化合物Didemnin A~C,它们都具有体内和体外抗病毒和抗肿瘤活性。体内筛选结果表明,Didemnin B的活性最强,较环孢霉素A强1000倍,具有强烈的抗P388白血病和B16黑色素瘤活性,美国NCI正进行它的抗肿瘤Ⅱ期临床研究。Didemnin B可连接分子量36000的糖蛋白,它的编码基因与棕榈酰蛋白硫酯酶(PPT)相似,提示Didemnin B可作为治疗基因突变引起婴儿性神经脂褐素症的潜在药物,有望成为一种新型的抗肿瘤药物。
Dehydrodidemnin B(Aplidine)是从被囊动物Aplidium albicans中分离出来的,是Didemnin B的类似物,能抑制DNA的复制和蛋白质的合成,阻滞细胞周期中G1-G2期,特别是它能抑制鸟氨酸脱羧酶,抑制白血病细胞血管内皮生长因子的表达,并阻断其受体的自分泌环,而且它的细胞毒作用对增殖细胞有明显的选择性。PharmaMar公司对它的研究已经进入Ⅲ期临床试验。
海绵的长久不腐烂现象提示人们,在海绵的体内存在极强的细胞毒性物质。源自海绵的多肽也很多,如Papuamides,Arenastatin A,Haliclamide,Halicylindramides,Geodiamolides,Theonellapepto-lides,Cyclolithistide,Jaspamide,Neosiphoniamolide A等。其中Jaspamide和Geodiamolides A,B是从海绵目中分离得到的环肽成分,具有显著的细胞毒活性。
从印度海兔(Dolabella auricularia)中分离到10种细胞毒性环肽Dollabilatin 1~10。其中Dollabilatin 10能使肿瘤细胞微管解聚并凋亡,对B16黑色素瘤治疗剂量仅为1.1μg/ml,是目前已知活性最强的抗肿瘤化合物之一。Pettit小组从海兔Dolabella auricularia中分离得到的Dolastatins系列化合物中发现抗癌活性单体Dolastatin 10具有抑制L12310小鼠白血病细胞生长、抑制肿瘤细胞的微管聚合作用,是一类新型强效的微管蛋白结合化合物,作为抗胰腺癌、前列腺癌、肺癌、皮肤癌、结肠癌、肝癌、乳腺癌和淋巴系统肿瘤用药,Dolastatin 10已进入Ⅱ期临床研究。Dolastatin 11具有很好的细胞生长抑制活性,而且对肌动蛋白也有较强的作用,研究人员对其进行了系统的研究。Dolastatin 11已在NCI进行临床前研究。最新研究发现Dolastatin 15有着不同于Dolastatins 10和11的抗肿瘤作用,目前Dolastatin 15已用于临床研究,其结构修饰产物LU103793(NSC D-669356)在欧洲已经开始癌症I期临床实验,在美国已经开始Ⅱ期临床实验。新近的研究表明,Dolastatins可作为进一步开发的抗癌药物资源。
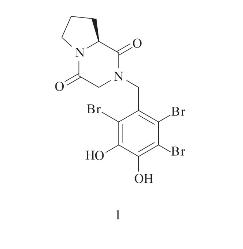
从中国青岛小实藻属Symphyocladia latiuscula分离得到溴苯酚和二肽类化合物(1)(Xu,2012)。
从新西兰书海绵分离得到的肽类化合物Mycalamide E(2),能有效地抑制蛋白质合成。从斐济西西亚岛Melophlus分离得到的aurantoside K(3),具有抗真菌活性。从昆士兰库拉索岛绣球海绵属海绵提取得到IotrochamidesA(4)和B(5),它们能选择性地抑制布氏锥虫(Kumar,2012;Feng,2012)。
从马莱塔岛Theonella swinhoei的次级代谢产物中分离得到5个肽类化合物perthamides G~K(6~10),它们都有消炎作用(Festa,2012)。从澳大利亚海绵Neamphius huxleyi中分离得到3个肽类化合物neamphamides B~D(11~13),它们都是强效的非选择性细胞毒素(Tran,2012;Yamano,2012)。
从所罗门群岛瓜达康纳尔岛海绵Pipestela candelabra中分离得到3个由NRPS-PKS共同催化合成的肽类化合物pipestelides A~C(14~16)(Sorre,2012)。
从巴哈马群岛海绵Caribbean stylissa中分离得到肽类化合物Didebromonagelamide A(17)。从澳大利亚湾一株海绵中分离得到3种肽类化合物(18~20)(Zhang,2012);从毛里求斯海绵donnani中提取得到肽类化合 物donnazoles A(21)和B(22)(Mnnoz,2012)。
从一株澳大利亚坎贝尔港采集的类角海绵属海绵Pseudoceratina sp.中分离得到肽类化合物(23)(24)(Kouakota,2012),purealins B~D(25~27)(Kobayashi,1995),purealidin R(28)(Cimino,1983),aerophobin(29)和外消旋化合物purealin(30)(Salim,2012)。

从印度尼西亚巴厘岛线虫Aplysinella strongylata提取得到了21个肽类化合物psammaplysin variants(31~51),其中化合物367对恶性疟原虫有抑制作用(Mudianta,2012)。
从日本冲绳岛海绵Halichondria sponge分离得到两个肽类化合物Halichonadins K(52)和L(53)(Tanaka,2012),通过X-ray单晶衍射和化学互变现象确定了该化合物的绝对构型。

免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




