甾体化合物也叫类固醇化合物,广泛存在于动植物组织中,是一类重要的天然产物,其中大多数具有重要的生理作用。这类化合物的分子都具有一个环戊烷多氢菲的基本骨架。除骨架外,绝大多数甾体化合物还含有三个侧链,其中,10位和13位分别是两个甲基,称为角甲基,17位上连有一个较长的侧链,一般还含有官能团(图3-22)。
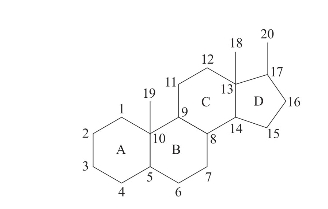
图3-22 甾体化合物
甾体(steroids)是一类结构非常特殊的天然产物,其分子母体结构中都含有环戊烷多氢菲(cyclopentano-perhydrophenanthrene)碳骨架,此骨架又称甾核(steroid nucleus)。甾体化合物是天然产物中最广泛出现的成分之一,几乎所有生物体自身都能生物合成甾体化合物。天然甾体化合物种类很多、结构复杂、数量庞大、生物活性广泛,是一类重要的天然有机化合物。甾体化合物的提取分离、合成以及应用研究已成为药物开发十分活跃的领域,被称作20世纪研究最为透彻的药物。
甾体类物质在海岸带中分布很广,含量也很高(Kim等,2012)。在海洋无脊椎动物、海绵、肠腔动物、棘皮动物以及海藻中均普遍存在。在陆地植物中,甾体分布面比较窄,如强心苷主要分布在夹竹桃科,麦角甾醇类主要分布在菌类中,植物一般很少。海洋中甾体的类型更为丰富,侧链变化也多;海洋甾体的氧化度更高,经常具有多个羟基或羰基,此外还经常有磺酸基团,使得海洋甾体更具有开发价值;海洋甾体经常和含氮的物质连接,从而构成甾体生物碱。
一、海绵来源的甾体化合物?
从海绵中分离得到的化合物1~6,具有抗肿瘤活性、抑酶活性、抗真菌活性、抗病毒(包括HIV)活性等(El Sayed等,2000)(图3-23)。

图3-23 海绵中分离到的甾体化合物
从海绵中分离得到,双甾体结构,含有4个醚键,具有抗肿瘤活性(El Sayed等,2000)(图3-24)。
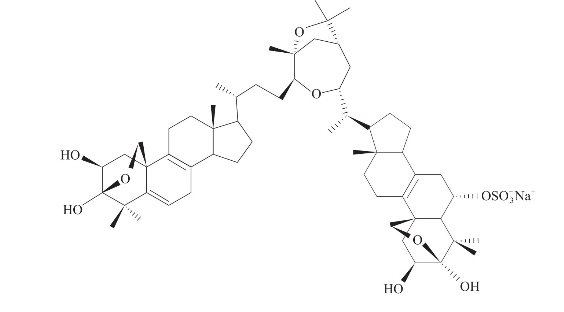
图3-24 海绵中分离到的双甾体化合物
南非印度洋的海洋蠕虫体内发现的吡嗪双甾体,具有显著抗肿瘤活性(El Sayed等,2000)(图3-25)。
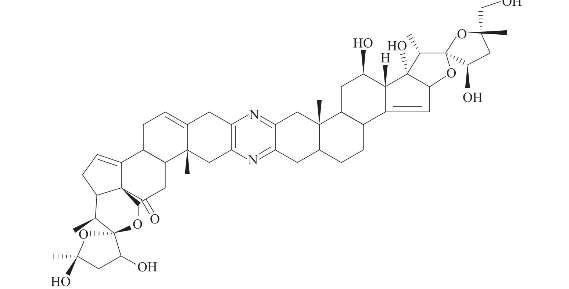
图3-25 海绵蠕虫体内发现的吡嗪双甾体
从菲律宾海域的海绵Xestospongia sp.中分离得到,具有抗HIV活性(El Sayed等,2000)(图3-26)。
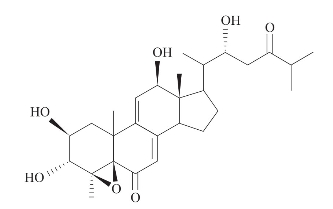
图3-26 从菲律宾海域海绵分离到的甾体化合物
从红海海绵Nephthea.sp.中分离得到,有抗结核作用(El Sayed等,2000)(图3-27)。
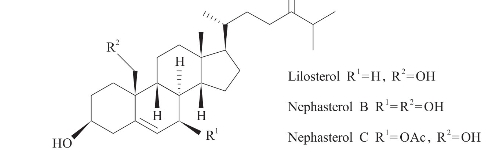
图3-27 从红海海绵分离到的甾体化合物
从一种海星Aphelasterias japonica.中发现,具有溶血活性(Finamore等,1992)(图3-28)。
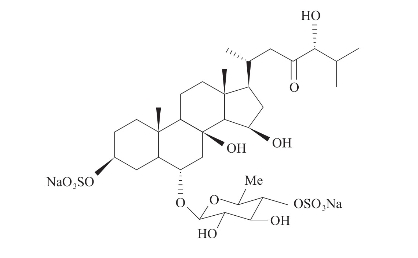
图3-28 从海星中发现的甾体化合物
Tung等(2009)从越南海绵Ianthella sp.的甲醇提取液中分离得到aragusteroketal B(a)和aragusterol B(b),其中化合物a是一种新的C29甾醇,在化合物支链的C25和C26位上有一个环丙烷结构(图3-29)。2种化合物对3种人乳腺癌细胞(MCF-7)、人肝癌细胞(SK-Hep-1)和人宫颈癌细胞(HeLa)均显示出较好的抑制活性,IC50在12.8~27.8 μmol/L之间。
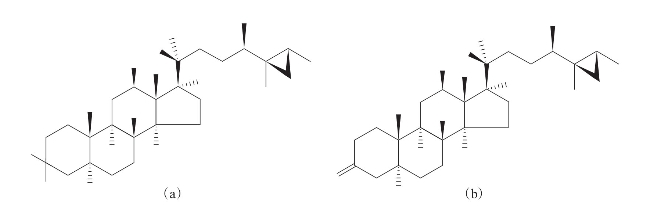
图3-29 甾体化合物aragusteroketal B(a)和aragusterol B(b)
Zhang等(2007)从中国南海海域的海绵Halichondriarugosa的乙醇提取物中得到2个甾体硫酸钠盐24ε,25-dimethyl-3H-hydroxyl-cholest-5-ene-2β-ol sodium sulfate(a)和24ε,25-dimethyl-cholest-5-ene-2β,3α-diol disodium sulfate(b),2种化合物对人肝癌细胞(BEL-7402)、结肠癌细胞(HT-29)、肺腺癌细胞(SPC-A1)和人胶质瘤细胞(U-2514)均显示一定的细胞毒作用,IC50在6.5~23.1μmol/L之间(图3-30)。

图3-30 从海绵提取物中得到的甾体硫酸钠盐
Holland等(2009)从澳大利亚纳尔逊湾的海绵Psammoclema sp.中分离得到4种新的甾体化合物trihydroxysteroid(a~d),4种化合物可有效地抑制结肠癌细胞(HT 29)、乳腺癌细胞(MCF-7)、子宫癌细胞(A 2780)和前列腺癌细胞(DU 145)的生长,IC50在5~27μmol/L之间(图3-31)。
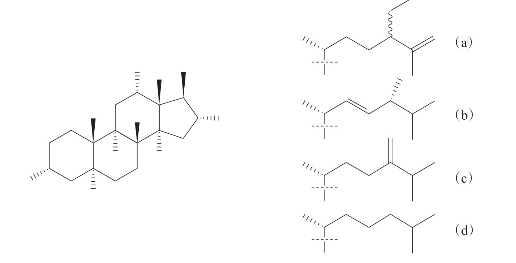
图3-31 从澳大利亚海绵中分离到的甾体化合物
Yang等(2011)从海洋苔藓虫Bugula neritina中分离得到2个氧化甾醇3β,24(S)-di hydroxycholesta-5,25-dien-7-one(a)和3β,25-dihydroxycholesta-5,23-dien-7-one(b),2种化合物对肝癌细胞(HepG2)、结肠癌细胞(HT-29)和大细胞肺癌细胞(NCIH4603)均具有细胞毒作用,IC50在22.58~53.41μg/ml之间(图3-32)。

图3-32 从海绿苔藓虫分离到的氧化甾醇
Cui等(2010)从褐藻Sargassum kjellmanianum分离得到的内生真菌Aspergillus ochra ceus EN-31中分离得到3种新的甾体化合物7-Nor-ergosterolide(a),3β,11α-dihy drox yer gosta-8,24(28)-dien-7-one(b)和3β-hydroxyergosta-8,24(28)-dien-7-one(c)。化合物(a)是一种罕见的在B环上含有一个内酯的7位去甲甾类化合物,对非小细胞肺癌(NCl-H460)、人肝癌细胞(SMMC-7721)和人胰腺癌细胞(SW1990)均显示出细胞毒作用,IC50分别为5.0μg/ml、7.0μg/ml和28.0μg/ml;化合物(b)对SMMC-7721显示出细胞毒作用,IC50为28.0μg/ml(图3-33)。
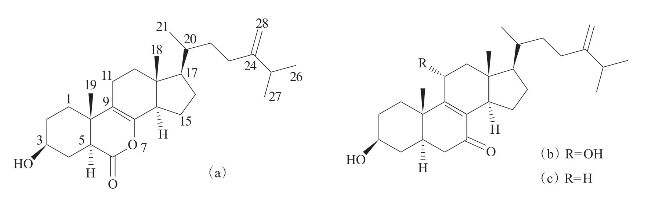
图3-33 从褐藻中分离到的甾体化合物
Simmons等(2011)从海绵分离得到的放线菌Actinomadura sp.SBMs009的乙酸乙酯提取液中得到化合物bendigoles(a)~(c),3种化合物均表现出一定的抗炎活性,都能抑制糖皮质激素受体(GR)易位活性,其中化合物(a)的抑制效果最佳;化合物(c)还可有效抑制NF-κB核易位活性,IC50为70μmol/L(图3-34)。
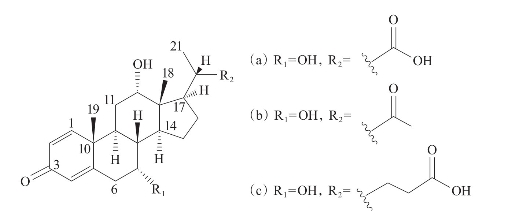
图3-34 从海绵分离到的放线菌提取液得到的化合物
Mandeau等(2005)从瓦努阿图拉门湾海绵Euryspongia n.sp.的乙醇浸提液中分离得到化合物3β-hydroxy-24-norchol-5-en-23-oicacid(a)和3β-hydroxy-26-norcampest-5-en-25-oic acid(b),2个化合物对卡西霉素(A23187)诱导下角朊细胞(HaCaT)的6-酮前列腺素的产生具有一定的抑制作用,其中化合物(b)在浓度0.1μg/ml,1.0μg/ml和10.0μg/ml时,6KPGF1含量分别为24%,31%和41%(图3-35)。
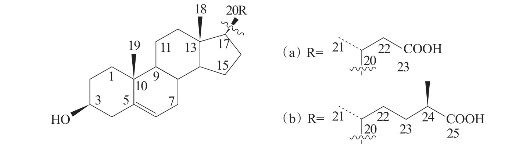
图3-35 从海绵的乙醇提取液中分离到的化合物
Wei等(2007)从加勒比海海绵Svenzeazeai的乙醇-氯仿提取液中分离得到具有[6-5-6-5]-甾核结构的新型化合物abeo-sterols parguesteros,2种化合物可有效地抑制结核菌Mycobacterium tuberculosis H37R v的活性,最低抑菌浓度(MIC)分别为7.8μg/ml和11.2μg/ml(图3-36)。
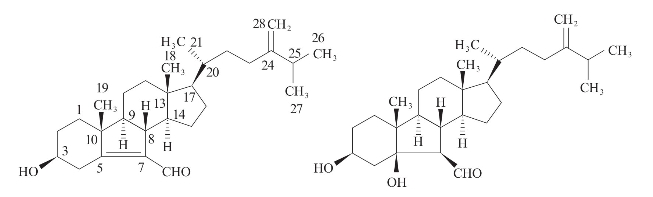
图3-36 从海绵乙醇一氯仿提取液分离到的化合物
Boonlarppradab等(2007)从帕劳群岛采集到未鉴定的Euryspongia属海绵中分离获得2个硫酸甾体eurysterols,2个化合物对两性霉素B耐药的野生白色念珠菌Candida albicans表现出抑菌活性,MIC值分别为15.6μg/ml和62.5μg/ml(图3-37)。

图3-37 从海绵中分离到的硫酸甾体
Gong等(2013)从中国南海软珊瑚Sarcophyton sp.的甲醇提取液中分离得到的2种化合物可有效抑制甲型H1N1流感病毒的活性,IC50分别为19.6μg/ml和36.7μg/ml(图3-38)。
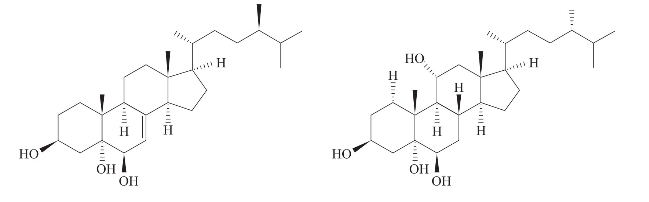
图3-38 从南海软珊瑚的甲醇提取液中分离到的化合物
Chen等(2011)从台湾珊瑚I.hippuris的丙酮提取液中分离得到2个多羟基甾醇(a)和(b),经细胞病变抑制试验发现,该化合物可有效阻遏人巨细胞病毒(HCMV)感染人胚胎成纤维细胞(HEL),EC50分别为2.0μg/ml和6.0μg/ml。与此同时,其对HEL细胞未显示细胞毒活性(图3-39)。

图3-39 从台湾珊瑚的丙酮提取液中分离到的多羟基甾醇
Rudi等(2001)从红海海绵Clathria sp.的甲醇-乙酸乙酯提取液中分离得到如下化合物,在浓度为10μg/ml时,该化合物可有效抑制人类免疫缺陷病毒1型(HIV-1)反转录酶的活性(图3-40)。
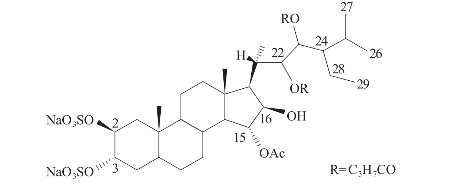
图3-40 从红海海绵的甲醇—乙酸乙酯提取液中分离到的化合物(https://www.xing528.com)
Whitson等(2008)从菲律宾群岛海绵Spheciospongia sp.的甲醇提取液中分离得到4种化合物(a)~(b),4种化合物均可有效抑制蛋白激酶C的活性,IC50分别为1.59mol/L,0.53mol/L,0.11mol/L和1.21mol/L。进一步研究发现,其对NF-κB也有抑制活性,EC50在12~64μmol/L之间(图3-41)。
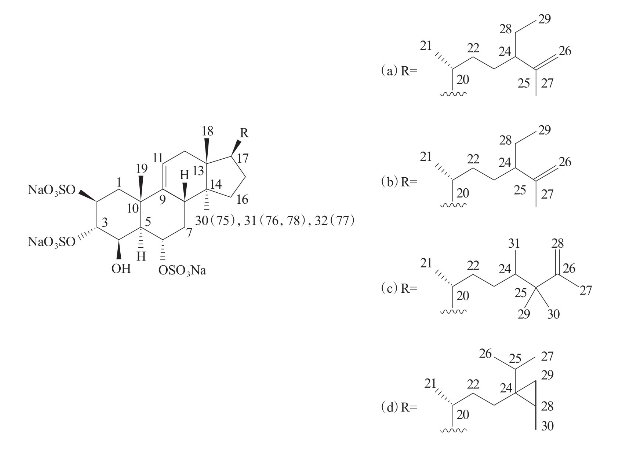
图3-41 从海绵的甲醇提取液中分离到的化合物
Dai等(2010)从印度尼西亚海绵Topsentia sp.的甲醇提取液中分离得到5种化合物,其中化合物(a)(图3-42)具有显著的天冬氨酸蛋白酶(BACE1)的抑制活性,IC50为2μmol/L。其他4种化合物对BACE1均不具有抑制作用,这可能与其存在硫酸酯钠基团有关。

图3-42 从印度尼西亚海绵的甲醇提取液中分离得到的化合物
Rao等(2010)从印度马纳尔湾海绵Callyspongia fibrosa分离得到化合物(a)~(b),研究发现这些化合物对恶性疟原虫(Plasmodiumfa lciparum)均有中等抑制活性,其中化合物(a)的效果最佳,而与氯喹相反,其对恶性疟原虫氯喹抗药株的活性要比氯喹敏感株的活性好(图3-43)。
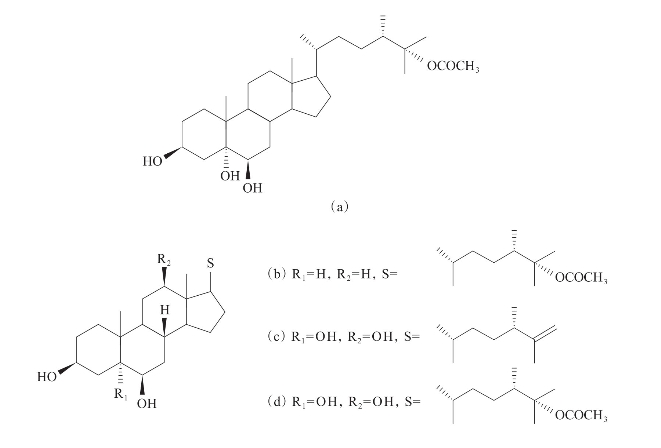
图3-43 从印度海绵分离到的化合物
二、海星来源的甾体化合物
广义海星皂苷指的是从海星中分离得到的以甾体为母核的配糖体。狭义海星皂苷是指具有△9,113β,6α-二羟基甾体母核,并在3位硫酸化、6位糖基化的一类特定的大分子甾体化合物。按结构可分为多羟基甾醇及其糖苷、环式甾体皂苷以及海星皂苷。
1.多羟基甾醇及其糖苷
Wang等(2005)从韩国海星Certonardoa semiregularis的甲醇提取液中分离得到硫酸酯化甾体皂苷化合物(a)和(b),化合物(a)对肺癌细胞(A549)、卵巢癌细胞(SKOV-3)、皮肤癌细胞(SK-MEL-2)、XF498和人结直肠腺癌细胞(HCT15)具有一定的抑制活性,其中对SK-MEL-2的抑制效果最好,ED50为2.67μg/ml(图3-44)。
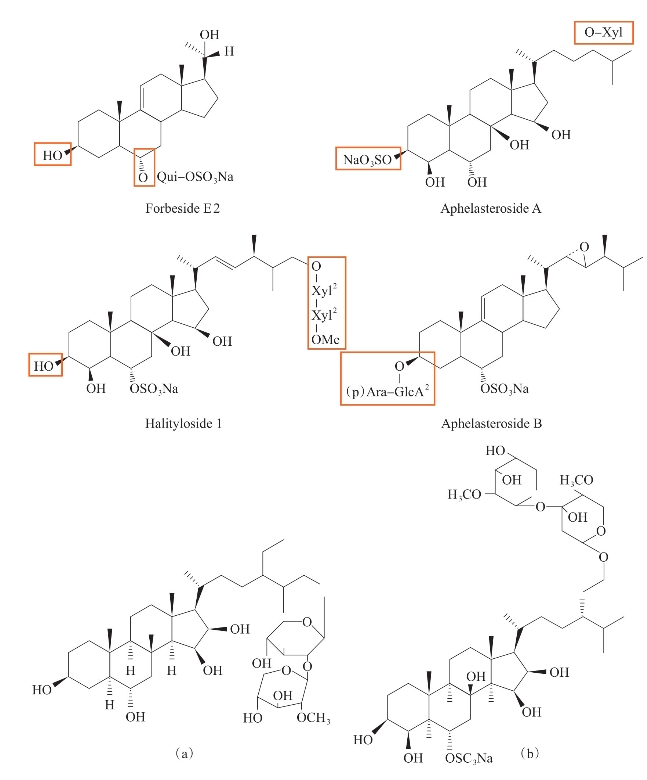
图3-44 海星来源的多羟基醇及其糖苷
Kicha等(2008)从远东海星Hippasteria kurilensis的乙醇提取液中分离得到6种化合物(a)~(f),化合物(b)(c)(d)(f)分别在浓度5.5×10-5,5.5×10-5,6.7×10-5和1.3×10-5mol/L的条件下,对紫海胆Strongylocentrotus nudus卵受精的抑制作用达100%,化合物(a)和(e)在5×10-5mol/L的浓度下显示出弱的抑制活性(图3-45)。
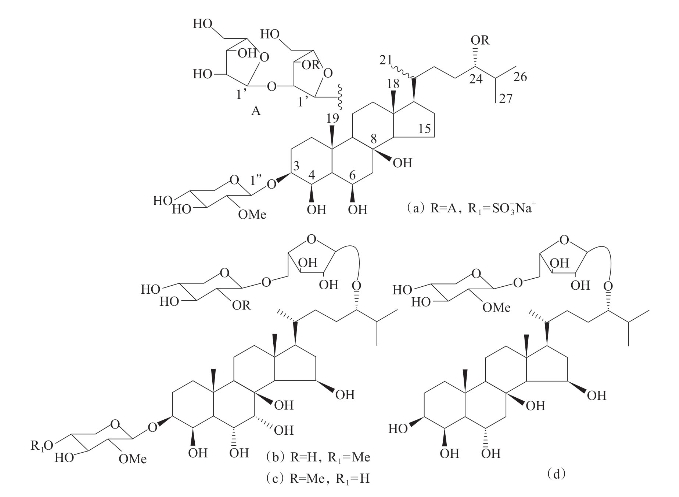
图3-45 从远东海星的乙醇提取物中分离到的化合物
2.环式甾体皂苷
不含硫酸基,但含1分子葡萄糖醛酸(连接于苷元3位),△7-3β,6β-二羟基甾体母核,寡糖基由3个单糖基组成,第3个糖基的6位羟基与苷元6位成苷,组成环状结构,状若环醚(图3-46)(马宁,2009)。
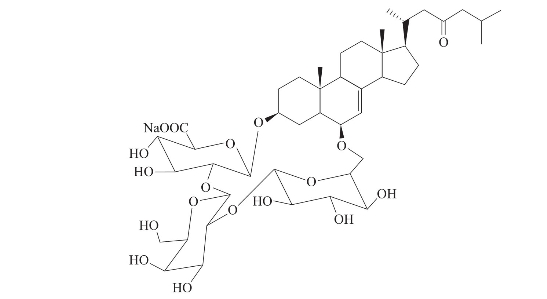
图3-46 环式甾体皂苷的结构
3.海星皂苷
(1)海星皂苷的化学性质:当一个非糖类物质(如三萜、甾体、二萜)连接糖以后所形成的物质称之为苷,这时把非糖类物质称为苷的苷元。海星皂苷极性大,不易结晶,因而大多数为无色不定型粉末,可溶于水,易溶于热水、稀醇、热甲醇和热乙醇中,含水丁醇或戊醇对皂苷的溶解度较好。几乎不溶或难溶于乙醚、苯等极性小的有机溶剂。海星皂苷具有溶血作用,大多数海星皂苷的水溶液有溶血作用,这可能是海星的一种自我保护机制;沉淀反应,海星皂苷的水溶液可以和铅盐、钡盐、铜盐等产生沉淀,利用这一性质进行皂苷的提取和初步分离;化学定性显色反应,Lieberman-Burchard反应,用于鉴别甾体母体;Molish反应(萘酚、浓硫酸),用于鉴别甾体连接的糖。
除3位硫酸基外,甾体母核、侧链和糖基上均无其他硫酸基团;侧链至少有1个位置被氧化,如羟基、酮羰基或环氧基团,甾体母核除3,6位外一般无含氧基团;苷元的侧链一般由8个碳原子骨架组成,一些化合物有失碳现象,碳原子可少至2个,另有一些在C-24位连接有额外的1或2个碳原子;糖基的个数以5或6个的情况居多,常见糖的种类为喹诺糖(quinovose,Qui)、岩藻糖(D-fucose,Fuc)、木糖(D-xylose,Xy1)、半乳糖(D-galactose,Gal)、葡萄糖(D-glucose,Glc),少见的有阿拉伯糖(L-arabinose,Ara)、D-6-去氧-木-4-己酮糖。所有糖基几乎均以吡喃形式存在。除阿拉伯糖为α构型外,其余糖基的苷键构型均为β;寡糖链具有相似的连接方式,多具1个分支,少数具有2个分支或无分支。起始糖基多为喹诺糖或葡萄糖。除个别例外(如santiagoside),每一位置上糖基的苷化位置基本固定(图3-47)。

图3-47 海星皂苷
(2)海星皂苷的提取与分离:由于海星体内的酶容易水解海星皂苷,因此提取时首先要抑制酶的作用。一般可用乙醇破坏酶的活力,或用硫酸铵等无机盐盐析,使酶沉淀除去。
①总皂苷的提取:
1)两相萃取法:减压浓缩所得提取液,再用氯仿或乙酸乙酯与水分配,除去脂溶性成分,最后用水饱和的正丁醇与水分配,浓缩所得的正丁醇溶液即得总皂苷(康俊霞等,2012)。
2)铅盐法:滤液先用乙醚除去其中的叶绿素和油脂等杂质,然后加饱和乙酸铅水溶液至不再产生沉淀为止。过滤,滤渣加适量乙醇使成50%的浓度,按常法用饱和硫酸钠水溶液、稀硫酸,或通硫化氢脱铅,过滤。
3)吸附法:滤液用新煅烧的氧化镁或活性炭吸附,再用甲醇或其他适当溶剂解析,浓缩即得总苷。有时先用铅盐法或溶剂法处理后,再用吸附剂吸附纯化。
②皂苷的纯化:将上述方法获得的总皂苷部位溶于水,上样至大孔吸附树脂柱,先用水洗去糖及蛋白质等成分,然后用梯度甲醇或乙醇洗脱,可获得更为精制的总皂苷。
硅胶色谱和反相硅胶色谱(键和C-18反相硅胶)纯化,具有上样量大、操作简单等优点,分离效果差,易吸附皂苷,在用硅胶色谱分离皂苷类化合物时,经常采用氯仿-甲醇-水三元溶剂系统。显示剂采用硫酸-乙醇溶液或硫酸-香兰素(在氯仿-甲醇溶剂系统中加入适量的水,可克服皂苷类化合物进行硅胶色谱时产生的脱尾现象,获得更好的分离效果)。
反相硅胶色谱(键和C-18反相硅胶)的优点:分离效果好,样品回收率高;缺点:上样小,不容易实现工业化生产;固定相为十八烷基键合硅胶;最常用溶剂为水、甲醇、乙腈和乙醇(赵君等,2013;樊廷俊等,2008)。
三、珊瑚来源的甾体化合物
Zhang等(2013)从中国南海海域的偏扁软柳珊瑚Subergorgia suberosa中分离得到新的9,11-开环甾醇化合物subergorgols(a)(b),2个化合物具有特征的3,6,11- trihydroxy-7-en-9-one-5-9,11-secosteroid母核,化合物(a)对人白血病细胞株K 562及人乳腺癌细胞株MDA-MB-231有较强的抑制活性,IC50分别为5.5μmol/L 和6.2μmol/L。化合物(b)对K 562细胞株也有很好的抑制作用,IC50为6.5μmol/L(图3-48)。
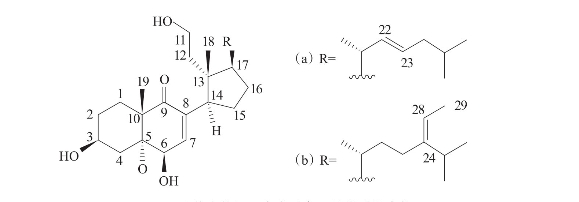
图3-47 从偏扁软柳珊瑚中分离到的甾醇化合物
Lai等(2011)从中国广西北部湾的柳珊瑚Astrogorgia sp.中分离得到5种9-10开环甾醇化合物(a)~(e),结构特点是在9-10开环母核上都含有一个3-hydroxy-10-methylphenyl环,这类化合物对与肿瘤相关的间变性淋巴瘤激酶(ALK)、酪氨酸激酶(AXL)、黏着斑激酶(FAK)、胰岛素样生长因子受体(IGF-1R)、SRC激酶和血管内皮生长因子受体2(VEGF-R2)均具有特异性抑制作用(图3-49)。
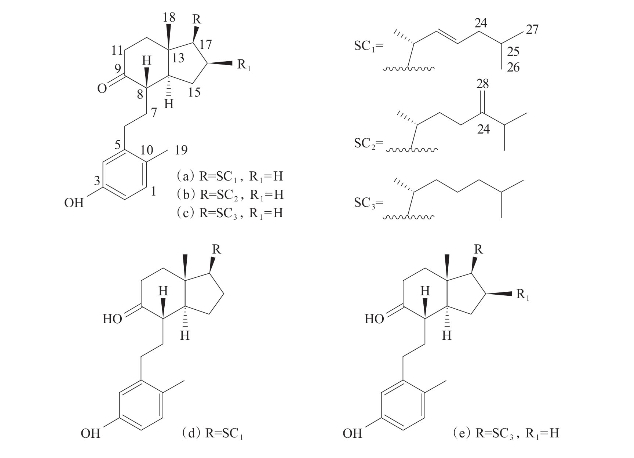
图3-48 从北部湾柳珊瑚中分离到的甾醇化合物
Quang等(2011)从越南软珊瑚Lobophytum laevigatum的甲醇提取液中分离到新的甾体类化合物lobophytosterol,在C17和C20位上存在一个环氧结构,对人结肠癌细胞株(HCT-116)、肺癌细胞株(A549)和人早幼粒白血病细胞株(HL-60)均有细胞毒活性,IC50分别为3.2μmol/L,4.5μmol/L和5.6μmol/L,主要是通过诱导细胞凋亡的方式来抑制细胞的增长(图3-50)。
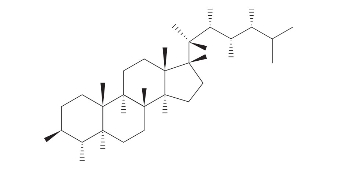
图3-50 从越南软珊瑚的甲醇提取液中分离到的甾体类化合物
Huang等(2008)从台湾软珊瑚Nephthea chabroli的丙酮提取液中分离得到6个甾体化合物(a)~(f),并进行体外抗炎活性测试。结果表明,化合物(c)(d)(e)在浓度为10μmol/L时,能够分别有效地降低iNOS的量至0,43.1%±7.9%和76.9%±9.4%;化合物(a)~(c)和(f)也均可显著地抑制iNOS的表达(10.6%±0.5%,9.6%±1.0%,0和32.8%±6.8%),但是不能抑制COX-2蛋白表达(图3-51)。
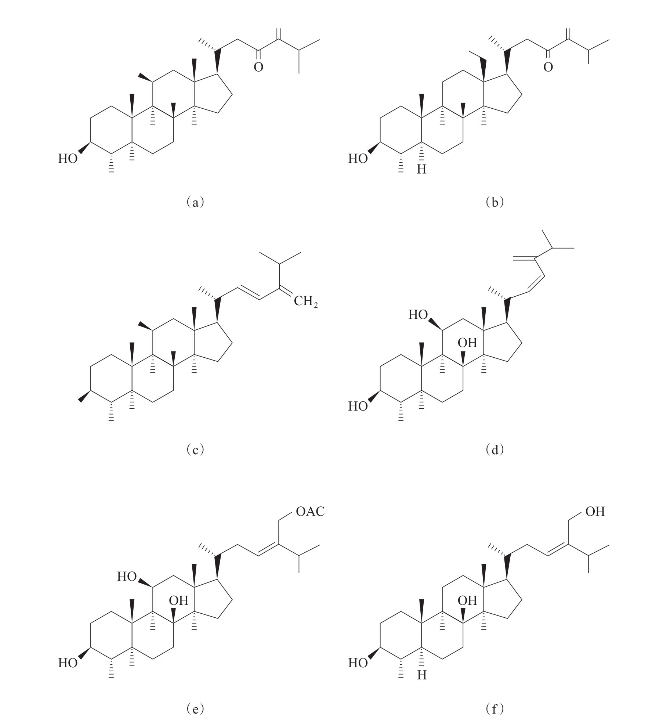
图3-51 从台湾软珊瑚的丙酮提取液中分离到的甾体化合物
Cheng等(2009)从台湾软珊瑚Nephthea chabroli的丙酮提取液中分离得到C19位氧化的化合物nebrosteroids(a)~(d)和4-甲基化的化合物nebrosteroid(e),经脂多糖(LPS)诱导对巨噬细胞R AW264.7进行体外抗炎活性测定。结果表明,化合物(a)(b)(d)和(e)在浓度为10μmol/L时,能够将iNOS的量分别减少至20.2%±2.6%,65.2%±5.5%,79.2%±11.3%和61.0%±4.6%,将COX-2的量分别降低至75.3%± 3.3%,86.0%±1.7%,63.8%±7.7%和60.1%±4.6%;化合物(c)对iNOS和COX-2均没有抑制作用(图3-52)。

图3-52 从台湾软珊瑚的丙酮提取液中分离到的化合物
Su等(2008)从台湾软珊瑚Sinularia sp.和八放珊瑚Dendroneph thyagriffini的乙醇提取液中分离得到8个含有2个羟基的甾体化合物(a)~(h),其中化合物(a)和(b)在甾核C9和C11位存在一个双键。经体外抗炎活性测定,发现化合物(a)(b)(g)在浓度为10μmol/L时,对LPS诱导下的巨噬细胞R AW264.7的促炎COX-2蛋白的积累具有一定的抑制作用。化合物(e)~(h)在浓度为10μmol/L时,对LPS诱导下的巨噬细胞R AW264.7的促炎iNOS蛋白的积累具有较好的抑制作用(图3-53)。
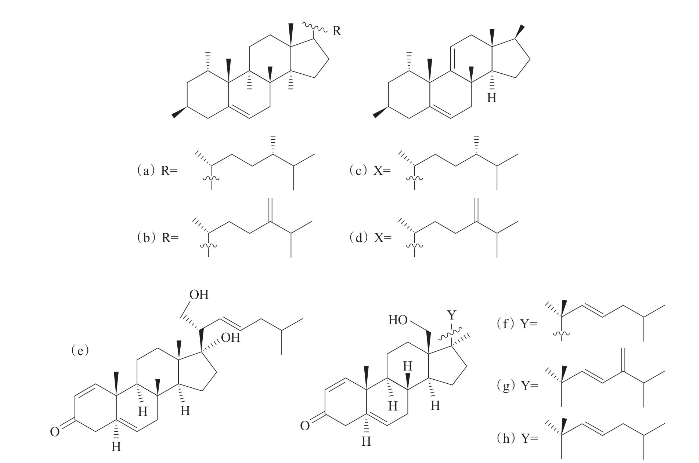
图3-53 从珊瑚的乙醇提取液中分离到的甾体化合物
四、海岸带来源甾体化合物的分离纯化
甾体化合物是以环戊烷多氢菲为母核的结构,因而绝大多数的甾体化合物极性都较低。目前,通常采用不同极性的有机溶剂对海洋来源样品进行浸提,减压浓缩,得到粗浸膏,然后再运用硅胶、凝胶和反相高效液相等色谱方法对粗分样品进行分离纯化。
五、海岸带来源甾体化合物的应用前景
海岸带来源甾体化合物具有抗肿瘤、抗菌、抗炎和抗病毒等生理活性,具有良好的新药开发前景。不同生物来源的甾体化合物在结构上有所差别,甾核环或支链上的细微差别都可能引起生理活性的显著差别。甾体化合物的应用非常广泛,如治疗过敏性疾病的氢化可的松、避孕药黄体酮、利尿剂安体舒通、合成甾体激素的薯蓣皂甙元、强心作用的地高辛、蟾毒甙等都是甾体化合物。
因此,可以以这些天然甾体化合物作为药物研究的先导化合物,研究其在体内的吸收、分布、代谢、排泄和毒性,进一步进行构效关系和化学合成研究,开发生理活性显著的甾体化合物并进行药物设计和制备,为人类健康做出贡献。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




