糖脂(glycolipids)是指糖类和脂类形成的共价化合物。它是一类两亲性分子,在生物体内广泛存在。依据脂质部分的不同,糖脂可分为四类:①含鞘氨醇(sphingosine)的鞘糖脂(glycosphingolipids,GSL);②含甘油脂(glycerolipids)的甘油糖脂(glycoglycerolipids);③磷酸多萜醇衍生的糖脂(polyprenol phosphate glycoside);④类固醇衍生的糖脂(steryl glycoside)。
糖脂的糖链可与蛋白质受体相互识别,同时本身也是信号传导分子。糖脂的生物学功能可归纳如下:①是细胞质膜外层的主要组分,提供了结构上的稳定和强度;②参与细胞间相互作用和识别;③参与细胞黏附;④是分化标志;⑤参与细胞生长调节、凋亡;⑥可与生物活性因子相互作用,如作为糖蛋白、病毒、激素细胞毒素的受体;⑦具有细胞表面标记和抗原及免疫学功能;⑧影响细胞质膜的功能。糖脂在生物化学和生物医学研究领域已经引起了人们的广泛注意和极大的兴趣,在细胞生物学中作为信号调节因子具有重要的作用。糖脂及其衍生物被认为在细胞生长、分化、凋亡方面具有重要的调节作用,并且某些是潜在的治疗药物,主要用于调节免疫反应和阻断细胞黏附,在肿瘤、器官移植和其他一些由于细胞调节紊乱而引起的疾病的治疗方面发挥重要的作用。
糖脂广泛分布于生物界,在哺乳动物的组织和器官中所含的糖脂主要为鞘糖脂。鞘糖脂的组成、结构和分布具有组织专一性和专属性。随着科技的发展,生物膜尤其是质膜的研究达到了分子水平,鞘糖脂作为真核细胞质膜的主要组成成分之一,不仅维持着细胞的基本结构,而且在细胞生长、分化、增殖、黏附、信号转导等细胞基本活动中发挥着重要作用,还参与细胞癌变、肿瘤转移等过程。
一、鞘糖脂
(一)鞘糖脂概述
鞘糖脂是细胞表面的多功能调节因子,疾病组织细胞膜表面鞘糖脂的变化可能与细胞发育、分化和凋亡等的异变密切相关(王艳萍等,2011)。鞘糖脂(GSLs)最早由Emst Klenk于1942年从脑组织分离并命名。大量研究发现,鞘糖脂在哺乳动物的组织和器官中普遍存在,其组成、结构和分布具有种属以及细胞专一性。鞘糖脂由亲水的糖链和疏水的神经酰胺(由神经鞘氨醇和脂肪酸构成)组成,是一类两亲性化合物。在细胞中,鞘糖脂亲水的糖链部分则伸在膜外,脂质部分包埋在磷脂双分子层中,作为膜的组分存在。人们根据核心糖链与脂质相邻的3~4个糖的结构特点,又将鞘糖脂分为红细胞系列、异红细胞系列、乳糖系列、新乳糖系列、半乳糖系列、神经节系列、黏附系列等若干系列。
由于单糖的种类和数目、连接顺序、位点以及异头构型等有无穷多的变化,鞘糖脂的糖链结构比较复杂。与具有相同残基数的肽相比较,一个含有4个不同氨基酸的四肽至多含有数十种异构体,而一个含有4个不同糖基的四糖在理论上则可能有3万余种异构体。因此,鞘糖脂的寡糖链蕴含了更为丰富的生物学信息。
最近越来越多的研究表明,鞘糖脂具有广泛的生物活性和药理作用,但对其的研究受到限制,主要表现在鞘糖脂含量过少,纯化、分离、鉴定都较为困难。
(二)鞘糖脂的分布与来源
鞘糖脂的组成、结构和分布具有组织专一性和专属性,它们大多数作为细胞膜的组成成分存在于动物组织、海绵和真菌中。部分植物中也含有一些鞘糖脂,但总体来看在植物中的分布不是很普遍。
(三)鞘糖脂的结构
鞘糖脂由一个神经酰胺的骨架与一个或多个糖基连接形成,主要包含疏水的脂肪链以及亲水的糖链两部分,以便其在嵌入细胞膜脂双层的同时将糖链构成的极性端伸向细胞质膜外,从而成为细胞表面具有生物活性的标志(图3-12)。鞘糖脂的神经酰胺部分由神经鞘氨醇和脂肪链组成,糖链的组成较复杂,所含基团有D-葡萄糖、D-半乳糖、D-乙酰氨基葡萄糖、D-乙酰氨基半乳糖、L-岩藻糖、D-甘露糖及唾液酸(SA)等。

图3-12 鞘糖脂的结构
(四)鞘糖脂的分类
鞘糖脂主要分为Gala-,Globo(Gb)-,isoglobo(i Gb)-,Ganglio(Gg)-,lacto(Lc)-,Neolacto(n Lc)-,Arthro(Ar)-以及Mollu(MI)-等八类(王艳萍等,2011;续旭,2009)。
根据糖链组成的不同,可将鞘糖脂分为三类:仅含一个糖基的脑苷脂、不含唾液酸的非硫酸化的中性鞘糖脂以及含有唾液酸或/且被硫酸化的酸性鞘糖脂。其中脑苷脂可被硫酸化成硫苷脂,结构复杂的中性或酸性鞘糖脂可由多个单糖组成糖链。鞘糖脂按其所含的单糖的性质又可分为两大类,即中性的鞘糖脂和酸性的鞘糖脂,前者糖链中只含中性糖类,后者糖链中除了中性糖以外,还含有唾液酸[sialic acids,SA,又叫神经氨酸(neuraminic acids,Neu Ac)]或硫酸化的单糖。含唾液酸的鞘糖脂又称为神经节苷脂(gangliosides),含硫酸化单糖的鞘糖脂又称为硫酸鞘糖脂(sulfoglycosphingolipids),也称为硫苷脂(sulfatides)。
海洋天然鞘糖脂clarhamnoside的结 构为α-L-Rhap-(1→3)-β-D-NHAc Galp-(1→6)-α-Galp-(1→2)-α-Galp-Ceramide。该化合物糖链的结构特点在于内侧半乳糖通过α-糖苷键连接神经酰胺,该糖的2位又通过α-糖苷键与另一个半乳糖连接,这种结构在天然物中极为少见,也是糖合成化学的难点之一;另外它是目前发现的唯一含有末端鼠李糖单元的天然α-Gal-GSLs。
(五)鞘糖脂的生物合成
1.中性鞘糖脂的合成
不含唾液酸的鞘糖脂称为中性鞘糖脂,其生物合成是通过在神经酰胺分子上顺序添加单糖而合成寡糖链,该过程是在真核细胞的内质网和高尔基体中进行的。神经酰胺是鞘糖脂和鞘磷脂的共同母体,是合成鞘糖脂的前提基础。神经酰胺形成以后,在高尔基体中一系列糖基转移酶的催化作用下进行糖基化反应,生成系列相关中性鞘糖脂,生物体中主要的中性鞘糖脂合成途径及相关合成酶如图3-13(杨广宇等,2015)。
2.酸性鞘糖脂的合成
酸性鞘糖脂是指含一个或者多个唾液酸的鞘糖脂,其中神经节苷脂(gangliosides)是酸性鞘糖脂中的重要成员,主要存在于神经组织、脾脏与胸腺中。以神经节苷脂为代表的酸性鞘糖脂合成途径见图3-13(朱峰等,2002)。

图3-13 鞘糖脂的生物合成途径
鞘糖脂位于细胞膜脂质双分子层,是哺乳动物细胞膜上的必需组成成分之一,参与细胞的多种生物学活动,在细胞识别、细胞发育、免疫应答及分化中都发挥重要的作用。组织器官中鞘糖脂的异常表达往往与各种疾病具有明显的相关性。因此,鞘糖脂的结构表征、构效关系研究以及与之相关的鞘糖脂生物合成及分解代谢途径的研究已成为近年来的热点问题。最近研究也表明鞘糖脂在疾病的发生发展及治疗过程中都具有至关重要的作用。对鞘糖脂的结构与功能的关系、糖脂的合成以及代谢做进一步的分析。
3.鞘糖脂N-去酰基化酶的克隆、性质表征及在鞘糖脂酶法合成中的应用
鞘糖脂是一类双亲性分子,由神经酰胺与寡糖链以糖苷键连接而成,在细胞信号传导、细胞生长、分化、凋亡等过程中均发挥重要的作用;对多种神经退行性疾病(阿尔兹海默症、帕金森症、亨廷顿舞蹈症)及癌症、中风等均有积极的疗效。鞘糖脂N-去酰基化酶(SCDase)催化鞘糖脂中脂肪酸与鞘氨醇间的酰胺键断裂,产生相应的去酰基化形式,并可催化水解的可逆反应,在鞘糖脂类化合物修饰及体外酶法合成中具有重要应用价值。目前仅有来源于Pseudomonas sp.TK4和Shewanella alga G8两个SCDase已报道,其中后者(SCDase-G8)的全长基因已克隆表达,全长基因产物经C末端切除加工后成为成熟蛋白,然而对于成熟蛋白的异源表达和性质表征还未有详细报道。研究人员已经克隆了SCDase-G8全长基因的C末端截短突变体(SCDase-G8del),并成功在大肠杆菌中实现功能表达,纯化获得了纯度在95%以上的SCDase。针对传统放射性同位素标记TLC分析SCDase活性方法的安全性低、耗时长、重复性差、分辨率不高、定量不准确等问题,建立了基于邻苯二甲醛柱前衍生的HPLC酶活性测定方法,该方法安全快捷、灵敏度好、准确性高,并适宜于大规模高通量分析。对重组酶进行性质表征发现,其比活力为125.2U/mg;最适作用温度为40℃,最适pH为8.0;5mmol/L Zn2+、Cu2+强烈抑制酶活性,相同浓度其他二价金属离子表现出不同程度的激活作用,其中Mn2+、Co2+最为强烈,可提高约40%酶活性;Triton X-100可显著增强酶活性,在0.3%Triton X-100存在时,其活性可提升约14倍;DMSO,DME,DMF,THF等有机溶剂在较低浓度时抑制SCDase的活性,但浓度提高时抑制作用减弱,其中DME在20%浓度时可以使酶活性提高约30%。该研究应用SCDase-G8del合成了神经节苷脂GM1及其前体核心Glc-Cer,并成功地与由来源于Rhodococcus sp.strain M-777的内切糖基神经酰胺酶(EGCII)改造而来的糖苷合成酶(Glycosynthase)连用,建立了针对GM1的一过酶法合成体系,产物产率为41.5%,获得了结构单一的GM1(d18∶1/18∶0)。该研究建立了快速、灵敏、准确的SCDase活性分析方法,为SCDase的系统研究提供了有力的工具;克隆表达并系统表征了来源于Shewanella alga G8的SCDase成熟蛋白,初步探索了其在神经节苷脂酶法合成中的应用,为鞘糖脂类化合物的体外酶法合成奠定了基础(武烈,2012)。
(六)天然鞘糖脂的发现
1997年,Costantino等从加勒比海绵中获得了β构型的半乳糖鞘糖脂plakoside A和plakoside B。它们既是第一个糖基2位异戊烯基化的糖基鞘脂,亦是天然界首例具有环丙烷结构的神经酰胺,plakoside A和plakoside B没有显示免疫促进活性,并且没有细胞毒活性,而是表现出较强的免疫抑制活性。如果不考虑糖苷键的构型和酰胺部分的差别,从免疫促进活性到免疫抑制活性的转变是由于分子中2-OH被异戊烯醚化,这和以前报道的α-GalCer的半乳糖2-OH糖苷化免疫促进活性消失一致,说明内侧糖的2-OH上的基团对活性影响很大。因此,对该类化合物进行研究,以开发一类独特的免疫抑制剂,无疑引起了科学家们的兴趣。
1998年,该小组在海绵中分离出了glycolipids simplexides,其免疫抑制活性与plakoside A、B相当,无细胞毒活性。它们对活性T细胞具有强烈的免疫抑制作用,因而似乎可以成为更准确地阐述鞘糖脂免疫调节活性结构因素的模型化合物。同年,该小组从加勒比海绵的代谢产物中分离获得了混合物glycolipids simplexides,由5个结构类似物组成,都含有一个1,2-顺式葡萄糖糖苷键,并且与脂肪烃长链部分相连的半乳糖为1→4分枝。对此混合物进行的免疫抑制活性测定显示,该类化合物具有较好的抑制淋巴结细胞增殖作用,当浓度为100ng/ml时,淋巴结细胞的抑制率可达79%。值得提出的是,此类化合物并没有表现出细胞毒活性。因此,发掘具有与常规免疫抑制剂不同作用机制的高效低毒新药有十分重要的意义(Costantino等,1999)。
2000年,plakoside C和plakoside D两个结构与plakoside A和plakoside B类似的异戊烯醚化鞘糖脂被从海绵Ectyoplasia ferox中分离出来,但其活性未见报道(Costantino等,2000)。
糖脂是一类两亲性分子,在生物体内广泛存在。糖脂及其衍生物被认为在细胞生长、分化、凋亡方面具有重要的调节作用,并且某些是潜在的治疗药物。已有证据表明,糖脂分子参与免疫应答过程。
二、甘油糖脂
(一)甘油糖脂的来源
甘油糖脂主要存在于动物的神经组织、植物和微生物中,是植物叶绿体类囊膜、细菌原生质膜尤其是革兰阳性细菌菌膜的常见组成成分,参与细胞膜的识别活动。
甘油糖脂广泛存在于高等植物中。1956年,存在于小麦粉中的双半乳糖二酰基甘油(DGDG)首次被发现。2001年,Dai从菊科植物Serratula strangulata的根茎中分离得到三种甘油糖脂。通过活性跟踪检测,Larsen等于2003年从狗蔷薇Rosacanina中分离得到一种单半乳糖甘油二酯(MGDG)。含有SQDG、MGDG和DGDG的甘油糖脂组分被Maeda等从菠菜(Spinacia olerace L.)中分离得到。Manez等人发现化合物inugalactolipid A(DGDG)为旋覆花植物I.viscosa的地上部分抗炎作用的药效物质之一。昭和草为民间宣称具有缓解炎症作用的可食用植物。2007年,研究者通过利用巨噬细胞、癌细胞、基因活性为基础的体外生物活性测定方法,以及老鼠皮肤发炎与黑色素瘤动物模式,从昭和草植物中分离到一种甘油糖脂l,2-di-O-α-linolenoyl-3-O-β-galactopyranosyl-snglycerol(dLGG)。据报道,南瓜和生姜中也含有部分甘油糖脂化合物。
研究发现藻类中含有大量的甘油糖脂。在褐藻(Ectocarpus fasciculatus)中SQDG占甘油脂总量的26.3%;在红藻(Chondiria dasyphylla)中SQDG含量可占糖脂总量的39.9%;某些硅藻中含量也很高,如在Naviculaalba中可占总极性脂的74%。随着甘油糖脂一些生物活性的陆续发现,以各种藻类植物作为资源,从中分离提取甘油糖脂越来越引起了众多国内外研究者的兴趣。1989年,Gustafson等人工培养的蓝绿藻L.lagerheimii和P.tenue的细胞提取物中分离出含磺酸基的甘油糖脂(SQDG)。Reshef等从5种蓝藻中分离到的26种糖脂化合物,11种为SQDG,6种为DGDG,9种为MGDG。2002年,Bergr等从紫球藻Phyridum cruentum分离得到化合物硫代异鼠李糖甘油单酯(SQAG),其脂酰基主要连接有棕榈酸(16∶0,26.1%)、花生四烯酸(20∶4,36.8%)、二十碳五烯酸(20∶5,16.6%)、十六碳一烯酸(16∶l,10.5%)等4种脂肪酸。2003年,岑颖洲等从海藻麒麟菜Eucheuma muricatum中分离得到一个甘油糖脂化合物,经用波谱方法及化学方法确定它的化学结构,是一个新型的核糖基甘油糖脂化合物,首次报道这类糖脂化合物在自然界中的存在。2005年,Gutierrez和Lule从蚤状溞Daphnia pulex中分离得到3种MGDGs和1种DGDGs。Bruno等从嗜热蓝藻ETS-05中分离得到MGDG,DGDG和SQDG三类化合物。卡特前沟藻Amphidinium carteri中分离到的溶血性物质为MGDG和DGDG。李宪璀从海藻石莼中分离得到一种α-葡萄糖苷酶抑制剂SQG,结构鉴定为酰基-3-(6-脱氧-6-磺酸基-α-D-吡喃型葡萄糖苷基)-sn-甘油酯。2009年,陆魏等从微劳马尾藻(Sargassu mfulfellum)的提取物中分离纯化了6种化合物,其中两个为甘油糖脂,分别为棕榈酰基-油酰基-3-O-α-D-吡喃葡萄糖基甘油和肉豆蔻酰基-油酰基-3-O-α-D-吡喃葡萄糖基甘油。
另外,在微生物中也发现了甘油糖脂的存在。2000年,Nakata等从水生细菌Corynebacterium aquaticum中分离到两种甘油糖脂H632A和5365A,发现它们能够明显与3种人类感冒病毒[A/PR/8/34(HINI),A/AiChi/2/68(H3N2),A/Memphis/l/7l(H3N2)]相结合。Matsufuji从微杆菌Microbacterium sp.M874B和棒状杆菌Corynebacterium a quaticum S365中分别分离得到具有抗氧化活性的甘油糖脂M874B和S365B。紫细菌(Rhodobater sphaeroides)中SQDG含量约为总脂肪酸的2.6%。另外,有人在非光合细菌(Rhizobium melioti)和一种嗜热非光合细菌(Bacillus acidocaldarius)中分离到了SQDG,可见甘油糖脂也存在于某些非光合生物中。
(二)甘油糖脂的化学结构
自然界分离到的甘油糖脂化合物大致可分为以下几类(图3-14):
A.酯键型甘油糖脂
B.醚型甘油糖脂:糖脂甘油部分的羟基被烷基化,形成醚键,而非酯键
C.糖基上的羟基发生脂酰化的甘油糖脂
D.糖醛酸型甘油糖脂
E.糖基6-位氨基化的甘油糖脂
F.糖基6-位磺酸化的甘油糖脂
G.甘油的两个羟基都被糖苷化的甘油糖脂

图3-14 不同结构类型的甘油糖脂
(三)甘油糖脂的分离提取
1.大孔吸附树脂法
样品的粗分离可以用大孔吸附树脂法,得到的产物是糖脂混合物,无法获得单一化合物。例如,曹东旭等报道以鲤鱼头糜为糖脂原料,用HP-20对90%乙醇萃取物进行分离,用90%的氯仿洗脱,再用90%乙醇洗脱,再用HP-20大孔吸附树脂对得到的90%的乙醇洗脱液进行分离,依次用70%的乙醇和95%的乙醇洗脱,收集浓缩95%乙醇的洗脱液,即可得到糖脂浓缩物。
2.高效薄层层析法
Murakami等报道,对泰国中草药酸橙Citrus hystrix的新鲜叶子进行乙酸乙酯萃取,利用葡聚糖凝胶C-100对萃取物进行层析,以丙酮浓度依次提高的丙酮/甲苯溶液为洗脱剂,得到60%~80%的丙酮洗脱物。然后,将洗脱物进行反相硅胶柱层析,依次以甲醇/水(9∶1,V/V)、甲醇/乙醇/水(16∶4∶5,V/V/V)为洗脱剂,得到含甘油糖脂DLGG和LPGG的混合物,进一步进行高效薄层层析制备硅胶板分离,得到甘油糖脂单体DLGG和LPGG。高效薄层层析要分离得到糖脂单一组分通常需要大量反复提取,而且提取量少,很难满足糖脂结构鉴定和生物活性的进一步研究。
3.柱层析色谱法
柱层析色谱法成为糖脂分离广泛采用的一种分离方法。Hou等报道,对民间昭和草的乙酸乙酯相进行分离,氯仿-甲醇为洗脱剂,进行正向硅胶柱层析和C18反相硅胶柱层析,以95%甲醇为洗脱剂,得到富含亚麻酸的甘油糖脂成分。YamauchiR等从红甜椒中分离得到单半乳糖二酰甘油和双半乳糖二酰甘油两种甘油糖脂。他们首先将红甜椒浆依次用氯仿、丙酮和甲醇萃取,得到富含糖脂的丙酮萃取物。然后将丙酮萃取物以氯仿-甲醇为梯度洗脱剂(99∶1~80∶2,V/V),进行多次柱层析,得到两种甘油糖脂。
(四)甘油糖脂的生物活性
1.抗HIV的作用
来源于人工培养的蓝藻L.lagerhe和P.tenue的细胞提取物中分离出含磺酸基的甘油糖脂(SQDG,sulf-quinovosyld iacylglycerols),是一种能抑制HIV的复制的新型抗HIV药物的先导化合物。这一新发现引起了人们对甘油糖脂研究的关注。
Loya等对来源于蓝绿藻中的三类甘油糖脂SQDG,MGDG(Monog alactosyldiacylglycerol),DGDG(Digalactosyldiacylg-lycerol)抗HIV的构效关系进行了研究,发现HIV-IRT酶能够被SQDG选择性地、有效地抑制,当糖环上的2,3位羟基被棕榈酰基取代时,抑制作用大大降低。分子中这些位置的脂酰基可能由于立体阻碍作用干扰了活性,MGDG,DGDG对HIV-IRT的抑制活性明显低于SQDG,水解除去甘油上的脂酰基,则化合物的抑制作用消失。这说明甘油糖脂抑制HIV-IRT的活性与磺酸基、甘油部分的脂酰基有关(马会芳等,2017)。
2.对酶的抑制作用
来源于嗜盐细菌中的一种醚型的含磺酸基的甘油糖脂(KN-208),能够抑制真核生物的DNA聚合酶α和β,同时也能抑制大肠杆菌的DNA聚合酶Ⅰ以及HIV反相转移酶。
从海洋红藻G.tenella中分离到一种SQDG(KM043),能抑制真核生物DNA聚合酶α,β和HIV-反相转移酶Ⅰ。从高等植物Athyrium niponicum中分离到3种SQDG,活性检测表明这些化合物能够抑制牛DNA聚合酶α及鼠DNA聚合酶β。
Hanashima等将SQDG/SQMG的结构拆分成四部分:磺酸基部分、单糖部分、甘油酯部分和脂肪酸部分。SQDG和SQMG对DNA聚合酶α、β抑制活性的构效关系研究表明,①糖脂的四部分必须都存在,方能发挥抑制作用;②糖苷键的类型(α,β)对活性的影响没有明显的差别;③SQDG/SQMG对DNA聚合酶α的抑制活性大于对DNA聚合酶β的抑制活性;④对DNA聚合酶α的抑制作用是SQDG大于SQMG,对DNA聚合酶β的抑制作用二者相同;⑤随着脂酰基链的延长,SQDG与SQMG的抑制作用均加强;⑥不同的糖基对活性的影响不大。初步的构效关系研究结果说明,SQDG/SQMG的活性均与糖环上的磺酸基及脂酰基链长短有关(蒋志国等,2009)。
3.抗肿瘤活性
(1)抗EB病毒早期抗原的活性:虽然某些MGDG和DGDG显示较强的抗肿瘤活性,但是很难找出它们的活性与脂酰基链之间的关系。为此,Nagatsu等合成了20种具有不同脂酰基的MGDGs和3种单半乳糖单脂酰甘油(MGMGs),测定了它们对EB病毒早期抗原的抑制活性。结果表明,在各种脂酰基中油脂酰基对甘油糖脂活性的贡献最大,其中单半乳糖基二油脂酰基甘油的抗肿瘤活性最强。未脂酰化的单半乳糖基甘油亦显示出与单半乳糖单脂酰甘油相似的抗肿瘤活性,这表明单半乳糖基甘油是MGDGs具有抗肿瘤活性的基本结构,而连接不同的脂酰基则对活性起到了不同程度的促进作用
(王辉等,2007;Cateni等,2007)。
意大利Colombo研究小组和日本Nagatsu研究小组联合对甘油糖脂抗肿瘤的构效关系做了进一步的研究,主要研究了三类单脂酰基2-O-β-D半乳糖基甘油酯,分别是1-位脂酰化、3-位脂酰化和糖环6’-位脂酰化的甘油糖脂,脂酰环链的长度范围为C4~C12。体外、体内活性实验结果表明,含有己酰基的此类甘油糖脂抗肿瘤活性最强;脂酰基在1-位上的活性比在其他位置的强,但差别并不是很明显;半乳糖基甘油糖脂的活性比葡萄糖基甘油糖脂的活性高。研究者认为,影响甘油糖脂的抗肿瘤活性强弱的最关键因素是脂酰基链的长度,与糖基及脂酰基的位置关系并不是很明显(Colombo等,1996)。
从淡水绿藻Chlorella vulgaris中分离到5种MGDGs和两种DGDGs。活性研究表明,有两种MGDG具有较强的抑制肿瘤生长的作用,含有7z,10z-十六碳二烯脂酰基的MGDG的抗肿瘤活性最强。从蓝藻Anabaena flosuquae中分离到糖基的6’-位羟基和甘油的1-位羟基脂酰化的甘油糖脂1-O-acyl-3-O-(6’-O-acyl-β-D-ga lactopyrano-syl)-sn-glycerol,后来利用脂酶选择性脂酰化合成了一系列具有不同脂酰基的此类甘油糖脂,研究发现含有不饱和脂酰基的糖脂抗肿瘤活性较强,并且半乳糖基6’-位上为棕榈油酰基的糖脂的抗肿瘤活性最强(Zhang等,2014)。
从人工培养的淡水微藻P.tenue中分离到的甘油糖脂可分为三类:MGDG,DGDG 和SQDG。活性检测这些具有不同脂酰基的甘油糖脂时发现,MGDG和DGDG抑制肿瘤的能力比SQDG强,测试的17个MGDGs和DGDGs中有3种DGDGs显示了很强的抑制肿瘤生长的活性(Murakami等,1991)。
(2)抑制纤维肉瘤的作用:对46种干燥的海藻(4种绿藻,21种褐藻,21种红藻)组织粉末进行抗肿瘤活性筛选,发现几种红藻具有明显抑制Ehrlich瘤的作用。为了证实海藻中的抗肿瘤活性成分,从这些褐藻和红藻中提取分离到的几种甘油糖脂具有明显的抑制纤维肉瘤的作用。
(3)对胃癌细胞的作用:美国科学家Quasney等研究了植物中的SQDG对人的胃癌细胞株SNU-1的作用。SNU-1细胞株分别在不同浓度的SQDG中培育72h,结果发现SQDG浓度为50μmol/L和0.5mmol/L时SNU-1的增殖被抑制,抑制率分别为24%和100%。其中SQDG的浓度为5mmol/L时,细胞增殖被抑制的同时伴随着部分细胞的凋亡;浓度为50mmol/L时,则引起细胞的坏死(Quasney等,2001)。
Sugawara等在研究SQDG/SQMG的构效关系时,发现它们对胃癌细胞株NUG C-3具有抑制作用:①SQMG对癌细胞株的生长具有明显的抑制作用,SQDG却没有这种效果;②糖苷键类型对活性没有影响;③随着SQMG的脂酰基链的增长,抑制活性亦增强。上文提到SQDG对DNA聚合酶的抑制作用优于SQMG,而对癌细胞株的生长却没有什么作用,这表明SQDG不能穿透细胞膜进入细胞中(Murakami等,2003)。
(4)对肺腺癌的作用:Sahara从海洋无脊椎动物海胆(Stronglocentrotus inter medius)的肠内分离到一种葡萄糖基3’-位为磺酸基的甘油糖脂(A-5)。体外实验表明,A-5对肿瘤细胞有细胞毒作用。对长有人类肺腺癌实体瘤的裸鼠进行体内实验表明,A-5具有较强的抑制实体瘤生长的作用,并且在用A-5处理过的老鼠的实体瘤处出现出血坏死区域,这表明A-5具有抑制肿瘤的活性(Sahara等,1997)。
此外,德国学者Wicke从与海绵共生的微生物Macrobacterium sp.中分离到4种与细胞相关的甘油糖脂,发现它们除了较好的表面活性外,还具有抗肿瘤的作用(Hölzl等,2007)。从人工培养的霉菌Schizonella meranongramma中分离到两种新型的糖脂Schizinellin A和B,它们可以抑制Ehrlich腹水癌细胞中的DNA、RNA和一些蛋白质的合成(Deml等,1980)。
4.抗炎活性
通过活性跟踪检测,从Okinawan海绵(Phyllospongia foliascenes)中分离到一种具有抗炎活性的半乳糖脂M-5,随后又合成了半乳糖脂M-5的类似物(菊地博等,1982)。
5.抑制补体结合反应
从Okinawan海绵中同时还分离到一种具有抑制补体结合反应的甘油糖脂SQDG(M-6)(Terasaki等,2003)。
6.消肿活性(https://www.xing528.com)
从褐藻裙带菜Undaria pinnatifida和Costaria costata的甲醇提取液中分离到DGDG,MGDG和SQDG都具有消肿作用,其中SQDG的作用最强(Katsuoka,Ogura等,1990)。
7.微藻溶解活性
Murakami等从人工培养的蓝藻P.tenue中分离到一些能引起微藻溶解的甘油糖脂MGDG,其中含有不饱和脂肪酸的具有较强的自身溶解(autolysis)活性,在浓度较低的情况下就可引起微藻溶解,含有饱和脂肪酸的在浓度达到100×106也不引起溶解。这说明甘油糖脂的生物活性和化学特性与其甘油上的脂酰基的组成和分布有关。随后又陆续分离到7种新的MGDG和6种新的DGDG。比较8种MGDGs和9种DGDGs的微藻溶解活性,发现MGDGs具有微藻溶解活性,DGDGs无微藻溶解活性。研究认为在这种微藻中,由于脂酰酶的作用使MGDG上的脂酰基被释放出来而引起自身溶解(Shirahashi等,1993)。
8.抗菌活性
从人工培养的霉菌Schizonella melanogramma中分离到两种甘油糖脂Schizinellin A 和B,具有抗革兰阳性菌和某些革兰阴性菌及一些真菌的作用(Deml等,1980)。
9.溶血活性
从两种有毒的海洋甲藻中分离到一些甘油糖脂,包括MGDG和DGDG,它们都具有溶血活性。从人工培养的霉菌中分离到的糖脂Schizinellin A和B对牛细胞有强的溶血活性。从亚热带水域的海洋深处收集到的一种甲藻,实验发现对小鼠具有较高的致死率、鱼毒性和溶血性,其中从Amphidinium carteri中分离到的溶血性物质为MGDG和
DGDG(周成旭等,2009)。
10.抗动脉粥样硬化
Karaninnis等通过一种新型的萃取过程,首先将橄榄油、玉米油、大豆油、向日葵油和芝麻油中的总脂(TL)分离成总极性脂(TPL)和总中性脂(TNL),然后通过HPLC进一步将总极性脂(TPL)和总中性脂(TNL)分离成不同组分。利用体外诱导或抑制免洗涤血小板聚集能力的生物活性测定方法,在TPL中发现了高含量的血小板激活因子(PAF)对抗剂,其中以橄榄油含量最高,结构鉴定为一种甘油糖脂,进一步科学证明了植物油特别是橄榄油能防止动脉粥样硬化的原因(蒋志国,2010)。
11.抗流感病毒的作用
Nakata等从水生细菌Corynebacterium aquaticum中分离到两种甘油糖脂H632A和S5365A,发现它们能够明显地与3种人类感冒病毒〔A/PR/8/34(H1N1),A/Aichi/2/68(H3NZ),A/Memphis/1/71(H3NZ)〕相结合。研究认为甘油糖脂的抗流感病毒作用主要体现为两点:一是抑制了病毒的血细胞的凝聚和溶解活性,其次是阻碍了被病毒感染了的Madin-Darby canine(犬)的肾细胞的胞液酶的外泄(吕国凯,2009)。
12.与淋巴细胞的结合作用
日本学者Toujima等从Acholeplasm Alaidlawii PG-8的膜中分离到一种甘油糖脂(GAGDG),随后合成了GAGDG的类似物。活性研究结果表明,GAGDG及其类似物与人类的淋巴细胞及外围T细胞的结合能力较高,这说明在原核生物Alaidlawii PG-8膜中的甘油糖脂可能参与了细菌细胞对真核细胞的黏附(吕国凯,2009)。
13.免疫抑制作用
日本学者Matsumoto等对SQDG的免疫抑制作用进行了探讨。根据从海洋动物海胆中分离到的SQDG设计合成4种SQDG:3-O-(6-deoxy-6-sulfono-α-glucopyranosyl)-bis-1,2-O-diacylglycerols,其中两个脂酰基为C16的称为a-SQDG(16∶0),脂酰基为C18的称为a-SQDG(18∶0)。在T细胞增殖检测(混合的淋巴细胞反应,MLR)中,除了化合物a-SQDG(16∶0)外,其他3种化合物都能显著地抑制MLR的结合,其中化合物b-SQDG(18∶0)对人类MLR具有最强的免疫抑制效应。这些化合物利用MTT法检测时没有细胞毒。检测化合物b-SQDG(18∶0)对老鼠同种皮肤移植排斥反应的抑制效果,发现b-SQDG(18∶0)延缓了老鼠的皮肤同种移植的排斥反应,但在病理组织学上并没有明显的相反效果,还需做进一步的研究(吕国凯,2009)。
14.抗氧化活性
从Microbacterium sp M874和Corynebacteriu aquaticum S365中分别分离到具有抗氧化活性的甘油糖脂M874B和S365B,它们能够阻止由tert-Butylhydroperoxide诱导的氧化的细胞的死亡。通过检测它们的PRS(alkyl peroxyl radical scavenging)活性来筛选抗氧化性,发现二者具有明显的抗氧化活性,化合物M874B的活性大于S365B,二者仅在脂酰基结构上有稍微的差异。实验发现M874B还能够保护由于加热和外部的H2O2所引起的细胞死亡,能够消除由H2O2释放的羟基自由基,这说明MGDG例如M874B是一种新型的氧自由基清道夫,能够终止某些反应的氧化因素(吕国凯,2009)。
此外,M874B能够增加人类白血病细胞HL-60的生长,并且能够明显抑制由TPA诱导的HL-60细胞的分化。由于M874B能够清除许多氧化性物质,研究者认为M874B对HL-60细胞的作用是由于其具有氧自由基清除活性,在细胞培养过程中它能够保护细胞免受环境中氧自由基的入侵而有利于细胞的生长。由TPA诱导的HL-60细胞的分化对羟基自由基的参与具有特异性,因此M 874B的抗氧化活性阻止了细胞的分化。
三、新糖脂类化合物
(一)核糖苷核糖基甘油糖脂
1.核糖苷核糖基甘油糖脂来源:海藻麒麟菜Eucheuma muricatum
麒麟菜属于红藻,到目前为止只对其所含氨基酸、蛋白质、多糖以及所含Ca,Fe,Mg,Zn等成分的分析研究有报道。在对化学成分的研究中,除已分离和通过波谱分析技术鉴定出若干已知成分和一种具有较高应用价值的植物增长激素Caulerpin化合物外,还发现了一种在自然界十分罕见的新的糖脂类化合物(图3-15)。

图3-15 核糖苷核糖基甘油糖脂的结构
2.提取方法
经过浸提、色谱层析分离、重结晶提纯后得一固体样品。为确定该化合物的化学结构,除进行UV,IR,MS及NMR等波谱分析外,还取部分样品水解并经甲酯衍生化处理后进行GC—MS分析。
3.生物活性
一类十分重要的生理活性物质,在体内细胞的相互作用和分化、生长控制和癌病转化、免疫识别、酶催化等方面都有着重要的生物作用。
(二)3-正十六烷酰氧基-2-(16”Z)-二十一碳烯酰氧基-丙三醇-1-β-D-半乳糖苷
1.来源:褐藻圈扇藻Zonaria diesingiana
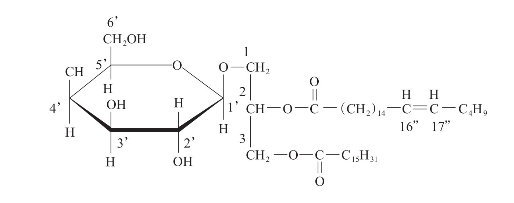
图3-16 3-正十六烷酰氧基-2-(16”Z)-二十一碳烯酰氧基-丙三醇-1-β-D-半乳糖苷的化学结构
2.提取方法
以乙醇浸提浓缩后将乙酸乙酯萃取物进行硅胶柱层析,以乙酸乙酯、石油醚为梯度洗脱剂。从80%的乙酸乙酯洗脱液中得一淡黄色固体,再以乙酸乙酯重结晶得到。
四、槐糖脂
(一)来源
目前能够产生槐糖脂的微生物主要是球拟酵母属(Torulopsis)和假丝酵母属(Candida)的一些酵母菌,后来酵母菌鉴定系统将球拟酵母属归类到假丝酵母属。用于 槐糖 脂生 产 和 研 究的 包括C.bogoriensis,C.apicola,C.bombicola,C.magnoliae,C.gropengiesseri,C.petrophilum,C.lipolytica,Rhodotorulabogoriensis等菌株,最常用的菌株是C.bombicola(梁吉虎,2011)。
(二)化学结构式
槐糖脂的化学结构见图3-17。

图3-17 槐糖脂的化学结构
(三)分离提取
槐糖脂的分离纯化一般采用乙酸乙酯等有机溶剂提取法,然后蒸发除去乙酸乙酯,用正己烷洗涤以除去脂质残留和乙醇等副产物,再蒸干完全除去正己烷。正己烷也可用甲基叔丁基醚或戊烷代替。由于槐糖脂比发酵液密度高,可采用离心法与发酵液初步分离后提取,且在某些培养基中内酯型槐糖脂以晶体形式直接析出(杨雪,2012)。
(四)营养价值和生理功能
1.食品工业方面
由于槐糖脂是生物表面活性剂的一种,因而具有表面活性剂的一些特性,如乳化活性、增稠作用、润滑作用等;又具有自身的优点,无臭、无味、无毒,添加到食品中不会对人体造成伤害。正是这些优点,为槐糖脂可以作为食品添加剂应用于食品工业提供了可能性(刘冉等,2016)。
2.医学方面
(1)抗炎:美国研究人员对槐糖脂的抗炎活性进行了深入研究,证实了槐糖脂通过调节一氧化氮、黏附分子和炎症细胞因子的生成,减少大鼠败血性腹膜炎模型中脓毒症的死亡率,同时也论证了不同剂量槐糖脂和不同衍生物对减少该脓毒症死亡率有影响。
槐糖脂作用于骨髓瘤细胞系(U266),可以降低IgE的生成,推测这种作用是通过影响血浆细胞活性产生的。后机制研究证实槐糖脂可以减少IgE协同因子BSAP(Pax5),TLR-2,STAT3和IL-6的mRNA表达,而不影响β肌动蛋白、细胞结构、增生和凋亡、IgA的产生以及FceRI和IL-6RmRNA的表达。最近,用槐糖脂对小鼠哮喘模型喷雾给药,证实槐糖脂能抑制哮喘病和卵白蛋白特异性IgE产生。以上研究为槐糖脂作为抗炎、IgE失调疾病以及哮喘病的治疗药物的应用提供了依据(刘冉等,2016)。
(2)抗肿瘤:1997年,粗品槐糖脂被发现能诱导人早幼粒白血病细胞HL-60分化为单核细胞,开启了槐糖脂抗肿瘤活性的研究(刘冉等,2016)。随后通过对纯化后的槐糖脂及其衍生物抗肿瘤活性的研究,发现其抗肿瘤活性可能与槐糖脂分子结构上的乙酰基有关。近几年槐糖脂抗肿瘤活性的研究仍在继续,Chen等报道由Wickerhamiella domercqiae生产的内酯型槐糖脂具有抗肿瘤活性,通过噻唑蓝(MTT)还原测定技术,后机制研究证实槐糖脂对细胞系H7402(人肝癌细胞系),A549(人肺腺癌细胞系),HL-60(人急性早幼粒白血病细胞系)和K 562(人慢性粒细胞白血病细胞系)具有抗性。研究还表明,槐糖脂可以诱导肿瘤细胞的凋亡。天然槐糖脂混合物及其衍生物对胰腺癌细胞有抗性。天然槐糖脂给药时细胞坏死率约20%,衍生物中甲酯衍生物的细胞坏死率最高约63%;酸型和双乙酸内酯型槐糖脂给药时,细胞坏死率则与其剂量有关,0.5mg/ml时细胞坏死率分别为49%和40.3%,增大到2.0mg/ml时基本无抗肿瘤活性。
(3)抗菌:Kim等报道了槐糖脂对枯草芽孢杆菌(Bacillus subtilis)、木糖葡萄球菌(Staphylococcusxylosus)、变形链球菌(Streptococcus mutans)、痤疮丙酸杆菌(Propionibacterium acne)和番茄灰霉病菌(Botrytis cineria)的抗菌活性,但对大肠杆菌(Escherichia coli.)生长没有抑制作用,并推测其抗菌活性取决于细菌的细胞壁结构(袁兵兵,2011)。通过测定胞内苹果酸脱氢酶,表明槐糖脂的抗菌机制是破坏细胞膜结构。后来Yoo等证实了槐糖脂对疫病霉菌(Phytophthora sp.)和腐霉菌(Pythium sp.)有生长抑制作用,并证实其活性与结构有关(伏圣秘,2014)。Shah等研究发现,以不同糖为底物得到的槐糖脂对微生物的抗性不同,也表明其抗菌活性与结构相关。
(4)抗病毒:由于女性艾滋病的发病率逐年上升,女性阴道杀菌避孕药物的开发显得尤为重要(刘冉等,2016)。Shah等发现槐糖脂衍生物有杀精子的作用,尔后他们进一步研究了天然混合物、酸型、内酯型槐糖脂及其各种衍生物的杀精子、抗艾滋病毒活性和细胞毒性。结果表明,槐糖脂的双乙酰化乙酯衍生物杀精子、抗艾滋病毒活性最高,效果和壬苯醇醚-9相近,但对阴道细胞有毒性;相对其他同类药物,其低毒高效,所以可通过化学改性对其进一步开发。
(五)槐糖脂研究现状及存在问题
作为食品添加剂,槐糖脂的添加方法、添加量是目前的研究热点。
研究槐糖脂在医药方面的应用,提高槐糖脂的高附加值,也是目前槐糖脂研究的热点。但是目前对于槐糖脂的分子结构与槐糖脂药学活性的关系还不清楚。有的文献报道可能与槐糖脂分子中的乙酰基有关。另外,还有人报道多糖的抗肿瘤活性可能与糖苷键的类型有关,如β-1,2糖苷键,由于槐糖脂中的槐糖部分是两个葡萄糖分子以β-1,2-糖苷键连接,这可能也与槐糖脂具有抑菌和抗肿瘤活性有关。因此,研究和探讨槐糖脂的分子结构与其药学活性的关系,以及阐明槐糖脂引起肿瘤细胞凋亡的作用靶点和凋亡途径,是今后的研究目标。
五、鼠李糖脂
(一)鼠李糖脂的来源
鼠李糖脂是由假单胞菌类产生的一种生物代谢性质的生物表面活性剂,同时也是一种研究时间最长、应用技术最为成熟的一种生物表面活性剂。它在土壤、水体和植物中都自然存在。它属于一种糖脂类的阴离子表面活性剂(杜瑾等,2015;王爽,2013;孙瑾,2015; 沙如意,2012;巩志金等,2015)。
鼠李糖脂具有增溶、乳化、消泡、降低表/界面张力、分散与絮凝、抗静电和润滑等多种功能,同时还具有表面活性高、低毒、可自然生物降解等特性,是研究较深入的生物表面活性剂之一,在石油开采、食品、医药、化妆品等领域具有极大的潜在应用价值。近年来,鼠李糖脂在生物修复重金属、持久性有机污染物等污染场地中的应用备受关注。鼠李糖脂对真菌、细菌、植物病毒具有一定的抑制作用,并被证明是一种稳定的胞外溶血素。最近研究表明,Burkholderia pseudomallei产生的鼠李糖脂同系物还具有一定的细胞毒素活性。鼠李糖脂所具有的这些特性抑制了菌体周围杂菌的生长,增加了菌株对环境的适应性以及竞争力。
国内外一般采用铜绿假单胞菌(Pseudomonas aeruginosa)利用不同碳源来产生鼠李糖脂。通常表述的“鼠李糖脂”不是一种单一的结构体,而是由很多种同族结构组成的混合物,在已知的报道中已经发现多达28种(另有说法为60种)不同结构的鼠李糖脂结构。其具备一般表面活性剂的基本特征,亲水基团一般由1~2分子的鼠李糖环构成,憎水基团则由1~2分子具有不同碳链长度的饱和或不饱和脂肪酸构成。在生物合成过程中,这些基团之间可能相互连接而生成多种化学结构相近的同系物。研究表明,发酵产物中一般含有4种主要的鼠李糖脂(图3-18),学术界一般用R1-R4(或RLl-RL4,RH1-RH4)表示,结构通式为:

图3-18 鼠李糖脂的化学结构式
鼠李糖脂的结构多达几十种,一般在学术界经常看到双鼠李糖脂和单鼠李糖脂的表述,单双是指鼠李糖脂结构中的糖环的数量,外文文献表示为:di-rhamno lipid(双)、mono-rhamno lipid(单)。
多种铜绿假单胞菌(Pseudomonas aeruginosa)都可利用不同碳源合成RL。RL的制备主要通过微生物发酵,再从发酵液中提取得到,生产RL的菌种以铜绿假单胞菌最为常用。目前,国内经微生物发酵得到的RL产量较低,分离提取工艺复杂,且成本偏高,限制了鼠李糖脂的规模化生产及应用。因此,提高发酵液中的鼠李糖脂产量,降低提取成本,对RL的推广应用有重要意义。
可以筛选出优良菌种,对其进行发酵,通过单因素试验和正交试验对发酵条件进行优化,确定菌株的最优的碳源、氮源和无机盐等发酵条件,提高发酵液中鼠李糖脂的含量。
常规鼠李糖脂提取纯化的方法包括酸降解、溶液萃取、硫酸铝沉淀、离子交换色谱法和离心分配色谱法等。组分鉴定可用HPLC-MS、红外光谱、核磁共振和毛细管电泳,其中,HPLC-MS最为精确。发酵液中鼠李糖脂含量的测定可用蒽酮硫酸法、苯酚硫酸法和苔黑酚硫酸法,其中,蒽酮硫酸法用得最多和最准确。
(二)鼠李糖脂的分离纯化
用2mol/L NaOH溶液调节发酵液pH至8.0,在10733g离心条件下离心15min后收集上清液。用6mol/L HCl调节上清液pH至2.0,在4℃下静置过夜;然后于10733g离心力下离心15min,收集底物,用去离子水洗涤3次并冷冻干燥,得到粗鼠李糖脂混合物。将其溶于氯仿,真空抽滤去除蛋白质等不溶杂质后用柱色谱法进行纯化,柱色谱填充物选用的是对糖脂类生物表面活性剂分离性能较优的薄层色谱硅胶。硅胶在105℃活化24h后采用湿法装柱,将氯仿溶液与活化后的硅胶混合引流入玻璃柱(320mm× 25mm)中,并注意排尽残留气泡。将粗鼠李糖脂的氯仿溶液小心沿色谱柱内壁壁周注入色谱柱的顶部,打开柱阀,使鼠李糖脂吸附到顶部硅胶上。采用500ml的氯仿对硅胶柱淋洗以除去鼠李糖脂中的中性脂,然后依次用100ml(10∶1,V/V),200ml(2∶1,V/V),100ml(1∶1,V/V)和200ml(1∶2,V/V)的氯仿和甲醇混合液进行梯度洗脱,淋洗液的流速控制在2ml/min,定量收集淋洗液。采用薄层色谱(TLC)对溶液成分进行鉴定,用硅胶板(HF 254,青岛海洋化学品公司)作为展开板。展开剂成分为CHCl3/ CH3OH/CH3COOH(65/15/2,V/V/V),莫氏试剂作为显色剂。鼠李糖脂的单糖脂和二糖脂洗出液分别合并后于40℃真空旋转蒸发除去溶剂,得到单糖脂和二糖脂产品,并做进一步定性分析。
(三)鼠李糖脂发酵菌种的改良和筛选
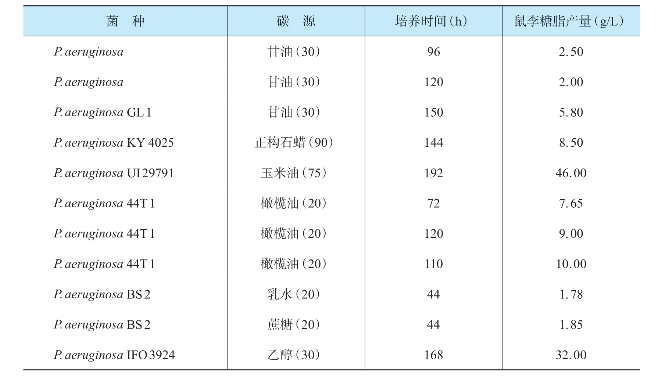
产鼠李糖脂菌株一般为假单胞菌属,包括铜绿假单胞菌、荧光假单胞菌等菌种。由于铜绿假单胞菌产鼠李糖脂的产量相对于其他菌株发酵鼠李糖脂产量较高,因此,利用微生物生产鼠李糖脂时常选用铜绿假单胞菌作为生产菌株(张翠坤等,2015)。该菌种是一种革兰阴性菌,大部分为专性需氧、好能营养型菌株,个别菌株能利用H2进行自养生长,最适温度一般为30℃左右,最适pH范围为6.8~8.0。菌体形态为杆状,能利用的碳源种类较多,包括葡萄糖、脂肪酸、芳香族化合物等。表3-2为某些铜绿假单胞菌在摇瓶中或生物反应器中的产量。从表中可以看出,虽然铜绿假单胞菌发酵鼠李糖脂产量的报告相差较大,但总体上还处于一个较低的水平上,产量较低使得铜绿假单胞菌发酵生产鼠李糖脂还只局限于摇瓶培养阶段,因此需要对菌种继续进行改良(王爽,2013)。
表3-2 某些铜绿假单胞菌在摇瓶或生物反应器中的产量
菌株改良的方法之一便是菌株诱变。微生物诱变的手段大体可分为物理诱变和化学诱变。物理诱变一般包括紫外线诱变、等离子体诱变、X射线诱变等,是通过物理手段对DNA造成伤害,导致碱基错配,形成突变株。化学诱变方法往往采用化学试剂直接影响诱变菌株的DNA复制,主要采用的试剂包括烷化剂、碱基类似物(base analog)、羟胺(hydroxylamine)、吖啶色素等物质。化学诱变剂自身及其挥发的蒸气中往往具有较强的致癌性,因此在使用过程中容易造成人身伤害,需格外谨慎。微生物诱变往往需采用多种诱变方式,单一诱变形式容易导致诱变效率降低,多种诱变方式的使用易于提高诱变水平,获得高产菌株(王爽,2013)。
同时,由于铜绿假单胞菌是一种潜在致病菌,可引起败血症等症状,该特点在某种程度上限制了铜绿假单胞菌发酵鼠李糖脂的生产。因此,利用传统诱变手段改良菌株的同时,还可采用基因工程技术改良菌株特性。2005年,山东大学李清心将rhlAB基因转入无潜在致病性的假单胞菌受体菌中,并在强启动子的作用下,受体菌可以更高效地合成鼠李糖脂,较大地提高了鼠李糖脂的产量。这种工程菌的构建避免了铜绿假单胞菌生产鼠李糖脂过程中的潜在致病性问题,使其可以在制药、化妆品行业中广泛应用(孙超,2012)。
鼠李糖脂菌株的改良离不开快速高效的鼠李糖脂高产菌株筛选方法。随着人们对鼠李糖脂理化性质研究的不断深入,用于菌株筛选的鼠李糖脂定性定量方法也日益增多。如基于鼠李糖脂与CTAB非亲和作用的筛选方法、基于鼠李糖脂溶血特性的筛选方法、基于鼠李糖脂表面活性的筛选方法、基于鼠李糖脂糖基性质的筛选方法和基于色谱层析的筛选方法。其中,CTAB应用最为广泛。
(四)基于鼠李糖脂与CTAB非亲和作用的筛选方法
目前,应用较广泛的鼠李糖脂产生菌筛选法为蓝色凝胶平板筛选法,即十六烷基三甲基溴化铵(CTAB)琼脂平板筛选法。该方法原理为,十六烷基三甲基溴化铵在培养基中达到一定浓度后,其非极性部分结合形成胶束,该胶束与菌体分泌的鼠李糖脂不亲和,菌体产生鼠李糖脂时,胶束便分布在菌株周围,由于十六烷基三甲基溴化铵吸附亚甲基蓝,利用亚甲基蓝作指示剂,菌株周围便形成蓝色光晕。蓝色凝胶平板筛选法是一种应用简便、效果较好的菌株筛选方法(张翠坤等,2015;马东林等,2014)。
晕圈的大小在一定程度上反映了鼠李糖脂的分泌水平。因此,CTAB平板法可区分产鼠李糖脂与不产鼠李糖脂的菌株。向环境样品加入无菌生理盐水稀释,振荡后静止10min,取上清液涂布在CTAB平板上,挑选其上生长的菌株三区划线纯化保存。将获得的分离菌株与实验室保藏的假单胞菌属菌株单菌落点种在CTAB平板培养基上,37℃培养72h。观察菌落周围是否出现深蓝色晕圈,并测量菌落直径与晕圈直径,晕圈直径与菌落直径的比值大致与鼠李糖脂的产量呈正比。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




