1.催化剂发生作用时反应系统的状态
工业上通常根据催化剂和反应物系的状态,将催化作用分为均相催化和多相催化两类。当催化剂和反应物同处于一个溶液或气体混合物组成的均匀体系中时,其催化作用称为均相催化作用;而当催化剂与反应产物处于不同相时(通常是催化剂呈固体,反应物为气体或液体),其催化作用称为多相催化作用。用催化转化法降解燃煤烟气中的氮氧化物属于多相催化反应。在多相催化反应中,反应物在催化剂表面上的接触是关键因素之一,因为催化反应是在催化剂表面完成的。反应物接触催化剂表面首先需在表面上被吸附,这种吸附往往是化学吸附,化学吸附的结果导致反应物分子化学键的松弛,使反应得以进行下去。因此,也称固体催化剂为触媒。
通常用降低反应活化能的程度反映催化剂的活性,从表2-1可以清楚地看出催化剂对反应活化能的降低程度
表2-1 催化反应与非催化反应的活化能
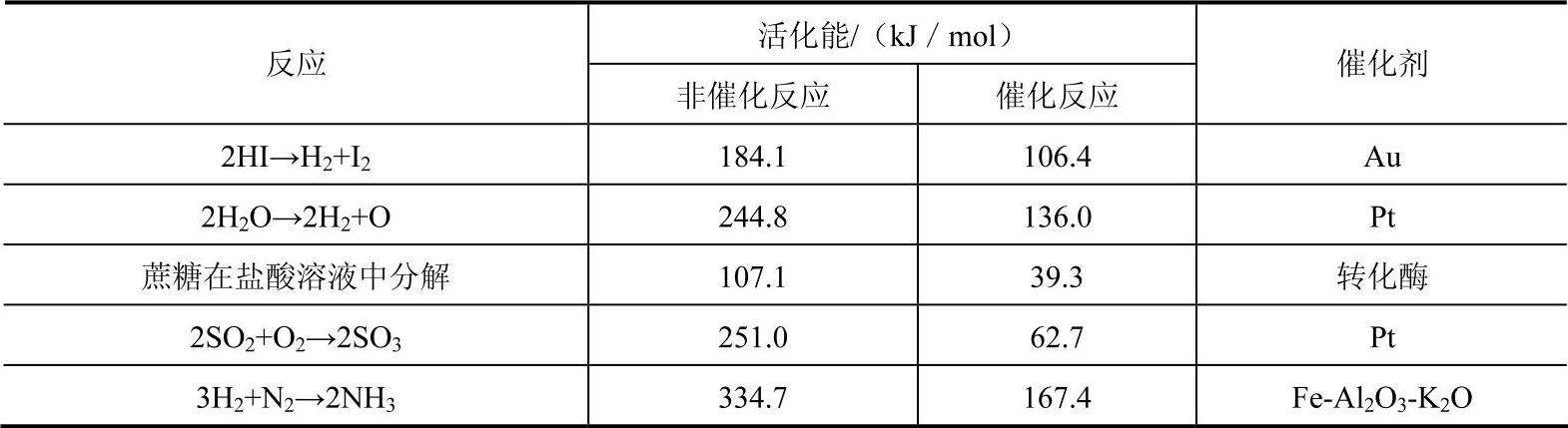
催化作用能降低反应的活化能,从而加快化学反应速率的特征,还可以从阿伦尼乌斯关系式得到解释。当反应物浓度一定时,其反应速率的加快表现在速度常数的加大上,阿伦尼乌斯关系式如下:

式中k——反应速度常数;
α——频率因子;
E——反应活化能;
T——绝对温度;
R——气体常数。
由式(2-1)可以看出,E的降低会使k增加。催化作用控制反应的方向主要表现在化工生产上。有些有机反应,可能有几个不同的反应方向,因而所得到的产物十分复杂,降低了主产品的产率。若选择合适的催化剂,能使反应方向沿着设计所需的方向进行,提高了主产品的产率,从而降低副产品的含量。
2.催化剂作用的突出特征(https://www.xing528.com)
催化剂有如三个突出的特征。
(1)加快化学反应速度 控制反应方向加快化学反应速度是催化剂最为显著的特征。例如,N2和H2之间的反应,在无催化剂作用的情况下,即使在400℃下看不到发生反应,但以铁为催化剂时,反应速度却能显著地提高。催化剂之所以能加快反应速度,是由于它改变了反应的历程,从而降低了反应的活化能,使反应得以迅速进行,缩短了反应达到平衡的时间。
(2)催化作用不能改变化学平衡和反应热 从热力学的观点看,在化学反应体系中催化剂不能改变体系中的自由能变化(GΔ0),只能改变化学反应速度。化学反应的自由能变化GΔ0与平衡常数Ka间的关系式为:

式中 T——绝对温度
R——气体常数
由式(2-2)可以看出,催化作用也不能改变化学平衡。由此特征可知,催化剂只能在化学热力学容许的条件下,在动力学上对反应施加影响,提高其达到平衡状态的速率。对于受化学反应体系平衡限制,必须在有利于平衡的基础上来选择和使用催化剂。
在选择催化剂时,一般应在远离平衡的条件下来考察催化剂的性能,即须在很大推动力的条件下,来观察催化剂在动力学上的效应,从而对不同的试样进行比较
(3)催化作用有特殊的选择性 特定的催化剂只能催化特定的反应。这种选择性使人们有可能对复杂的反应系统从动力学上加以控制,使之向特定方向进行,生产出特定的产物。例如,用催化剂可使乙烯被选择性地氧化为环氧乙烷,减少生成CO2和H2O;在氨选择性还原NOX的过程中,Cu-Cr催化剂只加速氨和NOX的反应相对抑制NH3和O2的反应,从而降低氨耗。可见,对于在热力学上副反应占优势的反应系统,催化作用能有选择地使特定的反应加速。
3.催化作用原理
固体表面上的吸附可分为物理吸附和化学吸附。物理吸附不能改变被吸附分子的键价;化学吸附则来源于化学键价,它能使被吸附分子的键价发生变化,或引起分子的变形,从而产生催化作用。所以,化学吸附是多相催化的基础。在研究催化机理时,就是研究反应物如何被固体催化剂吸附,以及吸附的状态和规律。多相反应中,气体在吸附剂表面吸附与否,吸附强弱程度都与催化反应密切相关。应选择对反应物有适当强弱吸附能力的物质作催化剂,对不能吸附气体反应物的物质可选作载体。在气固相催化反应中,最具有代表性的是固体电子理论和活性中心模型理论。固体电子理论和活性中心模型理论都认为,在气-固相催化反应中,吸附质与催化剂之间生成了中间活性物,从而改变了反应路线,使活化能降低。但是固体电子理论认为反应物、中间活性物和催化剂之间都是通过电子转移来改变化学键性质的活性中心模型理论则认为化学吸附键的形成并不是经典意义上的电子转移造成的,而是催化剂表面不均匀出现许多活性中心,尤其是在表面缺陷和棱角等价键中有较大不饱和的部位,比如在金属催化剂、氧化物半导体催化剂等固体表面上,都存在大量的活性中心。活性中心模型理论经历了三个阶段的发展,第一阶段只是提出了活性中心理论,认为由于催化剂表面活性中心对反应物分子的化学吸附,导致了反应物分子中化学键的松弛,生成了中间活性物种,引起催化反应的发生。但活性中心理论并没有对中间活性物种的结构和性质作更深入的研究。
另外,活性中心理论还提出了一个重要的概念,就是催化剂活性中心在催化剂表面上所占的面积很小,而微量毒物就能使催化剂失去活性,因而,发现催化剂的活性中心与制备条件有很大的关系,这一发现促进了人们对催化剂制备方法的研究随着研究的深入,又出现了活性配合物理论(过渡态理论)。理论认为,活性中心吸附了反应物分子之后形成了中间活性物,具有较大的活性,称为活化配合物,这种活化配合物既容易形成,也容易分解。在进一步的反应中,它又与另外的反应物分子形成最终产物而释放出催化剂。由于活化配合物的生成,改变了反应,使活化能大大降低。但这一理论解释不了催化剂的选择性。
为了解释催化剂的选择性,提出了多位活性配合物理论。这一理论包括了空间适应性原则和能量适应性原则。空间适应性原则认为,多相化学反应中,不是所有的反应物分子都能被活性中心吸附,它必须要求催化剂的空间结构与反应物分子的空间结构相适应,才能产生有效的吸附。比如,反应物分子要断裂的键应与活性中心催化剂分子的键在长度和方向上一致,如反应物分子为对称正六角形,要求催化剂原子间的排列也必须是对称的正六角形,只有这样,催化剂与反应物分子才能产生有效的吸附。由于这种吸附需要多于一个活性位以上的吸附,所以才有多位之称但研究中又发现,用Pt催化烯类的脱氢反应时,Pt具有很高的催化活性,但改用空间结构与Pt相同的Zn和Cu作催化剂,并无催化活性。这说明,仅有空间适应性还不一定能产生有效的化学吸附,必须具备能量有一定的适中性。这就是所说的能量适中性原则,这一原则还包括催化剂与反应分子之间形成的配合键也不能太强,这样会不利于中间配合物的继续分解。正是由于多位理论提出的空间适应性与能量适中性原则,正确地解释了催化剂的选择性,这一个理论的出现,给人们在催化剂的选择和制造上提供了依据。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




