知识链接
混合碱是Na2CO3 与NaOH 或Na2CO3 与NaHCO3 的混合物。常用双指示剂法测定其含量。就是分别以酚酞和甲基橙为指示剂,在同一份溶液中用盐酸标准溶液进行连续滴定,根据两个终点所消耗的盐酸标准溶液的体积计算混合碱中各组分的含量。
安全提示
(1)注意强碱对皮肤的腐蚀与刺激。
(2)如皮肤不慎被NaOH 溅到,应迅速用流动的水冲洗到创面无肥皂样滑腻感,再用5%硼酸液温敷10~20 min,然后用水冲洗。如眼睛不慎被NaOH 溅到,应立即用大量流动的水清洗,也可把面部浸入充满流动水的器皿中,转动头部,张大眼睛清洗 10~20 min,再用生理盐水冲洗,并滴入可的松液与抗生素。
(3)使用盐酸时,应配合个人防护装备。如橡胶手套或聚氯乙烯手套、护目镜、耐化学品的衣物和鞋子等,以降低直接接触盐酸所带来的危险。皮肤接触:立即脱去污染的衣着,用大量流动清水冲洗至少15 min,可涂抹弱碱性物质,如肥皂水等。
(4)实验室应佩戴护目镜和防护手套。
一、实训目的
(1)进一步熟练滴定操作和滴定终点的判断。
(2)掌握双指示剂法测定混合碱的原理和组成成分的判别及计算方法。
二、实训原理
混合碱是Na2CO3 与NaOH 或Na2CO3 与NaHCO3 的混合物。欲测定同一份试样中各组分的含量,可用HCl 标准溶液滴定,选用两种不同指示剂分别指示第一、第二化学计量点的到达。根据到达两个化学计量点时消耗的HCl 标准溶液的体积,便可判别试样的组成及计算各组分含量。
在混合碱试样中加入酚酞指示剂,此时溶液呈红色,用HCl 标准溶液滴定到溶液由红色恰好变为无色时,则试液中所含NaOH 完全被中和,Na2CO3 则被中和到NaHCO3,若溶液中含NaHCO3,则未被滴定,反应如下:
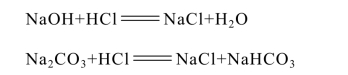
设滴定用去的HCl 标准溶液的体积为V1(mL),再加入甲基橙指示剂,继续用HCl标准溶液滴定到溶液由黄色变为橙色。此时试液中的NaHCO3(Na2CO3 第一步被中和生成的,或是试样中含有的)被中和成CO2 和H2O。
![]()
此时,又消耗的HCl 标准溶液(即第一计量点到第二计量点消耗的)的体积为V2(mL)。
当V1>V2 时,试样为Na2CO3 与NaOH 的混合物,中和Na2CO3 所需HCl 是分两批加入的,两次用量应该相等。即滴定Na2CO3 所消耗的HCl 的体积为2V2,而中和 NaOH 所消耗的HCl 的体积为(V1-V2),故计算NaOH 和Na2CO3 的含量公式应为:
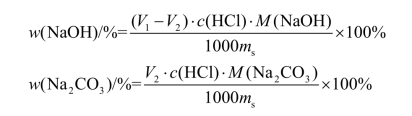
当V1<V2 时,试样为Na2CO3 与NaHCO3 的混合物,此时V1 为中和Na2CO3 时所消耗的HCl 的体积,故Na2CO3 所消耗的HCl 的体积为2V1,中和NaHCO3 消耗的HCl 的体积为(V2-V1),计算NaHCO3 和Na2CO3 含量的公式为:
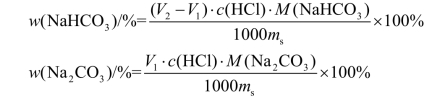
式中 ms—— 混合碱试样质量,g。
三、实训用品及准备
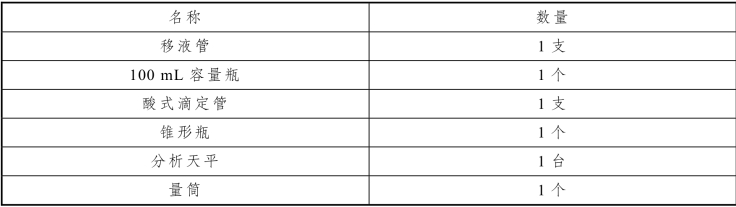
1.实训仪器
表5-22 混合碱的分析实训仪器
2.实训试剂
表5-23 混合碱的分析实训试剂
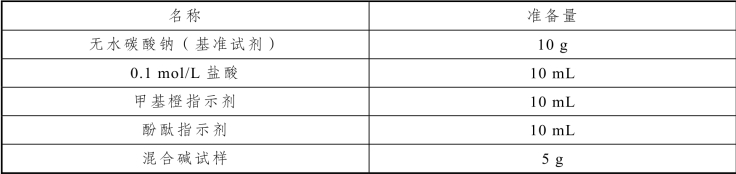
0.1 mol/L 盐酸的配制:3 mL 浓盐酸稀释至330 mL,转入试剂瓶,摇匀,贴标签(在通风橱中配,老师先示范)。
四、实训内容(https://www.xing528.com)
1.盐酸的标定
洗净酸式滴定管,经检漏、润洗、装液、静置等操作,备用。
准确称取无水碳酸钠2 份,每份0.10~0.12 g(或准确称取1.0~1.2 g 无水碳酸钠,溶解后,定容在250 mL 容量瓶中,用25 mL 移液管移取),分别放在250 mL 锥形瓶内,加水20~30 mL 溶解,小心摇匀,加指示剂1~2 滴,然后用盐酸滴定至溶液由黄色变为橙色,即为终点。平行滴定3 份,计算HCl 标准溶液的浓度。其相对平均偏差不得大于0.3%。
2.混合碱水溶液配制
准确称取2 g 混合碱样品溶解于小烧杯中,转移到250 mL 容量瓶中,定容、摇匀。
3.混合碱的测定
(1)用移液管移取已配好的混合碱溶液25 mL 于250 mL 锥形瓶中,加入3 滴酚酞指示剂,立即用0.1 mol/L HCl 标准溶液滴定至由红色变为近无色,记下所消耗HCl 的体积V1(mL)。
(2)加入甲基橙指示剂2 滴,继续用HCl 标准溶液滴定至由黄色变为橙色,记下第二次所消耗HCl 的体积V2(mL)。平行测定3 次。
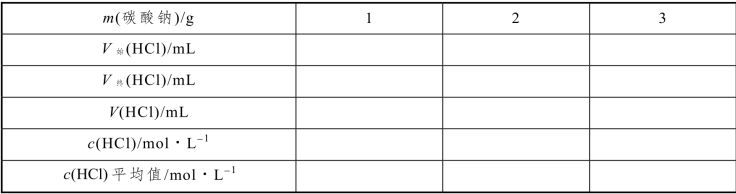
五、数据记录与处理
表5-24 HCl 标准溶液浓度标定数据记录
计算公式:
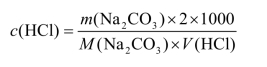
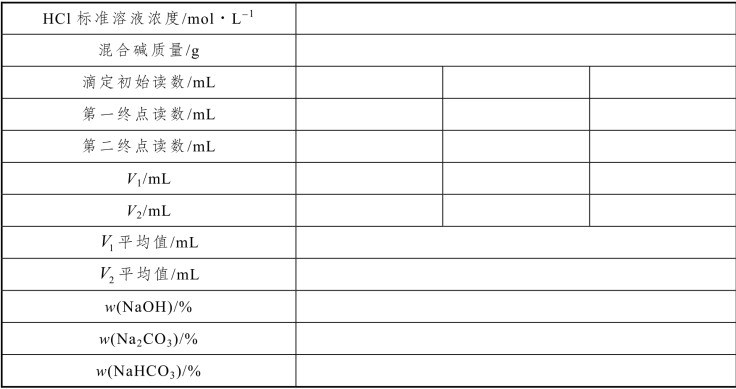
表5-25 混合碱的分析数据记录
六、注意事项
(1)称量无水Na2CO3 基准物时,称量瓶一定要带盖,以免吸湿。
(2)滴定速度宜慢,近终点时每加一滴后摇匀,至颜色稳定后再加第二滴,否则因颜色变化较慢容易过量。
(3)在第一终点滴完后的锥形瓶中加甲基橙,立即滴V2。千万不能在3 个锥形瓶先分别滴V1,再分别滴V2。
(4)最好用浓度相当的 NaHCO3 的酚酞溶液做对照,在到达第一终点前,滴定速度不要过快,否则会造成溶液中HCl 局部过浓,引起CO2 损失,带来较大的误差;滴定速度亦不能太慢,摇动要均匀。
(5)临近第二终点时,一定要充分摇动,以防止形成CO2 的过饱和溶液而使终点提前到达。
七、实训评估
表5-26 混合碱的分析实训评估
八、拓展练习
(1)什么叫双指示剂法?
(2)用盐酸滴定混合碱液时,将试液在空气中放置一段时间后滴定,会给测定结果带来什么影响?若到达第一化学计算点前,滴定速度过快或摇动不均匀,对测定结果有何影响?
(3)采用双指示剂法测定碱试样,试判断下列5 种情况,碱试样中存在的成分是什么?
① V1=0 ② V2=0 ③ V1>V2 ④ V1<V2 ⑤ V1=V2
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




