知识链接
饼干是以谷类粉(和/或豆类、薯类粉)等为主要原料,添加或不添加糖、油脂及其他原料,经调粉(或调浆)、成型、烘烤(或煎烤)等工艺制成的食品,以及熟制前或熟制后在产品之间(或表面,或内部)添加奶油、蛋白、可可、巧克力等的食品。
部分饼干在制作过程中需要加入膨松剂。膨松剂指食品加工中添加于生产焙烤食品的主要原料小麦粉中,并在加工过程中受热分解,产生气体,使面坯起发,形成致密多孔组织,从而使制品膨松、柔软或酥脆的一类食品添加剂。通常应用于糕点、饼干、面包、馒头等以小麦粉为主的焙烤食品制作过程中,焙烤食品的生产,如碳酸氢钠加入食品中,经烘烤加热产生二氧化碳,在食品内部形成均匀、致密的孔性组织,体积增大,使面包、蛋糕等食品柔软富有弹性,使饼干酥松,口感好。
膨松剂可分为碱性膨松剂和复合膨松剂两类。
1.碱性膨松剂
主要是碳酸氢钠,产生二氧化碳,使面坯起发。酸性物质可中和在产生二氧化碳过程中所形成的碱性盐,以及调节二氧化碳产生的速度。而淀粉等则具有有利于膨松剂保存,调节气体产生速度,使气泡分布均匀等作用。
2.复合膨松剂
复合膨松剂的配方很多,且依具体食品生产需要而有所不同。饼干加工中常用的复合膨松剂是泡打粉,它是由苏打粉配合其他酸性材料,并以玉米粉为填充剂的白色粉末。泡打粉在接触水分,酸性及碱性粉末同时溶于水中而起反应,有一部分会开始释出二氧化碳,同时在烘焙加热的过程中,会释放出更多的气体,这些气体会使产品达到膨胀及松软的效果。快速反应的泡打粉在溶于水时即开始起作用,而慢速反应的泡打粉则在烘焙加热过程开始起作用,其中双重反应泡打粉兼有快速及慢速两种泡打粉的反应特性。一般市面上所采购的泡打粉皆为双重反应泡打粉。
无论是碱性膨松剂或是复合膨松剂,成分中都含有碳酸钠和碳酸氢钠,碳酸氢钠在人体内分解成碳酸钠、水和二氧化碳。水对人体是无害的,二氧化碳若不是大量对胃部也不会有很大的损害。但若长期摄入,碳酸钠可能会引起代谢性碱中毒和钠大量潴留(引起低钾血症),对心肾功能不全的患者不利,另外还会影响胃酸的分泌。故应对饼干中碳酸钠和碳酸氢钠的含量进行严格控制。
安全提示
(1)盐酸具有腐蚀性,破坏皮肤组织,注意切勿接触皮肤及衣服,配制前可佩戴好橡胶手套。配制稀盐酸时,要求将盐酸缓慢地倒入水中,配制过程应在通风橱中进行,若不慎沾到皮肤及衣服,应先用干布蘸干,再用饱和碳酸氢钠溶液冲洗
(2)按照滴定规程规范操作。
(3)实验废液应倒入指定的容器,不能随手倒在水槽中。
一、实训目的
(1)巩固盐酸标准滴定液的配制与标定。
(2)巩固用递减称量法称量固体。
(3)掌握用酸碱滴定法测定混合碱含量的原理和方法。
二、实训原理
浓盐酸因含有杂质而且易挥发,因而不能直接配制成标准溶液,需要先配制成近似浓度的溶液,然后用其他基准物质进行标定。
常用于标定酸溶液的基准物质有:碳酸钠(Na2CO3)或硼砂(Na2B4O7·10H2O);用碳酸钠(Na2CO3)标定HCl 溶液反应方程式如下:
![]()
混合碱指NaOH 和Na2CO3 或Na2CO3 和NaHCO3 等类似的混合物,可采用双指示剂法进行分析,并测定各组分的含量。
三、实训用品及准备
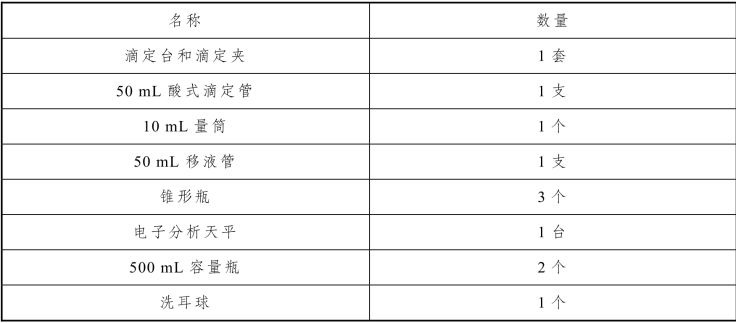
1.实训仪器
表3-26 饼干中碳酸钠和碳酸氢钠含量的测定实训仪器
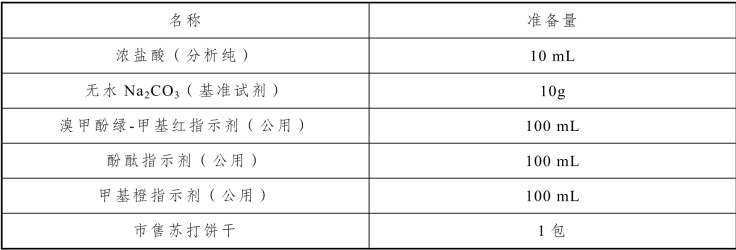
2.实训试剂
表3-27 饼干中碳酸钠和碳酸氢钠含量的测定实训试剂
(1)工作基准试剂无水Na2CO3:先置于270~300 °C 高温炉中灼烧至恒重,保存于干燥器中。
(2)溴甲酚绿-甲基红指示剂(变色点pH=5.1):
溶液Ⅰ:称取0.1 g 溴甲酚绿,溶于乙醇(95%),用乙醇(95%)稀释至100 mL;
溶液Ⅱ:称取0.2 g 甲基红,溶于乙醇(95%),用乙醇(95%)稀释至100 mL;
取30 mL 溶液Ⅰ,10 mL 溶液Ⅱ,混匀。
(3)酚酞指示剂:称取0.1 g 酚酞,然后用少量95%乙醇溶解,稀释到100 mL。
(4)甲基橙指示剂(1 g/L):称取1.000 g 甲基橙溶于1000 mL 蒸馏水中,摇匀即可。
四、实训内容
1.HCl( 0.1 mol/L) 标准溶液的配制与标定
(1)0.1 mol/L HCl 溶液的配制
用洁净的10 mL 量筒量取浓盐酸4.5 mL,倒入小烧杯中,加入少量蒸馏水,然后转移到500 mL 洁净的容量瓶中,用蒸馏水稀释至500 mL,盖上玻璃塞,摇匀,贴好标签。
(2)0.1mol/L HCl 溶液的标定
准确称取无水Na2CO3 0.12~0.14 g 于锥形瓶中,加30 mL 蒸馏水溶解。再往锥形瓶中加入甲基红-溴甲酚绿混合指示剂1~2 滴,用配制的HCl 溶液滴定至溶液刚刚由绿变紫红色,煮沸约2 min。冷却至室温(或旋摇2 min)继续滴定至暗紫色即为终点,记录所消耗HCl 溶液的体积。平行测定3 份。
2.饼干中碳酸钠、碳酸氢钠的含量测定
(1)试样溶液制备
饼干试样捣碎后,用减量法精密称取精确称取10 g(称准至0.001 g)于100 mL 烧杯中。加入40 mL 新煮沸并冷却的蒸馏水,用煮沸过的蒸馏水定量转移至500 mL 容量瓶中,并稀释到刻度,充分搅动混匀后备用。将样品溶液小心地用双层慢速定性滤纸过滤,弃去前20 mL,收集滤液备用。
(2)测定
① 移取50 mL 滤液于250 mL 锥形瓶中,加入50 mL 新煮沸过的蒸馏水,3~4 滴酚酞指示剂溶液,然后用0.1 mol/L 盐酸标准溶液滴定至浅粉红色即为终点。滴定耗用盐酸标准溶液的体积为V1。
② 加入3~4 滴甲基橙指示剂溶液,继续用0.1 mol/L 盐酸标准溶液滴定至溶液由黄色变为橙色。用去的HCl 溶液的体积为V2。重复测定2~3 次,其相对偏差应在0.5%以内。
五、数据记录与处理
1.0.1 mol/L HCl溶液的标定(https://www.xing528.com)
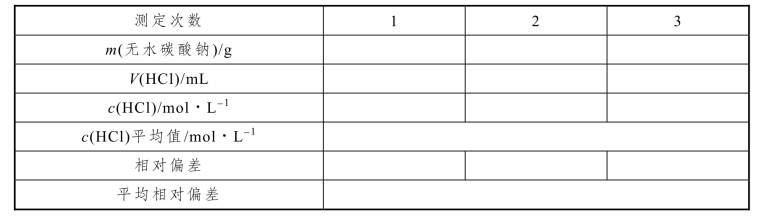
(1)数据记录
表3-28 0.1 mol/L HCl 溶液的标定数据记录
(2)结果计算
盐酸标准滴定溶液的浓度按下式计算:
![]()
式中 c—— 盐酸标准滴定溶液的实际浓度,mol/L;
m—— 基准无水碳酸钠的质量,g;
V—— 盐酸标准溶液用量,mL;
0.0530—— 与1 mL 盐酸标准滴定溶液[c(HCl)=1 mol/L]相当的基准无水碳酸钠质量,g。
2.饼干中碳酸钠、碳酸氢钠含量的测定
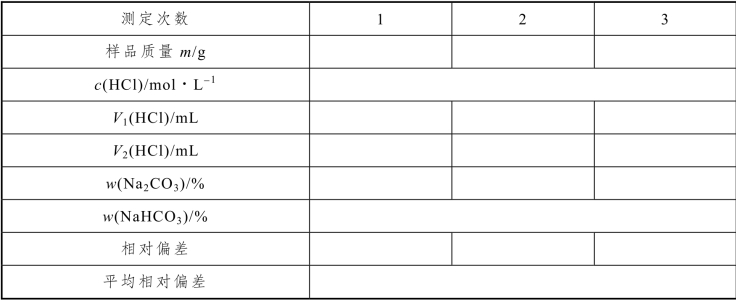
(1)数据记录
表3-29 饼干中碳酸钠和碳酸氢钠含量的测定数据记录
(2)结果计算
饼干中碳酸钠含量按下式计算:
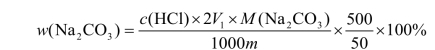
式中 c(HCl)—— 盐酸标准滴定溶液的实际浓度,mol/L;
m—— 饼干样品的质量,g;
V1—— 第一次滴定消耗盐酸标准溶液用量,mL;
![]()
500—— 样品稀释液总体积,mL;
50—— 滴定时吸取样液体积,mL。
饼干中碳酸氢钠含量按下式计算:
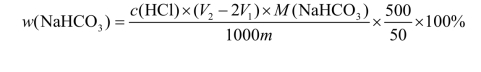
式中 c(HCl)—— 盐酸标准滴定溶液的实际浓度,mol/L;
m—— 饼干样品的质量,g;
V1—— 第一次滴定消耗盐酸标准溶液用量,mL;
V2—— 第二次滴定消耗盐酸标准溶液用量,mL
M(NaHCO3)—— 碳酸氢钠的摩尔质量,84 g/mol;
500—— 样品稀释液总体积,mL;
50—— 滴定时吸取样液体积,mL。
六、注意事项
(1)无水碳酸钠经过高温烘烤后,极易吸水,故称量瓶一定要盖严;称量时,动作要快些,以免无水碳酸钠吸水。
(2)实验中所用锥形瓶不需要烘干,加入蒸馏水的量不需要准确。
(3)Na2CO3 在270~300 °C 加热干燥,目的是除去其中的水分及少量NaHCO3。但若温度过高,则部分Na2CO3 分解为Na2O 和CO2。加热过程中(可在沙浴中进行),要翻动几次,使受热均匀。
(4)在临近第一终点的时候,如果滴定的速度太快,摇动不均匀,试液局部HCl 过浓,会与NaHCO3 反应生成H2CO3 从而分解为CO2 而逸出。因此滴定开始至第一终点前摇动要均匀,而当溶液的颜色从红色变为微红色的时候,应该慢滴慢摇,使生成的(或者原试液中的)NaHCO3 在未加甲基橙指示剂前不被滴定。另外最好采用NaHCO3 的酚酞溶液(浓度相当)做对照。
(5)在临近第二终点时,一定要充分摇动,以防止形成CO2 的过饱和溶液而使终点提前到达。
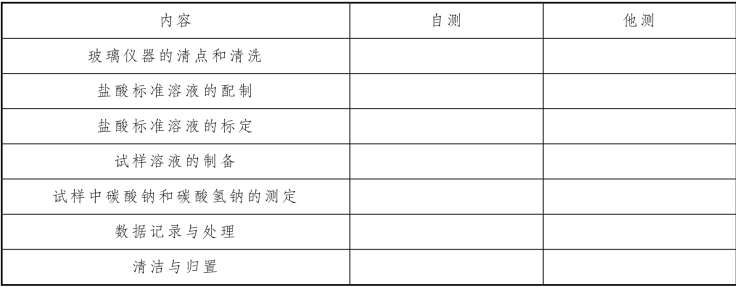
七、实训评估
表3-30 饼干中碳酸钠和碳酸氢钠含量的测定实训评估
八、拓展练习
(1)本实验用酚酞做指示剂时,所消耗的盐酸比用甲基橙做指示剂时少,为什么?
(2)在总碱量的计算式中,V 有几种求法?如果只要求测定总碱量,实验应该怎样做?
(3)在测定一批烧碱或碱灰样品时,若分别出现V1<V2,V1=V2,V1>V2,V1=0,V2=0的情况,说明样品的组成有什么差别?
(4)滴定管和移液管使用前均需要用操作溶液润洗,而滴定用的烧杯或锥形瓶为什么不能用待测液润洗?
(5)在滴定过程中产生的二氧化碳会使终点变色不够敏锐,在溶液滴定至临近终点时应如何处理消除干扰?
(6)当碳酸钠试样从称量瓶转移到锥形瓶的过程中,不小心有少量试样撒出,如仍用它来标定盐酸标准溶液的浓度,将会造成分析结果偏大还是偏小?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




