知识链接
钙是骨骼发育的基本原料,除了直接影响身高外,还在体内具有其他重要的生理功能,保证正常生长发育的顺利进行。镁也是一种参与生物体正常生命活度及新陈代谢过程必不可少的元素,参与维持基因组的稳定性。鸡蛋壳的主要成分为CaCO3,其次为MgCO3、蛋白质、色素以及少量的Fe、Al。随着人们生活水平的不断提高,鸡蛋的消耗量与日俱增,因此产生了大量的蛋壳,鸡蛋壳在医药、日用化工及农业方面都有广泛的应用。本实验不仅可以使学生的基本操作得到训练,提高自己的分析、解决问题的能力,还可以变废为宝,充分利用资源。
安全提示
使用烘箱在取拿样品时,注意不要烫伤,可佩戴隔热手套。
任务一 酸碱滴定法测定蛋壳中钙含量
一、实训目的
(1)了解从鸡蛋壳中得到钙离子的方法。
(2)掌握NaOH 溶液的配制和标定方法。
(3)掌握用酸碱滴定法测定鸡蛋壳中钙含量的测定方法和操作
(4)巩固滴定分析基本操作。
二、实训原理
鸡蛋壳中的钙主要以CaCO3 的形式存在。同时也有MgCO3。碳酸盐能与HCl 发生如下反应:

因此可以CaO 的含量表示蛋壳中Ca、Mg 的总量。过量的酸可用NaOH 标准溶液回滴。据实际与CaCO3 反应的盐酸标准溶液的体积可求得蛋壳中CaCO3 的含量,以CaO 的质量分数表示。实验结果按滴定分析记录格式作表格,并记录数据,按下式计算(质量分数)。

三、实训用品及准备
1.实训仪器
表3-15 酸碱滴定法测定蛋壳中钙含量实训仪器

2.实训试剂
表3-16 酸碱滴定法测定蛋壳中钙含量实训试剂

四、实训内容
1.蛋壳的预处理
将蛋壳洗净,取出内膜、烘干,用研钵研碎,准确称取一定质量蛋壳细粉,置于小烧杯中,用稀盐酸2.0 mL 润湿。
2.0.1 mol/L NaOH溶液的配制与标定
称取4.0 g NaOH 固体,置于烧杯中,加水溶解,然后定容至1000 mL 容量瓶中。
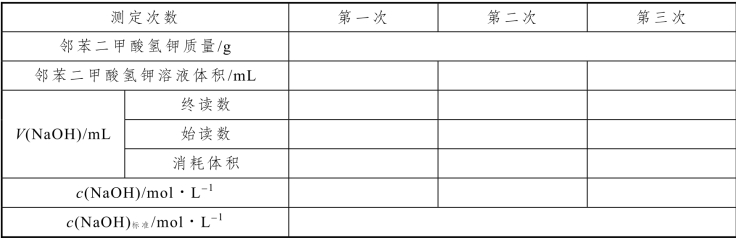
用电子天平准确称取1.5 mg(精确到0.1 mg)邻苯二甲酸氢钾(分析纯),放入烧杯中,加入30 mL 水并进行加热使其充分溶解,转移进100 mL 容量瓶中定容。将容量瓶充分震荡均匀后用移液管取25 mL 于锥形瓶中,滴加两滴酚酞指示剂,用刚配制的NaOH滴定至浅红色为终点且半分钟内不变色。平行滴定3 次。
3.0.1 mol/L盐酸的标定
用移液管准确吸取25.00 mL 待测盐酸,滴2~3 滴甲基橙,用已被标定的NaOH 溶液滴定,终点为红色变为橙黄色且半分钟内不变色,记录数据。如此重复3 次。
4.CaO含量的测定
用分析天平准确称取0.12~0.16 g(精确到0.1 mg)蛋壳粉于锥形瓶中,用酸式滴定管逐滴加入已标定好的HCl 标准溶液40.00 mL 左右(需精确读数),小火微热使之溶解(此时为避免HCl 挥发,应在锥形瓶上盖表面皿),并用蒸馏水将蒸发的盐酸冲回锥形瓶中,之后冷却,滴加2~3 滴甲基橙,用已标定好的NaOH 溶液进行反标定,终点为红色变为橙黄色且半分钟内不变色,记录数据。如此重复3 次。
五、数据记录与处理
1.NaOH 溶液的标定
表3-17 NaOH 溶液的标定数据记录
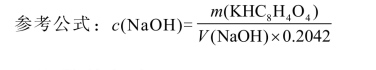
2.盐酸的标定
表3-18 盐酸的标定数据记录

3.CaO含量的测定
表3-19 CaO 含量的测定数据记录

六、注意事项
(1)由于酸太稀,溶解时需加热一定时间,试样中有不溶物,如蛋白质之类,但对测定影响不大。
(2)pH≤4.4,Fe、Al 不干扰,色素不影响。
(3)蛋壳中钙主要以CaCO3 形式存在,同时也有MgCO3,因此CaO 存量表示的是Ca+Mg 总量。
(4)在使用干燥箱时应注意:
① 使用前检查电源,要有良好地线。
② 干燥箱无防爆设备,切勿将易燃物品及挥发性物品放箱内加热。箱体附近不可放置易燃物品。
③ 箱内应清洁后使用,如有其他物品请取出后使用。
④ 使用时应定时监看,以免温度升降影响使用效果或发生事故。
⑤ 拿取干燥箱中物品时应注意不要烫伤。
⑥ 切勿拧动箱内感温器,放物品时也要避免碰撞感温器,否则温度不稳定。
七、实训评估
表3-20 酸碱滴定法测定蛋壳中钙含量实训评估(https://www.xing528.com)

任务二 配位滴定法测定蛋壳中Ca、Mg 含量
一、实训目的
(1)进一步巩固掌握配位滴定分析的方法与原理。
(2)学习使用配合掩蔽排除干扰离子影响的方法。
(3)训练对实物试样中某组分含量测定的一般步骤。
二、实训原理
鸡蛋壳的主要成分为CaCO3,其次为MgCO3、蛋白质、色素以及少量的Fe、Al。由于试样中含酸不溶物较少,故可用盐酸将其溶解制成试液。试样经溶解后,Ca2+、Mg2+共存于溶液中。为提高配合选择性,在pH=10 时,加入掩蔽剂三乙醇胺使之与Fe3+,Al3+等离子生成更稳定的配合物,以排除它们对 Ca2+,Mg2+测量的干扰。调节溶液的酸度至pH≥12,使Mg2+生成氢氧化物沉淀,以钙试剂为指示剂,用EDTA 标准溶液滴定,可单独测定钙的含量。另取一份试样,调节其酸度至pH=10,以铬黑T 为指示剂,用EDTA标准溶液可直接测定溶液中钙和镁的总量。由总量减去钙量即得镁量。
三、实训用品及准备
1.实训仪器
表3-21 配位滴定法测定蛋壳中Ca、Mg 含量实训仪器
2.实训试剂
表3-22 配位滴定法测定蛋壳中Ca、Mg 含量实训试剂

续表

四、实训内容
1.蛋壳的预处理
先将蛋壳洗净,加水煮沸5~10 min,去除蛋壳内表层的蛋白薄膜,然后把蛋壳放于烧杯中用小火(或在105 °C 干燥箱中)烤干,研成粉末。
2.试样的溶解及试液的制备
准确称取上述试样0.25~0.30 g(精确到0.1 mg),置于250 mL 烧杯中,加少量水润湿,盖上表面皿,从烧杯嘴处用滴管滴加HCl 5 mL 左右,使其完全溶解,必要时用小火加热(少量蛋白膜不溶)。冷却,转移至250 mL 容量瓶中,稀释至接近刻度线,若有泡沫,滴加2~3 滴95%乙醇,泡沫消除后,滴加水至刻度线摇匀。
3.Ca、 Mg总量的测定
用移液管准确吸取试液25.00 mL,置于250 mL 锥形瓶中,分别加入蒸馏水20 mL、三乙醇胺5 mL,摇匀。再加NH4Cl-NH3·H2O 缓冲液10 mL,摇匀。放入少许铬黑T 指示剂,用EDTA 标准溶液滴定至溶液由酒红色恰变纯蓝色,即达终点。根据消耗的EDTA体积计算Ca2+、Mg2+总量,以CaO 的含量表示。
4.钙含量的测定
用移液管准确吸取25.00 mL 上述待测试液于锥形瓶中,加入20 mL 蒸馏水和5 mL三乙醇胺溶液,摇匀。再加入NaOH 10 mL、钙指示剂约0.01 g,摇匀后,用EDTA 标准溶液滴定至由红色恰变为蓝色,即为终点。根据所消耗EDTA 标准溶液的体积计算Ca2+含量,以CaO 的含量表示。
任务三 高锰酸钾法测定蛋壳中CaO 的含量
一、实训目的
(1)学习间接氧化还原测定CaO 的含量。
(2)巩固沉淀分离、过滤洗涤与滴定分析基本操作。
二、实训原理

三、实训用品及准备
1.实训仪器
表3-23 高锰酸钾法测定蛋壳中CaO 的含量实训仪器

2.实训试剂
表3-24 高锰酸钾法测定蛋壳中CaO 的含量实训试剂

四、实训内容
1.0.01 mol/L KMnO4 溶液的配制
称取稍多于计算量的KMnO4,溶于适量的水中,加热煮沸20~30 min(随时加水补充因蒸发而损失的水)。冷却后在暗处放置7~10 d(如果溶液经煮沸并在水浴中保温1 h,放置2~3 d 也可),然后用玻璃砂芯漏斗(或玻璃纤维)过滤除去MnO2 等杂质。滤液贮存于棕色玻璃瓶中,待测定。
2.KMnO4 溶液浓度的标定
精确称取烘干后的分析纯草酸钠晶体0.06~0.08 g 于250 mL 锥形瓶中,加10 mL 蒸馏水使之溶解,再加30 mL 1 mol/L 的H2SO4 溶解,加热至75 °C 左右,立即用待标定的KMnO4 溶液标定。开始滴定时反应速度慢,每加入1 滴KMnO4 溶液,都摇动锥形瓶,使KMnO4 溶液颜色褪去后,再继续滴定。待溶液中产生Mn2+后,滴定速度可加快,临近终点时减慢速度,同时充分摇匀,至溶液突变为浅红色并持续半分钟不褪色即为滴定终点。平行滴定3 次,计算KMnO4 溶液的浓度。
3.蛋壳中CaO含量的测定
准确称取蛋壳粉0.07~0.08 g,放在250 mL 烧杯中,加1+1 盐酸3 mL、蒸馏水20 mL,加热溶解,若有不溶解蛋白质可过滤除去。滤液置于烧杯中,然后加入2.5% (NH4)2C2O4溶液 50 mL,若出现沉淀,再滴加浓盐酸使之溶解,然后加热至 70~80 °C,加入 2~3滴甲基橙,溶液呈红色,逐滴加入 10%氨水,不断搅拌,直至变黄并有氨味溢出为止。将溶液放置陈化,沉淀经过滤洗涤,直至无Cl-。然后将带有沉淀的滤纸洗入烧杯中,再用洗瓶吹洗1~2 次,然后稀释溶液至体积约为100 mL,加热至70~80 °C,用高锰酸钾标准溶液滴定至溶液呈浅红色,再把滤纸推入溶液中,再滴加高锰酸钾至浅红色在 30 s内不褪色为终点。平行滴定3 次,计算相关数据。
五、数据记录与处理
表3-25 三种不同方法的测定结果

六、拓展练习
(1)称取蛋壳的质量依据什么估算?
(2)蛋壳溶解应注意什么?
(3)为什么说最终表示的是Ca+Mg 的总量?
(4)三种方法各自有哪些优缺点?试分析一下(选做)。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




