知识链接
酸碱滴定法是滴定分析中的一个重要部分,是以酸碱反应为基础的。酸碱反应非常迅速,通常能够反应完全,副反应少,容易确定反应计量点。酸碱滴定法的适用性很广,凡是一般的酸、碱以及能与酸碱直接或间接发生反应的物质,都可以选择这种方法进行滴定。酸碱滴定法最常见的标准滴定溶液是0.1 mol/L 的盐酸和0.1 mol/L 的氢氧化钠溶液。
安全提示
盐酸的配制任务中有取用浓盐酸的环节,需要格外注意,本实验建议由教师完成该项操作。市售浓盐酸浓度为 12 mol/L,是无色透明的液体,具有强的挥发性,有强烈的刺鼻气味,腐蚀性强。盛有浓盐酸的容器打开后氯化氢气体会挥发,与空气中的水蒸气结合产生盐酸小液滴,使瓶口上方出现酸雾。因此在倾倒和初步稀释的过程中应当在通风橱中进行。为了降低直接接触盐酸所带来的危险,操作人员应着实验防护服和相应防护装备,如橡胶手套、护目镜、全包围抗腐鞋子等。若盐酸与皮肤发生接触,其急救措施为立即脱去受污染衣物,用大量流动清水冲洗至少 15 min,可涂抹弱碱性物质如稀碱溶液、肥皂水等,视情况就医;若盐酸与眼部接触,需立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15 min 后就医。
氢氧化钠溶液的配制任务中有取用固体氢氧化钠的环节,该操作可由学生自行完成,但要注意使用安全和规范。氢氧化钠是一种具有强腐蚀性的强碱,粉尘或烟雾会刺激眼和呼吸道,腐蚀鼻中隔,皮肤和眼与氢氧化钠直接接触会引起灼伤,误服可造成消化道灼伤,黏膜糜烂、出血和休克。若氢氧化钠与皮肤接触,需先用水冲洗至少 15 min,如果是浓溶液需要先用布擦干,再用 5%~10%硫酸镁或 3%硼酸溶液清洗并就医;若氢氧化钠与眼睛接触,应立即提起眼睑,用流动清水或生理盐水清洗至少15 min,或用3%硼酸溶液(或稀醋酸)冲洗,就医。
任务一 滴定管的强化训练
一、实训目的
(1)强化训练酸式滴定管和碱式滴定管的使用;
(2)正确判断甲基橙和酚酞的变色终点。
二、实训原理
滴定终点的判断是否正确直接决定了滴定分析的实验可靠性。我们必须学会判断滴定终点以及检验终点是否准确的方法。
甲基橙指示剂的变色范围为3.1~4.4,颜色由红到黄;pH=4.0 附近时颜色为橙色。以甲基橙为指示剂,利用NaOH 和HCl 互滴来分析,碱滴酸时终点颜色变化为由橙变黄,酸滴碱时终点颜色变化为由黄变橙。从视觉敏感性考虑,人总是更容易判断由浅入深的颜色变化,所以本次训练使用酸滴碱的方式练习甲基橙指示剂终点颜色的判断。同理,为了更容易判断指示剂颜色的变化,在碱滴酸的练习中将选用酚酞指示剂。酚酞指示剂的变色范围为8.2~10.0,颜色由无色至红色。碱滴酸时终点颜色变化为由无色变至粉红色。
三、实训用品及准备
1.实训仪器
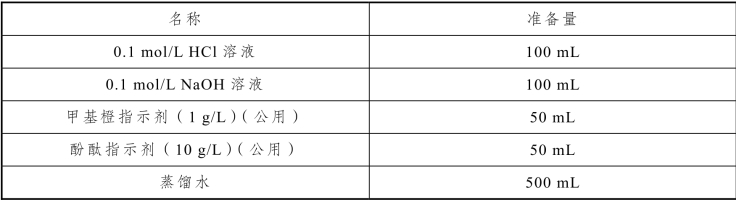
表2-34 滴定管的强化训练实训仪器

2.实训试剂
表2-35 滴定管的强化训练实训试剂
四、实训内容
1.滴定管的准备
完成实验前酸式滴定管和碱式滴定管的检漏、清洁、润洗和装液。滴定管准备好以后夹在滴定台上。
2.练习用甲基橙做指示剂的酸碱互滴
在锥形瓶中加入约30 mL 蒸馏水和1 滴甲基橙指示剂,从碱式滴定管中放出2~3 滴NaOH 溶液,观察其黄色;然后用酸式滴定管滴加HCl 溶液至由黄色变橙色,如果已滴到红色,再滴加NaOH 溶液至黄色。如此反复滴加两种溶液,直至能做到加半滴NaOH溶液由橙色变黄色,而加半滴HCl 溶液由黄色变橙色为止。掌握能通过加入半滴溶液而确定甲基橙指示剂变色终点的能力。
注意,快速检验加半滴变色的简便方法如下:
(1)当加半滴NaOH 溶液由橙色变黄色时,可利用滴入稀释一倍的HCl 溶液,观察是否变橙色来检验;
(2)当加半滴HCl 溶液由黄色变橙色时,可利用滴入稀释一倍的NaOH 溶液,观察是否变黄色来检验。
3.练习用酚酞做指示剂的酸碱互滴
在锥形瓶中加入约30 mL 蒸馏水和1 滴酚酞指示剂,从酸式滴定管中放出2~3 滴HCl 溶液,观察颜色状态;然后用碱式滴定管滴加NaOH 溶液至由无色变粉红色,如果已滴到红色,再滴加HCl 溶液至无色。如此反复滴加两种溶液,直至能做到加半滴HCl溶液由粉红色变无色,而加半滴NaOH 溶液由无色变粉红色为止。掌握能通过加入半滴溶液而确定酚酞指示剂变色终点的能力。
注意,快速检验加半滴变色的简便方法如下:
(1)当加半滴HCl 溶液由粉红色变无色时,可利用滴入稀释一倍的NaOH 溶液,观察是否变粉红色来检验;
(2)当加半滴NaOH 溶液由无色变粉红色时,可利用滴入稀释一倍的HCl 溶液,观察是否变无色来检验。
4.用 HCl 溶液滴定NaOH溶液
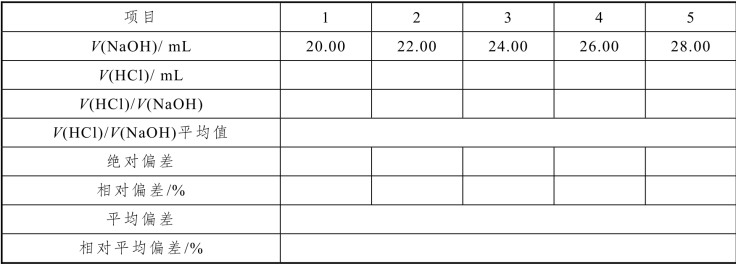
在碱式滴定管中装入NaOH 溶液,排出胶管与玻璃尖嘴的气泡,并将液面调节至0.00 mL标线。在酸式滴定管中装入HCl 溶液,排出气泡后调整液面至零刻线。以10 mL/min 的流速放出20.00 mL NaOH 溶液至锥形瓶中(或先快速放出19.5 mL,等待30 s,再继续放到20.00 mL),加1 滴甲基橙指示剂,用HCl 溶液滴定到溶液颜色由黄变橙,记录所消耗HCl 溶液的体积,注意读数的准确性。再放出2.00 mL NaOH 溶液,继续用HCl 溶液滴定至橙色,再次记录滴定终点读数,此时碱式滴定管的读数为 22.00 mL。如此连续滴定 5次,得到5 组数据,均为累计体积。计算每次滴定的体积比V(HCl)/V(NaOH)、体积比平均值、绝对偏差、相对偏差。如果5 组数据的相对偏差均<0.2%,则继续计算出平均偏差和相对平均偏差。若5 组数据的相对偏差有≥0.2%的情况,则要重新滴定获得新的5 组数据。
5.用 NaOH溶液滴定 HCl溶液
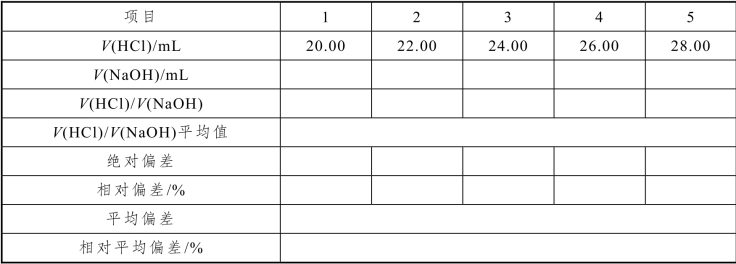
在酸式滴定管中装入HCl 溶液,排出玻璃尖嘴的气泡,并将液面调节至0.00 mL 标线。在碱式滴定管中装入NaOH 溶液,排出气泡后调整液面至零刻线。以10 mL/min 的流速放出20.00 mL HCl 溶液至锥形瓶中(或先快速放出19.5 mL,等待30 s,再继续放到20.00 mL),加2 滴酚酞指示剂,用NaOH 溶液滴定到溶液颜色由无色变粉红色,且30 s 之内不褪色即到终点。记录所消耗NaOH 溶液的体积,注意读数的准确性。再放出2.00 mL HCl 溶液,继续用NaOH 溶液滴定至粉红色,再次记录滴定终点读数,此时酸式滴定管的读数为22.00 mL。如此连续滴定5 次,得到5 组数据,均为累计体积。计算每次滴定的体积比V(HCl)/V(NaOH)、体积比平均值、绝对偏差、相对偏差。如果5 组数据的相对偏差均<0.2%,则继续计算出平均偏差和相对平均偏差。若5 组数据的相对偏差有≥0.2%的情况,则要重新滴定获得新的5 组数据。
6.实验结束
实验结束后,清洁实验仪器及实验台。
五、数据记录与处理
1.用 HCl 溶液滴定NaOH溶液
表2-36 HCl 滴定NaOH 溶液数据记录
2.用 NaOH溶液滴定 HCl溶液
表2-37 NaOH 滴定HCl 溶液数据记录
六、注意事项
(1)滴定溶液的量在20~30 mL 较为准确,并且易于观察终点。
(2)碱式滴定管使用时注意防止尖嘴处产生气泡。
(3)使用不同指示剂时,均应先练习至能正确地判断终点颜色变化后再开始具体的滴定实验。滴定过程中要注意观察溶液颜色变化的规律。
(4)读数要准确,滴定管读数要精确至小数点后百分位。
(5)V(HCl)/V(NaOH)亦可用V(NaOH)/V(HCl)表示。
七、实训评估
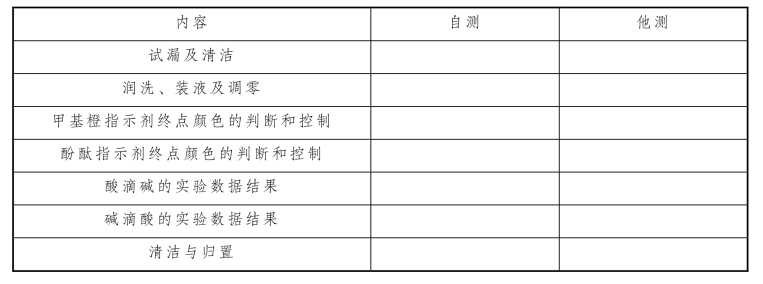
表2-38 滴定管的强化训练实训评估
八、拓展练习
(1)锥形瓶使用前是否需要干燥?为什么?
(2)若滴定结束时发现滴定管下端挂溶液或气泡应如何处理?
(3)实验数据分析的目的是什么?相对平均偏差是越大越好还是越小越好?
任务二 滴定分析基本操作
一、实训目的
(1)学习滴定分析法基本概念;
(2)掌握滴定分析的基本操作,了解基本流程;
(3)巩固甲基橙或甲基红、酚酞指示剂的使用及终点颜色的判断。
二、实训原理
滴定分析法,是化学分析法的一种,将一种已知其准确浓度的试剂溶液(称为标准溶液)滴加到被测物质的溶液中,直到化学反应完全时为止,然后根据所用试剂溶液的浓度和体积可以求得被测组分的含量,这种方法称为滴定分析法(或称容量分析法)。
本实验将结合移液管和滴定管的使用,巩固这两个能准确量取液体体积的玻璃仪器的操作。正确掌握精准量器的使用方法是滴定分析中必须掌握的基本技能,也是获得准确分析结果的前提条件。
![]()
可知: c(HCl)·V(HCl) = c(NaOH)·V(NaOH)
一定浓度的HCl 溶液与NaOH 溶液相互滴定时,所消耗的V(HCl)/V(NaOH)应该也是一定的。所以当需要分析其中某一种试剂的浓度时,只要已知另一种溶液的浓度以及滴定消耗的两种溶液的体积,就可以算出这种溶液的浓度。
用HCl 溶液滴定NaOH 溶液时,突跃范围是10.7~3.3,可以以甲基橙或甲基红作为指示剂。用NaOH 溶液滴定HCl 溶液时,突跃范围是4.3~9.7,可以用酚酞作为指示剂。
三、实训用品及准备
1.实训仪器
表2-39 滴定分析基本操作实训仪器
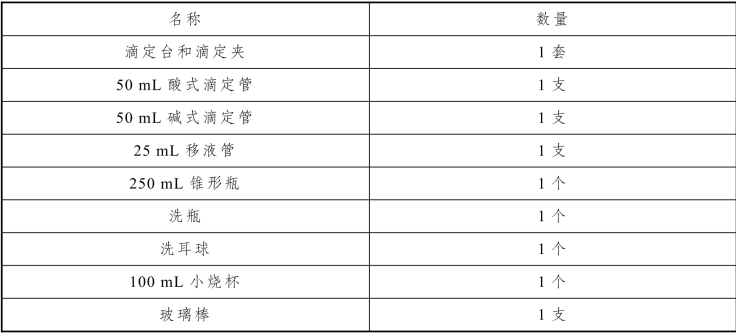
2.实训试剂
表2-40 滴定分析基本操作实训试剂
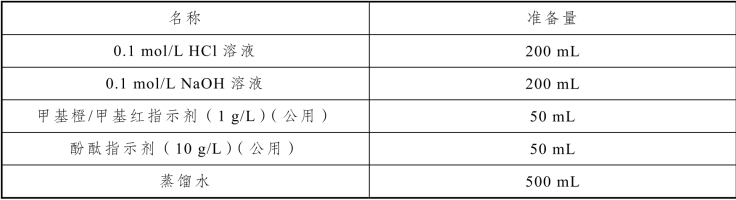
四、实训内容
1.滴定准备
完成移液管和滴定管使用前的准备工作,清洁其他待使用的玻璃仪器。
2.用 0.1 mol/L HCl溶液滴定 0.1 mol/L NaOH溶液
准备好0.1 mol/L NaOH 溶液,润洗移液管后用移液管准确移取25.00 mL 于锥形瓶中,加入2 滴甲基橙(或甲基红)指示剂,用0.1 mol/L HCl 溶液滴定。注意滴定动作,边滴边按画圈的方向摇动锥形瓶,这样可使锥形瓶中的溶液迅速反应。临近终点时用蒸馏水稍冲洗内壁后再逐滴滴加酸液,直至溶液恰好从黄色变为橙色为止。对滴定管中的 HCl溶液进行读数并记录数据,平行测定3 次。
3.用 0.1 mol/L NaOH 溶液滴定 0.1 mol/L HCl溶液
准备好0.1 mol/L HCl 溶液,润洗移液管后用移液管准确移取25.00 mL 于锥形瓶中,加入2 滴酚酞指示剂,用0.1 mol/L NaOH 溶液滴定。注意滴定动作,边滴边按画圈的方向摇动锥形瓶,这样可使锥形瓶中的溶液迅速反应。当溶液出现粉红色又快速消失时要减慢滴速。临近终点时用蒸馏水稍冲洗内壁后再逐滴滴加碱液,直至溶液恰好从无色变为粉红色为止。对滴定管中的NaOH 溶液进行读数并记录数据,平行测定3 次。
五、数据记录与处理
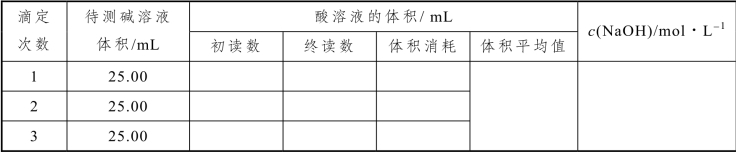
1.用 HCl 溶液滴定NaOH溶液
(假设HCl 溶液的浓度为0.1000 mol/L)
表2-41 用HCl 滴定NaOH 溶液数据记录
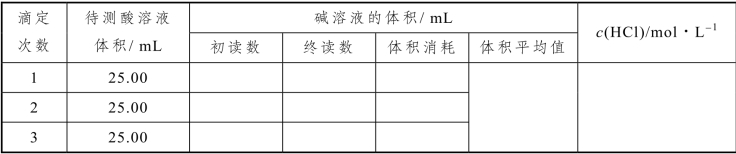
2.用 NaOH溶液滴定 HCl溶液
(假设NaOH 溶液的浓度为0.1000 mol/L)
表2-42 用NaOH 滴定HCl 溶液数据记录
六、注意事项
(1)润洗移液管时,需借助其他过渡容器,以免影响原标准溶液的浓度。
(2)标准溶液装入滴定管中时,不能借助其他过渡容器,以免影响原标准溶液的浓度。
(3)读数和计算时要遵循分析化学数字处理规范。
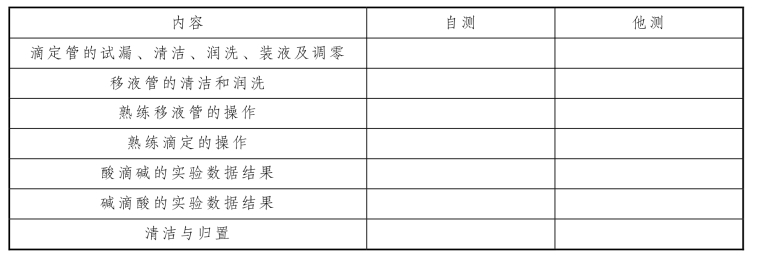
七、实训评估
表2-43 滴定分析基本操作实训评估
八、拓展练习(https://www.xing528.com)
(1)平行的3 组实验中,移液管是否需要每次都进行润洗?
(2)使用移液管转移溶液时是否存在尖嘴有气泡或尖嘴挂液滴的情况?该如何处理?
(3)如果滴定管装液前没有用待装液润洗,会造成什么结果?
(4)滴定过程中切忌滴速过快,是什么原因?
任务三 盐酸标准滴定溶液的配制与标定
一、实训目的
(1)学习盐酸标准滴定溶液的标定原理和意义;
(2)掌握一定浓度盐酸的配制方法;
(3)巩固减量法称量操作;
(4)进一步熟练滴定操作和滴定终点的颜色判断。
二、实训原理
标准溶液是指已知准确浓度的溶液。其配制方法通常有两种:直接法和标定法。本实验采用标定法。浓盐酸不仅含有杂质,而且容易挥发,是无法直接配制成标准滴定溶液的。只能先粗略配制成近似所需浓度的溶液,然后用基准物质标定其准确浓度再行使用。
实验首先需要配制500 mL 0.1 mol/L 的盐酸,配制原理是利用稀释定律。稀释定律告诉我们:对一定物质的量浓度的稀溶液进行稀释和浓缩时,溶质的物质的量始终不变。所以可利用公式:

想要配制500 mL 0.1 mol/L 的盐酸需要知道两个数据:一是盐酸浓溶液的浓度,二是取用浓溶液的体积。市售分析纯盐酸密度为1.19 g/mL,含HCl 约为37%,其物质的量浓度为12 mol/L,带入公式计算可知,需量取4.2 mL 浓盐酸进行配制。
标定盐酸常用的基准物质有无水碳酸钠或硼砂,还可通过与已知准确浓度的 NaOH标准溶液比较进行标定。无水碳酸钠易吸收空气中的水分,先将其置于270~300 °C 干燥1 h,然后保存于干燥器中备用。在化学计量点时,H2CO3 为饱和溶液,pH 为3.9,以甲基橙为指示剂应滴至溶液呈橙色为终点,为使H2CO3 的饱和部分不断分解逸出,临近终点时应将溶液剧烈摇动或加热。标定利用的化学反应如下:
![]()
硼砂较易提纯,不易吸湿,性质比较稳定,而且摩尔质量较大,可以减少称量误差。在化学计量点时,由于生成的硼酸是弱酸,溶液的pH 约为5,可用甲基红做指示剂。标定利用的化学反应如下:
![]()
三、实训用品及准备
1.实训仪器
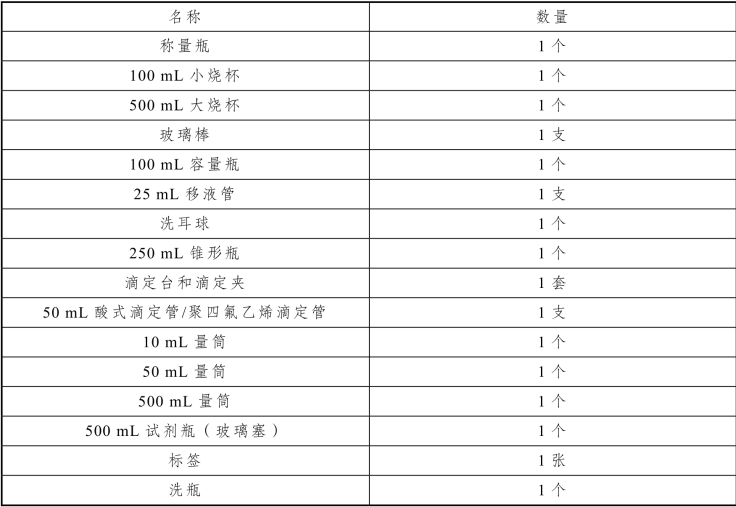
表2-44 盐酸标准滴定溶液的配制与标定实训仪器
2.实训试剂
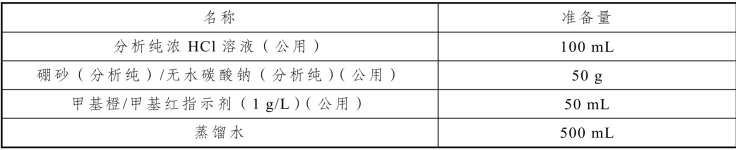
表2-45 盐酸标准滴定溶液的配制与标定实训试剂
四、实训内容
1.配制 500 mL 0.1 mol/L HCl溶液
用洁净的小量筒取4.2 mL 浓HCl,倒入500 mL 烧杯中,加入200 mL 蒸馏水,搅匀后再稀释至500 mL,移入试剂瓶中,摇匀并贴上标签。
注意:浓盐酸挥发性强,倾倒和初步稀释的步骤需要在通风橱中进行(由于浓盐酸的危险性,建议由教师完成该步骤)。
2.HCl溶液浓度的标定
洗净酸式滴定管,经检漏、清洁、润洗、装液、调零等操作后,夹在滴定台上备用。
用分析天平称取1.8 g 硼砂基准物于小烧杯中,注意使用减量法称量。称好硼砂后用少量蒸馏水溶解,配制成100 mL 溶液。用移液管准确移取25 mL 硼砂溶液于锥形瓶中,加入20 mL 蒸馏水,再加入甲基红指示剂2 滴,用待标定的盐酸滴定。终点颜色变化是由黄变橙色,注意及时准确地记录数据,平行滴定3 次。
如果基准试剂使用的是无水碳酸钠,操作如下:用分析天平称取0.5 g 无水碳酸钠基准物于小烧杯中,注意使用减量法称量。称好无水碳酸钠后用少量蒸馏水溶解,配制成100 mL 溶液。用移液管准确移取25 mL 碳酸钠溶液于锥形瓶中,加入20 mL 蒸馏水,再加入甲基橙指示剂2 滴,用待标定的盐酸滴定。终点颜色变化是由黄变橙色,注意及时准确地记录数据,平行滴定3 次。
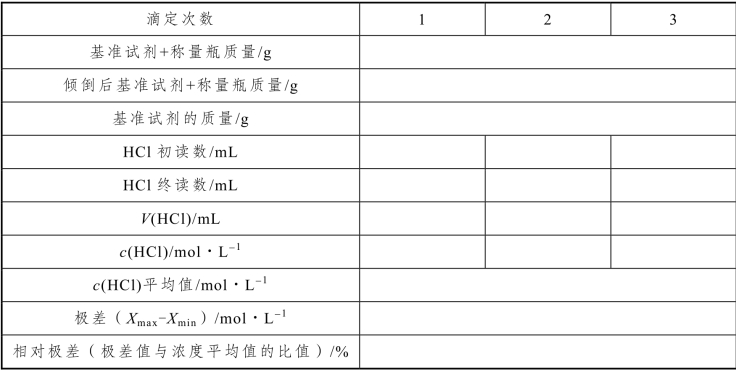
五、数据记录与处理
表2-46 盐酸标准滴定溶液的配制与标定数据记录
参考公式:

六、注意事项
严格意义上对平行实验需要做一组空白试验来减小试剂误差,所以可以增加一份空白试验数据,按照以下公式计算:
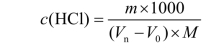
式中 Vn—— 盐酸的体积,mL;
V0—— 空白试验消耗盐酸的体积,mL。
七、实训评估
表2-47 盐酸标准滴定溶液的配制与标定实训评估

八、拓展练习
(1)为什么本次练习要采用减量法称量而没有采取直接称量的方式?
(2)使用无水碳酸钠标定HCl,在接近滴定终点时为什么要剧烈摇动锥形瓶?
(3)试推导数据处理中的计算公式。
(4)你认为你的操作过程中引入了哪些误差?
任务四 氢氧化钠标准滴定溶液的配制与标定
一、实训目的
(1)学习氢氧化钠标准滴定溶液的标定原理和意义;
(2)掌握一定浓度氢氧化钠溶液的配制方法;
(3)巩固减量法连续称量操作;
(4)进一步熟练滴定操作和滴定终点的颜色判断。
二、实训原理
氢氧化钠易吸收空气中的二氧化碳和水分,不符合基准物质的条件,所以需要先配制成近似浓度的溶液,然后用基准物质标定其准确浓度。
常用于标定氢氧化钠溶液的基准物质有邻苯二甲酸氢钾(KHC8H4O4)、草酸(H2C2O4·2H2O)等。
邻苯二甲酸氢钾易制得纯品,在空气中不吸水,容易保存,摩尔质量较大,是一种较好的基准物质,标定反应如下:
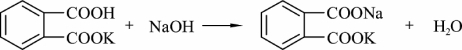
化学计量点时,溶液呈弱碱性(pH=9.20),可选用酚酞做指示剂。邻苯二甲酸氢钾通常在105~110 °C 下干燥2 h,干燥温度过高,则脱水成为邻苯二甲酸酐。草酸在相对湿度为5%~95%时不会风化失水,故将其保存在磨口玻璃瓶中即可,草酸固体状态比较稳定,但溶液状态的稳定性较差,空气能使草酸溶液慢慢氧化,光照和Mn2+能催化其氧化,因此草酸溶液应置于暗处存放。标定反应如下:
![]()
反应产物为Na2C2O4,在水溶液中显碱性,可选用酚酞做指示剂。本次试验采用邻苯二甲酸氢钾作为基准物质。
三、实训用品及准备
1.实训仪器
表2-48 NaOH 标准滴定溶液的配制与标定实训仪器

续表
2.实训试剂
表2-49 NaOH 标准滴定溶液的配制与标定实训试剂
四、实训内容
1.配制 500 mL 0.1 mol/L NaOH 溶液
用洁净的小烧杯称取2 g NaOH,加少量蒸馏水溶解后转入500 mL 烧杯中,边搅拌边继续加蒸馏水稀释至500 mL,移入试剂瓶中,摇匀并贴上标签。
2.NaOH 溶液浓度的标定
洗净碱式滴定管,经检漏、清洁、润洗、装液、调零等操作后,夹在滴定台上备用。
准确称取0.4~0.5 g 已烘干的邻苯二甲酸氢钾3 份,分别放入3 个已编号的250 mL锥形瓶中,各加20~30 mL 水溶解(若不溶可稍加热,冷却后再继续操作),加入1~2滴酚酞指示剂,用NaOH 溶液滴定至无色溶液变浅粉红色,半分钟不褪色,即为终点,计算NaOH 标准溶液的浓度等。注意及时准确地记录数据,平行滴定3 份。
五、数据记录与处理
表2-50 NaOH 标准滴定溶液的配制与标定数据记录

参考公式:

六、注意事项
严格意义上对平行实验需要做一组空白试验来减小试剂误差,所以可以增加一份空白试验数据,按照以下公式计算:
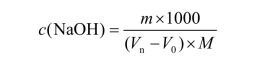
式中 Vn—— 氢氧化钠溶液体积,mL;
V0—— 空白试验消耗氢氧化钠溶液的体积,mL。
七、实训评估
表2-51 NaOH 标准滴定溶液的配制与标定实训评估

八、拓展练习
(1)计算配制500 mL 0.1 mol/L NaOH 要称取多少克固体试剂。
(2)如何计算称取基准物邻苯二甲酸氢钾或Na2CO3 的质量范围?称得太多或太少对标定有何影响?
(3)试推导数据处理中的计算公式。
(4)你认为你的操作过程中引入了哪些误差?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




