抗体(antibody)指机体的免疫系统在抗原刺激下,由B淋巴细胞或记忆细胞增殖分化成的浆细胞所产生的,可与相应抗原发生特异性结合的免疫球蛋白(immuno globulin,Ig)。主要分布在血清中,也分布于组织液及外分泌液中。
(一)Ig分子的基本结构
Ig分子的基本结构是由4条多肽链组成的,包括2条较大的相同的重链(heavy chain,H链)和2条较小的相同的轻链(light chain,L链),轻链与重链之间是由二硫键连接形成Ig分子单体,分为氨基端(N端)、羧基端(C端)(见图6-1)。
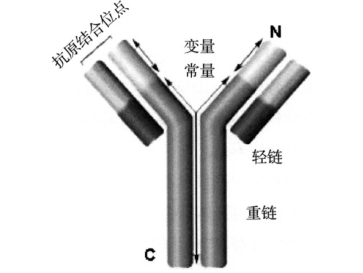
图6-1 Ig分子基本结构
每条H链有3个恒定区(CH1、CH2、CH3)(H链C端3/4~4/5处)和1个可变区(VH)(H链N端1/5~1/4处)。每个L链有1个可变区(VL)(L链N端1/2处)和1个恒定区(CL)(L链C端1/2处),通常不含碳水化合物。H链和L链的可变区形成抗原结合部位。不同H链和L链组成完整的Ig分子分别称之为IgM、IgG、IgA、IgD和IgE。
IgG、IgD、IgE及血清型IgA均为单体。分泌型IgA(secretoryIgA,SIgA)为双体,即2个单体IgA由J链相连,加上1个分泌片组成(见图6-2)。IgM为五聚体,即5个单体IgM由1条J链相连而成。
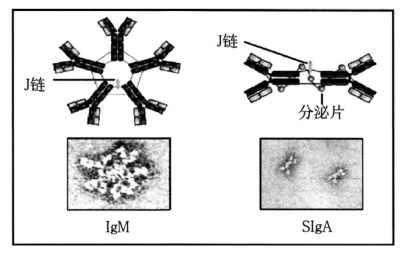
图6-2 1gM和SlgA结构示意图
(二)lg分子的生物学功能
1.特异性结合抗原
Ig分子最显著的生物学特点就是能够特异性地与抗原结合。这种特异性结合抗原特性是由其V区的空间构型决定的,从而在体内介导多种生理和病理效应,在体外引起抗原-抗体反应。(https://www.xing528.com)
2.活化补体
Ig与抗原结合后,即形成免疫复合物。人类IgG包括4个亚类Igl-4,其中IgG1、IgG2、IgG3和IgM可通过经典途径活化补体。当抗原与相应抗体结合后,IgG的CH2和IgM的CH3暴露出结合补体Clq的结合点,开始活化补体。凝聚的IgG4、IgA、IgE等可以通过旁路途径活化补体。
3.结合Fc受体
Ig能够通过IgFc段与多种表面具有相应Fc受体的细胞结合,从而产生如调理作用(图6-3)、抗体依赖性细胞介导的细胞毒作用(antibody dependent cell-mediated cytotoxicity,ADCC)和引起超敏反应等多种生物效应。
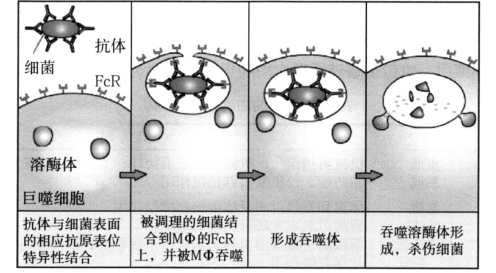
图6-3 抗体介导的调理作用
4.通过胎盘
IgG是唯一可通过胎盘从母体转移给胎儿的Ig。胎儿和新生儿抗感染免疫作用主要依赖于来自母体的IgG。
5.SIgA的黏膜抗感染作用
SIgA在黏膜表面有非常重要的效应功能,黏膜表面是大部分生物病原的入侵门户。由于外分泌液中SIgA含量多,又不易被一般蛋白酶破坏,因此成为机体抗感染的一道重要的免疫“屏障”。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




