铯-137(137Cs)是一个在核反应堆裂变时产生的放射性核素,很容易在水和空气中传播,其半衰期为30年。实验室或工业用γ辐射装置也常常带有137Cs。随着核工业的发展和核电站核泄漏事故的发生,核辐射污染引起了人们的广泛关注。研究137Cs辐射的生物效应,有益于核辐射污染监测与防护。
1.试验目的
研究137Cs辐射诱导实验红鲫主要器官的超氧化物歧化酶(SOD)与谷胱甘肽过氧化物酶(GSH-Px)的活性变化及热休克蛋白70(Hsp70)表达量的变化,以探讨实验红鲫对137Cs辐射的氧化应激响应和利用氧化应激生物标记来监测137Cs辐射污染的可行性。
2.试验方法
(1)试验用鱼及饲养
本试验所用的实验红鲫,由南华大学实验动物学部提供,均为2年龄,平均体长11.5cm,平均体质量34.6g。实验红鲫在水中驯养7d后用于试验。养殖用水为暴气3d的自来水,水温(20.4±1)℃、pH值(6.84±0.4)、溶氧量(6.21±0.4)mg/L。试验期间,用水族箱饲养实验红鲫并辅以增氧泵持续增氧。
(2)137Cs辐射处理及取样
根据前期所做急性毒性试验获得实验红鲫137Cs的辐射半数致死剂量为31.05Gy(戈瑞:核辐射剂量国际单位,每1kg受照物质吸收1J核辐射能时,其核辐射剂量称为1Gy),按1/16 LD50、1/8 LD50、1/4 LD50、1/2 LD50等级,设置4个不同剂量的辐射处理组,即1.94Gy辐射组、3.88Gy辐射组、7.76Gy辐射组、15.53Gy辐射组与1个对照组(0Gy组);每组用实验红鲫20尾。各辐射处理组的实验红鲫经137Cs辐射处理后,分别在24h,48h,72h,96h解剖试验鱼3尾,取出性腺以备SOD、GSH-Px活性检测,于7d和14d各解剖试验鱼3尾,取出肝脏、肾脏、心脏、脑,以备Hsp70含量检测。
(3)SOD活性的测定
将提取的性腺组织,用生理盐水漂洗,滤纸吸干多余生理盐水后称其质量并记录。冰浴下将性腺剪成碎块倒入匀浆器中研磨,约0.1g组织加入生理盐水约0.9mL,制备成10%组织匀浆,在冷冻离心机中4℃、3000r/min离心10min,取上清液进行测定。
按照所用BCA试剂盒的使用说明书测定性腺组织总蛋白浓度。
SOD活性的测定参照所用的SOD检测试剂盒的使用说明书进行操作,用酶标仪测定450nm波长下吸光度值计算SOD活性。酶活性用U/mg(每毫克酶蛋白的酶活力单位)表示。
(4)GSH-Px活性的测定
如上述,从性腺组织上清液中提取GSH-Px测定总蛋白浓度。GSHPx活性的测定参照所用GSH-Px试剂盒的使用说明书进行操作,用紫外分光光度计测定412nm波长下吸光度值,计算GSH-Px活性。
(5)Hsp70蛋白表达量的测定
1)组织蛋白提取与测定:将实验红鲫解剖,称取新鲜组织块100mg,冰浴下于玻璃匀浆器中充分匀浆,然后将其放入3mL的RIPA细胞裂解液中(RIPA中含有30μL的PMSE溶液)裂解约30min,然后在高速冷冻离心机中以12000r/min离心8min,吸取上清液分装并在-20℃保存。并吸取一定量的上清液留做蛋白定量。按照所用BCA试剂盒的使用说明书操作,测定各组织总蛋白浓度。
2)Western blot检测Hsp70蛋白表达量:参照《分子克隆实验指南》(第四版)和SDS-PAGE的试剂盒说明书进行SDS-PAGE电泳和Western blot试验操作。提取组织,剪碎,用RIPA裂解液裂解30min后,12 000r/min低温离心提取组织总蛋白,BCA法测定蛋白浓度(按照试剂盒说明书操作)。各组蛋白上样量50μg,经15%SDS-PAGE电泳分离(浓缩胶80V,20min;分离胶120V,2h),湿法转膜后(200mA,2h),以含5%脱脂牛奶的封闭液摇床上常温封闭2h;加入一抗(1∶2000稀释)、4℃孵育过夜,再加入二抗(1∶2000稀释),常温下孵育1h;采用ECL化学发光法,天能凝胶成像系统显影拍照。
(6)统计分析
试验数据用均数±标准差(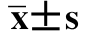 )表示,采用Alpha Imager 2200软件分析目的条带的分子量和净光密度值,采用SPSS18.0软件对数据进行统计和单因素方差分析(ANOVA),采用LSD法进行比较,P<0.05或P<0.01表示有统计学意义。
)表示,采用Alpha Imager 2200软件分析目的条带的分子量和净光密度值,采用SPSS18.0软件对数据进行统计和单因素方差分析(ANOVA),采用LSD法进行比较,P<0.05或P<0.01表示有统计学意义。
3.试验结果
(1)实验红鲫性腺SOD活性
实验红鲫经以1.94Gy、3.88Gy、7.76Gy、15.53Gy的137Cs辐射处理后,分别在24h、48h、72h和96h取性腺组织检测SOD活性,包括对照组实验红鲫,所测得的SOD活性变化数据见表4-47。以辐射时间看,各辐射处理组的实验红鲫的SOD活性与对照组相比均存在逐渐降低的趋势,且存在显著性差异。以辐射剂量看,各辐射处理组的实验红鲫的SOD活性与对照组相比均存在逐渐降低的趋势,且存在显著性差异。
表4-47 不同剂量核辐射处理后实验红鲫性腺SOD活性(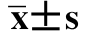 )U/mg
)U/mg
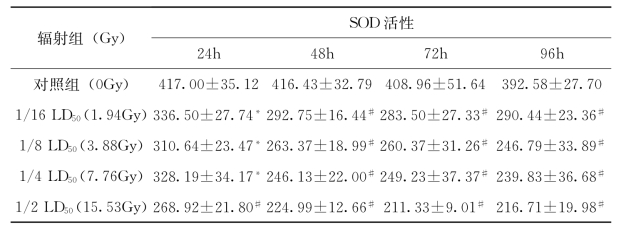
注:*表示与对照组相比,P<0.05;#表示与对照组相比,P<0.01。
(2)实验红鲫性腺GSH-Px活性
由表4-48可知,以辐射时间看,在核辐射处理24h后,各辐射处理组的实验红鲫的GSH-Px的活性与对照组相比均存在逐渐降低的趋势,且存在显著性差异。以辐射剂量看,各辐射处理组的实验红鲫的GSH-Px的活性与对照组相比均存在逐渐降低的趋势且存在显著性差异。
表4-47、表4-48数据显示1.94Gy至15.53Gy137Cs辐射能引起实验红鲫氧化应激,SOD、GSH-Px活性发生改变。1.94Gy以上137Cs辐射诱导实验红鲫性腺SOD活性下降,并随辐射剂量升高和时间的延长而下降,且下降幅度较大。各辐射处理组实验红鲫性腺的GSH-Px活性变化不大,表现出随辐射剂量升高则活性降低的变化趋势。
表4-48 不同剂量核辐射处理后实验红鲫性腺GSH-Px活性(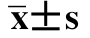 )U/mg (https://www.xing528.com)
)U/mg (https://www.xing528.com)
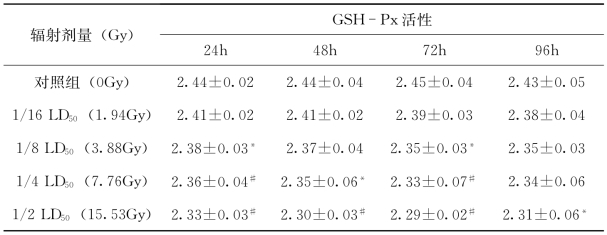
注:*表示与对照组相比,P<0.05;#表示与对照组相比,P<0.01。
(3)实验红鲫主要器官HSP70蛋白表达水平
图4-13表示在7d与14d,实验红鲫肝脏Hsp70表达量的统计学分析结果。结果显示,在7d与14d肝脏Hsp70的表达量都是升高的趋势,且与对照组相比,都存在显著性差异。
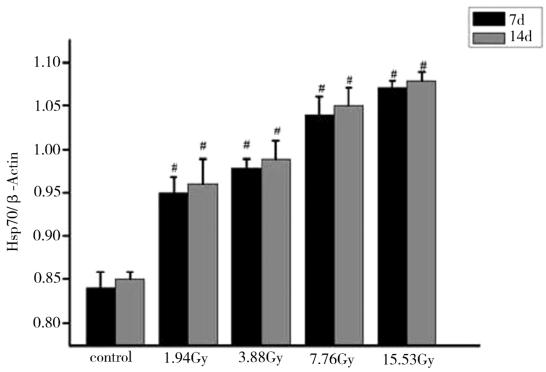
图4-13 不同剂量的核辐射后肝脏Hsp70表达量的统计结果
注:*表示与对照组相比,P<0.05;#表示与对照组相比,P<0.01。
图4-14表示在7d与14d,实验红鲫肾脏Hsp70表达量的统计学分析结果。结果显示,在7d与14d肾脏Hsp70的表达量都是升高的趋势,且与对照组相比,都存在显著性差异。
图4-15表示在7d与14d,实验红鲫心脏Hsp70的表达量的统计学分析结果。结果显示,在7d与14d心脏Hsp70的表达量都是升高的趋势,且与对照组相比,都存在显著性差异。
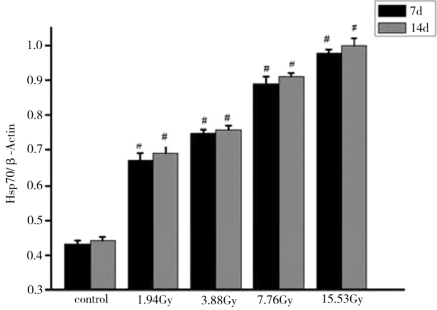
图4-14 不同剂量的核辐射后肾脏Hsp70表达量的统计结果
注:*表示与对照组相比,P<0.05;#表示与对照组相比,P<0.01。
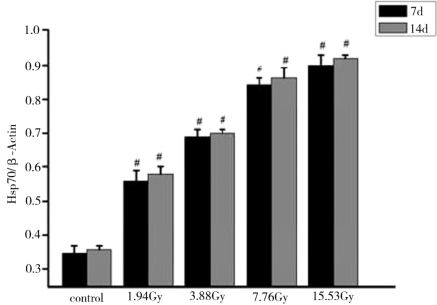
图4-15 不同剂量的核辐射后心脏Hsp70表达量的统计结果
注:*表示与对照组相比,P<0.05;#表示与对照组相比,P<0.01。
图4-16表示,在7d与14d,实验红鲫脑Hsp70表达量的统计学分析结果。结果显示,在7d与14d脑Hsp70表达量都是升高的趋势,且与对照组相比,都存在显著性差异。
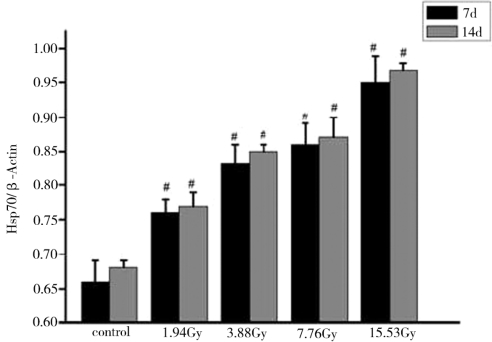
图4-16 不同剂量的核辐射后脑的Hsp70表达量的统计结果
注:*表示与对照组相比,P<0.05;#表示与对照组相比,P<0.01。
由图4-13、图4-14、图4-15、图4-16可知,137Cs辐射处理后7d和14d,各辐射处理组实验红鲫肝脏、肾脏、心脏和脑的Hsp70表达量均比对照组的高,且随着137Cs辐射剂量的增加和时间的延长而升高,均存在着一定的“剂量-时间-效应”关系。与对照组相比,差异具有统计学意义。实验红鲫不同器官的Hsp70表达量由高到低的器官依次是肝脏、心脏、肾脏和脑。其中,肝脏和肾脏的Hsp70表达量对低剂量(1.94Gy)137Cs辐射的氧化应激响应的幅度最大,约60%。
4.讨论
过去30余年,人们在研究生物有机体对重金属或化学品胁迫的氧化应激响应时发现,环境恶化会导致生物有机体氧化应激,在氧化应激状态下,生物有机体抗氧化防疫系统中的抗氧化酶活性和非酶系物质含量将会发生不同程度的改变。近年来,随着人们对环境核辐射污染的监测与治理的关注,关于核辐射生物效应问题的研究也随即吸引了不少研究者的兴趣。一些研究表明,一定剂量的核辐射也可使得生物机体产生氧化应激,对抗氧化防御系统产生影响。如γ射线辐射能引起小鼠和短柄草SOD活性显著改变,紫外线辐射能诱导革胡子鲇SOD、GPH-PX、GSH活性改变,12C6+辐射能引起斑马鱼SOD活性改变,紫外线辐射也可诱导小鼠Hsp70表达量升高。甚至有研究者建议,可以将SOD、GSH-Px、MDA、Hsp70等分子作为核辐射氧化应激生物标志物加以研究或用于监测实践。在本试验中观察到,实验红鲫经过1.94Gy至15.53Gy的137Cs辐射后,各器官组织的SOD、GSH-Px活性及Hsp70表达量均发生了显著变化。正常情况下,实验红鲫肝脏和性腺的SOD活性分别处于约160U/mg和409U/mg的水平。当受到1.94Gy的137Cs辐射后,肝脏SOD活性有所上升,尽管上升的幅度不大,但具有随时间延长SOD活性逐渐上升的趋势。这一现象提示实验红鲫受低剂量的137Cs辐射具有对SOD活性的诱导效应,高剂量的137Cs辐射则具有对SOD活性的抑制效应。同样,Zhou Rong研究斑马鱼对12C6+辐射的氧化应激,发现斑马鱼经5~15Gy的12C6+辐射处理后,12h后的眼部SOD活性达到高峰,随着辐射时间延长,SOD活性逐渐下降,但7d后仍未恢复正常水平,结果还表明12C6+辐射引起斑马鱼眼部SOD活性改变伴随着12C6+辐射剂量的增加而增加。但是也有例外,Shuqi Jiang等的研究表明,小鼠受5Gy的60Co-γ照射后第14d,血清SOD活性较对照组显著降低。翟苗苗等的研究表明,小鼠受4Gy的X射线照射后第6d,肝脏SOD出现显著性降低。本试验中,实验红鲫性腺SOD活性受到137Cs辐射后反而下降,且表现为随137Cs辐射剂量增加和时间延长,性腺SOD活性均逐渐下降的现象。对这一现象的解释可能是辐射增强了脂质过氧化作用,破坏了抗氧化防御系统。本试验结果表明,正常情况下,肝脏GSH-Px活性约为784U/mg的水平,性腺GSH-Px活性约为2.44U/mg的水平;受到高剂量(如15.53Gy)的137Cs辐射处理后,肝脏和性腺的GSH-Px活性仅分别降低约5%和约7%。其中肝脏GSH-Px的活性表现出随辐射剂量升高,GSH-Px活性逐渐降低的变化趋势;同一辐射剂量组中,GSH-Px活性变化表现为随观察时间延长则逐渐升高的趋势。但是这种变化规律在性腺组织不明显。137Cs辐射引起实验红鲫肝脏GSH-Px活性的变化规律与本试验室前期研究发现苯酚引起实验红鲫肝脏GSH-Px活性的变化规律一致。Kim BM、Eulgentini L和Anton Lennikov等最近的研究表明,紫外线可诱导Hsp70蛋白表达,且表达量显著升高。本试验也得出同样的结果,即实验红鲫经137Cs辐射处理后,7d和14d的肝脏、肾脏、脑、心脏的Hsp70的表达量均比对照组明显升高,且Hsp70的表达量随着137Cs辐射剂量的增加和时间的延长而升高,具有典型的“剂量-时间-效应”关系。
本试验也观察到,实验红鲫被以不同剂量的137Cs辐射处理后,性腺中的SOD活性远远高于肝脏中的SOD活性。提示实验红鲫肝脏不是一个以SOD活性变化应答137Cs辐射的敏感器官,而性腺可能是一个敏感器官。表明性腺SOD可以作为137Cs辐射应激的有效标志物。同样还观察到,无论受到低剂量(如1.94Gy)还是高剂量(如15.53Gy)的137Cs辐射处理后,性腺的GSH-Px活性虽有降低,但降低的幅度不大,均不超过10%。提示GSH-Px不是137Cs辐射应激的有效标志物。根据灰度扫描值估算,实验红鲫受到低剂量(如1.94Gy)的137Cs辐射处理后,肝脏和肾脏的Hsp70表达量则在7d上升幅度最大,高达60%左右。由此,可以认为肝脏和肾脏的Hsp70表达量可能是137Cs辐射应激的最有效标志物。
本试验所用的红鲫是本实验室建立的标准化的实验红鲫,它可以作为水源中一种优良的安全指示生物,过去也曾用于毒理学研究。在本试验的前期研究中,本试验团队测得实验红鲫对137Cs辐射的半数致死剂量(LD50)为31.05Gy,与文献报道的青鳉(Orizias latipes)的137Cs辐射半数致死剂量(LD50)为20Gy相比,可见实验红鲫对137Cs辐射既敏感又有一定的耐受性。本试验研究结果显示,实验红鲫经过低剂量(1.94Gy至15.53Gy)的137Cs辐射后,性腺的SOD活性发生了显著变化,各器官特别是肝脏和肾脏的Hsp70表达量也发生了显著变化,提示可以用实验红鲫作为测试动物,以实验红鲫性腺的SOD和肝脏或肾脏的Hsp70为氧化应激标志物来开展137Cs辐射监测研究。
5.结论
(1)实验红鲫性腺对137Cs辐射的氧化应激响应较敏感,可以作为水中一种优良的安全指示生物。
(2)性腺SOD和肝脏或肾脏的Hsp70可作为氧化应激标志物。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




