国内外已报道很多关于苯酚对水生生物的影响,研究内容主要集中在急慢性毒性、生长发育和生理代谢影响三个方面,而有关酚类化合物对水生生物DNA损伤及氧化胁迫研究甚少。为更加确切地阐明苯酚的实际影响和潜在危害,我们选用了多个生物标志物来衡量苯酚对实验红鲫的危害。生物标志物(biomarker)是指生物体受到外界胁迫后、还未发生严重损伤之前,在分子、细胞、个体或种群水平上表现出异常变化的信号指标。生物标志物能有效、敏感地反映出生物体发生严重损伤之前的生物变化,并能准确评估生物体所处的污染状态。
1.目的
用本实验室自主培育的标准化实验鱼类实验红鲫C1HD系,在急性毒性试验基础上,研究在不同浓度苯酚、不同暴露时间下红细胞微核率、拖尾率、性腺SOD、GSH-Px活性变化,旨在阐明苯酚的致毒机制,分析苯酚对水生生物的实际毒性和潜在影响;阐明几种指标作为生物标志物应用于含酚废水对指示生物毒害作用的可行性,为实验红鲫作为一种指示生物用于水体环境监测提供科学依据;为鱼类血液学和遗传毒理学研究以及水环境污染的生物监测提供更丰富的参考依据。
2.方法
(1)急性毒性试验
以本实验室培育的实验红鲫C1HD系为试验材料,参考本章本节试验一采用半静态生物测试法测定苯酚对实验红鲫的半数致死浓度和安全浓度。
(2)微核(mieronucleus,简称MN)试验
根据96h LC50,设置2.16mg/L、4.31mg/L、8.62mg/L、17.24mg/L四个苯酚浓度试验组和一个对照组,微核试验在染毒后24h、48h、72h、96h取样。从各处理组随机取鱼,每个浓度组观察3尾红鲫,每个片子计数2000个以上细胞,观察、记录出现微核及核异常的红细胞数。
(3)彗星试验
在急性毒性试验的基础上,根据苯酚对实验红鲫96h LC50,设定2.16mg/L、4.31mg/L、8.62mg/L、17.24mg/L四个浓度组以及一个对照组。各浓度组分别放置实验红鲫12尾。每组试验鱼在苯酚中暴露24h、48h、72h、96h后,尾静脉取血,细胞活性检测。彗星试验采用Singh等的方法并稍作改进,经过铺胶、裂解、解旋、电泳、中和、染色、镜检分析等步骤,用CASP软件分析系统分析彗星图像。彗星图像分析参照Collins等人的方法,每张载玻片观察100个细胞,根据拖尾中DNA的含量,将损伤程度划分为5个等级(0,1,2,3,4级。无损伤为0级,最大损伤为4级)。分级后,用下列公式量化DNA损伤程度:Arbitrary units=0×0级细胞数目+1×1级细胞数目+2×2级细胞数目+3×3级细胞数目+4×4级细胞数目,Arbitrary units为DNA损伤专用单位,是一种衡量DNA损伤程度的特有单位,是把不同的分级加以换算统计后,得到DNA损伤的总体水平。试验结果采用X2检验方法进行统计学分析。
(4)性腺SOD和GSH-Px活性测定
试验采用半静态生物测试法。试验设为1/16 96h LC50,1/8 96h LC50,1/4 96h LC50,1/2 96h LC50四个浓度组和一个对照组,即0mg/L浓度组,2.16mg/L浓度组,4.31mg/L浓度组,8.62mg/L浓度组,17.24mg/L浓度组。每个试验组放入规格一致的红鲫12尾,分别于暴露24h,48h,72h,96h后随机取3尾,迅速取其性腺组织,放入5mL Ep管中,置于-20℃冰箱,用于性腺组织中的SOD和GSH-Px酶活性测定。利用邻苯三酚自氧化法测定性腺组织SOD活性,紫外分光光度法测定性腺组织GSH-Px活性变化。采用SPSS13.0软件对试验数据进行单因素方差分析(ANOVA),采用LSD法,P<0.05为具有统计学意义。所得数据表示为平均数±标准差(Means±SD)。
以上4个试验即苯酚对实验红鲫急性毒性、遗传损伤和体内保护酶及解毒酶活性的影响,苯酚对实验红鲫的急性毒性试验,可作为评价水体安全性的一个快速有效的方法,同时为制定渔业环境质量标准、污染物排放等提供参考。苯酚对实验红鲫红细胞微核率和红细胞拖尾率的影响可评估苯酚对鱼类染色体的损伤程度,为含酚废水对鱼类的遗传毒性提供直接证据,为实验红鲫应用于水污染监测的指示生物提供基础资料。苯酚对红鲫性腺SOD,GSH-Px活性的影响,目的是了解实验红鲫在苯酚暴露下抗氧化酶SOD和GSH-Px活性的适应性变化,探讨上述指标作为红鲫生殖系统损伤标志物的可能性。目前关于苯酚对鱼类生殖系统的氧化损伤作用还未见报道。
3.结果
(1)苯酚对实验红鲫的急性毒性作用
急性实验结果见表4-16、表4-17。实验红鲫暴露于苯酚后,50.0mg/L和63.0mg/L浓度组刚开始即出现不良反应,红鲫来回游动,速度明显比对照组加快,随时间延长红鲫头部时而露出水面,呼吸外界氧气,同时鳃盖活动加强,预示急性呼吸窘迫,4h后个别个体逐渐失去平衡,游动变缓,侧面朝上,随后出现死亡。在25.0mg/L和32.0mg/L浓度组,4h内与对照组相比,行动无显著差异。到48h以后,鳃盖活动开始无规律性。皮肤和鳃分泌黏液逐渐增多,行动变得迟缓,且随暴露时间延长成时间-效应关系。苯酚对实验红鲫24h、48h和96h LC50分别为38.02mg/L、36.83mg/L和34.48mg/L,安全浓度为3.45mg/L。
表4-16 不同苯酚浓度下红鲫死亡率
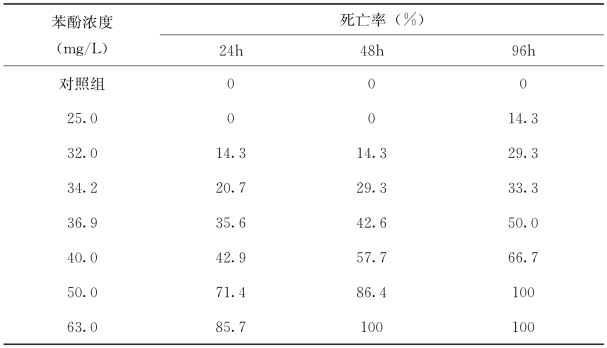
表4-17 苯酚对红鲫的半数致死浓度和安全浓度

(2)苯酚对实验红鲫红细胞微核的影响
苯酚暴露时间对实验红鲫红细胞微核率的影响结果(表4-18)显示:对照组之间微核率差异不显著(P>0.05),2.16mg/L浓度组、4.31mg/L浓度组、8.62mg/L浓度组暴露时间对微核率影响极显著(P<0.01),当浓度达到17.24mg/L时,微核率比8.62mg/L浓度组下降,原因可能是严重的细胞毒性作用限制了细胞分裂。
苯酚暴露浓度对实验红鲫红细胞微核率的影响显示:各时间段试验组与对照组微核率差异显著(P<0.05)。多重比较显示24h 2.16mg/L浓度组与4.31mg/L浓度组、8.62mg/L浓度组、17.24mg/L浓度组之间差异极显著(P<0.01),4.31mg/L浓度组与8.62mg/L浓度组、17.24mg/L浓度组差异极显著(P<0.01),8.62mg/L浓度组与17.24mg/L浓度组差异显著(P<0.05);48h的结果同24h;72h各浓度组与对照组之间差异均极显著(P<0.01);96h 2.16mg/L浓度组与4.31mg/L浓度组、8.62mg/L浓度组、17.24mg/L浓度组差异极显著(P<0.01),4.31mg/L浓度组与8.62mg/L浓度组、17.24mg/L浓度组差异极显著(P<0.01),4.31mg/L浓度组与17.24mg/L浓度组差异显著(P<0.05)。
表4-18 苯酚对实验红鲫红细胞微核率的影响
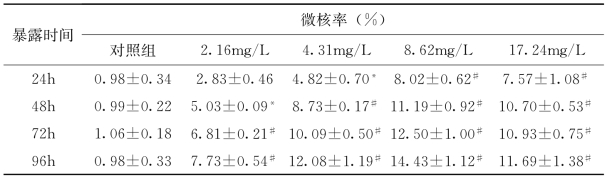
注:*P<0.05 #P<0.01。
(3)彗星试验检测苯酚对实验红鲫红细胞DNA损伤
彗星试验结果(表4-19)表明不同浓度处理组在24h、48h、72h和96h DNA损伤程度跟对照组相比均显著上升。然而,72h DNA损伤程度比48h降低,同样的情况也发生在96h跟72h对比时。
表4-19 不同苯酚浓度下的红鲫血细胞的DNA损伤表
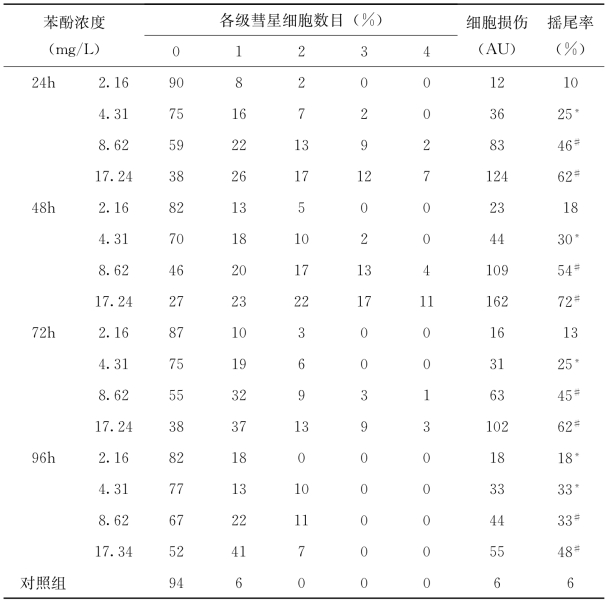 (https://www.xing528.com)
(https://www.xing528.com)
注:*P<0.05 #P<0.01。
(4)苯酚对实验红鲫性腺组织SOD活性的影响
红鲫暴露于0mg/L、2.16mg/L、4.31mg/L、8.62mg/L、17.24mg/L苯酚中24h、48h、72h、96h后性腺组织SOD、GSH-Px活性结果(表4-20)表明:当苯酚浓度较低(2.16mg/L)时,实验红鲫体内产生大量的ROS等有害物质,SOD活性被诱导,随暴露时间延长,活性逐渐升高。红鲫暴露于8.62mg/L苯酚中,48h酶活即被显著诱导(P<0.01),72h达到最高值后开始下降。苯酚浓度达到17.24mg/L,24h酶活即被显著诱导,48h达到最高值后开始下降。由表4-20可以看出苯酚浓度越高,SOD活性被显著诱导的时间越早,表现出一定的剂量-效应关系和时间-效应关系。
表4-20 苯酚暴露下红鲫性腺SOD活性的影响

注:*P<0.05 #P<0.01。
(5)苯酚对实验红鲫性腺组织GSH-Px活性的影响
由表4-21可知,低浓度苯酚(2.16mg/L)暴露24h后,GSH-Px活性跟对照组相比无显著差异,随暴露时间延长,酶活性逐渐降低。在4.31mg/L浓度苯酚暴露下,24h酶活升高,跟对照组相比,差异显著(P<0.05),随后酶活开始下降。高质量浓度苯酚(17.24mg/L)暴露下,酶活随暴露时间延长逐渐降低。各实验组在苯酚暴露48h,酶活开始下降。整体看来,GSH-Px酶活性随苯酚浓度增加和时间延长变化并不显著,剂量-效应和时间-效应关系不明显。
表4-21 苯酚暴露下红鲫性腺GSH-Px活性的影响
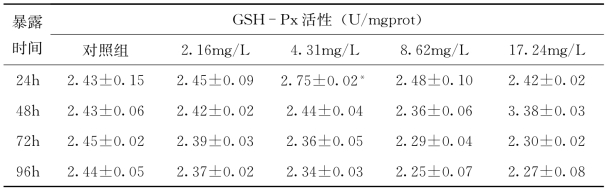
注:*P<0.05。
4.讨论
(1)苯酚诱发实验红鲫微核、彗星产生的机制及应用
微核试验(mieronucleus test,简称MNT)用于鱼类毒理学研究已有很多报道。微核试验是检测分裂后期染色体行为畸变的一种简便易行的方法。其原理是在外界诱变物干扰下,染色体断裂或纺锤丝功能障碍使染色质片段在分裂后期不能迁移到两级,进而不能在分裂末期进入子细胞中。这些染色质片段或整条染色体由于染色体迁移滞后,而在子细胞细胞质中形成一到多个微核。因此可以用微核出现的频率来检测染色体受伤害的程度,进而反映化学物或环境污染物的遗传毒性。水生污染物导致生物、种群、群落和生态水平上的多重后果,影响器官功能、生育状况、种群规模和生物多样性。其中,致癌、致突变的化合物是最危险的,可能超越对个体的伤害,会伤害几代人。敏感生物体的遗传毒性标志物可用来评估致突变污染物和确定污染物的来源。微核试验是检测细胞遗传损伤最合适的技术之一。目前微核试验被广泛应用在野生和转基因水生生物品种。大部分污染水环境的遗传毒性效应已在双壳类和鱼类上有所研究。在双壳类最常进行微核试验的组织就是血细胞和鳃细胞。鱼类微核试验可使用不同类型的细胞:红细胞、鳃细胞、肾细胞、肝细胞和鳍细胞。其中应用最广泛的就是外周血红细胞,因为它避免了复杂的细胞制备和频繁的动物杀害。国内外各实验室进行了暴露于不同污染物的不同鱼类红细胞微核的验证。鱼类红细胞MN的测试也广泛、频繁应用在暴露不同时期的淡水和海洋环境的遗传毒性评估。
微核试验,由于其简易性已成为测试环境动物基因组改变最适合的技术之一。它比中期染色体损伤的显微分析在技术上更容易,更快速,也解决了用染色体畸变技术难以分析的小染色体问题。此种方法可以分析任意核型任意增殖期的细胞。这也是为什么这种生物标志物被广泛应用在环境生物监测的原因之一。鱼类跟高等脊椎动物一样,当暴露于有毒物质中,可用来评估有毒物质对人类的潜在危害。Carrasco等首次描述了微核及核异常的判断标准。鱼红细胞微核的大小和形状是:圆形或椭圆形,直径为主核的1/5到1/40不等,最常见的鱼红细胞NAs(核异常)有核固缩、核碎裂、核空泡、核质外凸、核质内凹、核质缢裂等。现在还不能充分解释NAs的形成机制。如主核向外突出以“出芽”方式形成的NAs,即核质外突,其中一些被认为是遗传毒性损伤的指标,因此,它们可以作为MN的补充数据。微核与核质外突之间的关系,已有报道,而其他NAs,如核空泡,主要是相关的细胞毒作用,必须分开记录。
自从Singh等引入彗星试验,SCGE就成为检测DNA损伤修复、生物监测和遗传毒性检测的快速、高效、简便、敏感的实验方法。这项技术可以定量检测多种形式的DNA损伤,如单链DNA断裂、碱不稳定性位点、DNA交联、不完全切除修复等各种DNA损伤。现在彗星试验已被广泛应用在遗传毒理学和环境监测领域。
在衰老、遗传疾病、癌症治疗过程中,都会存在DNA损伤,DNA损伤的广泛应用使得人们迫切需要一种更简便的检测方法。彗星实验自1988年改进后,其应用的宽度和应用的人数几乎成指数增长。相比其他遗传毒性试验,SCGE的优点包括检测低水平DNA损伤的敏感性,每个样本所需的细胞数量少,实验周期短(只需几天),需要的试验材料少,它具有灵活性、低成本和操作简便、快速的优点。在接下来的十年中,此项技术被广泛应用于遗传毒性中人类和环境生物检测的DNA修复过程。彗星实验在遗传毒理学中的应用包括:①作为潜在的高通量筛选实验;②区分遗传毒性与细胞毒性诱导的染色体损伤的机制研究;③区分遗传毒性与非遗传毒性致癌物体内实验的机制研究;④潜在的用于调节表达的一组体内体外实验。彗星实验已经经历了实验室间、国际间的验证。
我们的研究结果表明彗星试验是一种评价苯酚遗传毒性的可靠敏感的方法。在实验中,实验红鲫血液红细胞在不同浓度、不同时间的苯酚处理下,DNA损伤跟对照组相比有显著性差异,证实苯酚确实具有遗传毒性。在实验中我们观测到72h时DNA损伤比48h时降低,96h时比72h时降低。有两个主要的机制可以解释这种现象:活细胞中DNA的嵌入过程和细胞色素P450的交互作用。DNA损伤的降低来源于DNA修复引起的损伤细胞的减少,活体中的一些代谢酶可以解毒或生物转化外源性化学物质。细胞色素P450就是这样一种酶,它可以引起药物、杀虫剂和化学致癌物的化学变化。我们的实验结果表明上述两种机制都可能是引起不同的暴露时间DNA损伤降低的主要原因。我们的研究结果表明苯酚确实可以引起实验红鲫红细胞的DNA损伤,我们的研究结果同样表明彗星试验是一种简单有效的生物标记。
(2)苯酚胁迫下实验红鲫的SOD和GSH-Px活性变化机制
目前作为生物标记物应用最广的酶就是超氧化物歧化酶(Superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(Glutathione peroxidase,GSHPx)。当暴露于污染环境时,细胞会产生过量的活性氧(Reactive Oxygen Species,ROS),如O2-、H2O2、OH等,这些ROS作为信号分子,刺激细胞的防御反应,对抗机体的一系列疾病。SOD能将O2-转化为H2O2,降低组织的氧化损伤。GSH-Px也是动物体内一种重要的抗氧化酶,它能催化过氧化氢的还原反应,对由ROS和羟自由基诱发的脂质过氧化物及过氧化氢有极强的清除能力,从而保护生物膜结构和生物大分子免受过氧化物损伤。因此,SOD和GSH-Px可以作为一种敏感有效的生物标志物用于指示水体环境中存在的有毒物质,同时也可用于反应污染物对水生动物的毒性效应。
抗氧化酶SOD和GSH-Px是生物体内抗氧化防御机制的一部分,在防御外来物质入侵,诱导氧化应激方面发挥着重要作用,常用其作为氧化胁迫的生物指标。ROS可引发脂质过氧化,对抗它们的第一道防线,就是SOD。其功能是催化超氧阴离子自由基转化为过氧化氢。SOD活性的降低,表明机体产生的超氧阴离子自由基(O2-)过多,引发脂质过氧化。GSHPx则负责分解大部分的过氧化氢和脂质过氧化物,从而保护细胞免受过氧化物的毒害。机体处于胁迫状态下,会产生超氧阴离子自由基(O2-)、H2O2、羟自由基(OH)和单态氧(O1)等ROS物质,从而产生氧化应激,损害脂质、蛋白质或核酸物质,导致生化损伤。许多环境污染物如苯酚,可诱导水生生物体内产生大量ROS成分,机体中的抗氧化酶系统在维持氧自由基代谢平衡方面起着十分重要的作用,因此抗氧化酶活力变化可以反映体内ROS的变化。许多研究表明,当生物体受到轻微外界污染物胁迫时,SOD活性往往升高;而当受到重度外界污染物胁迫时,SOD活性通常降低,使生物体内积累过量的ROS,从而导致生物体受到伤害。在本试验中,红鲫暴露于低质量浓度苯酚时,机体被诱导产生大量SOD,以消除由于苯酚刺激而产生的氧自由基,使机体免受氧自由基的伤害。随暴露时间的延长,机体产生了适应性,应激反应减缓,酶活开始下降。苯酚浓度过高时,机体短时间内产生过量氧自由基,超过了机体的调节能力,ROS开始攻击各种生物大分子,对机体产生毒害。Roche等研究发现苯酚能引起黑鲈(sea bass)红细胞过氧化酶活性增加和红细胞溶血。黑鲈腹腔注射苯酚3~15天后,总血红蛋白、红细胞压积、过氧化氢酶活性降低;皮质醇、超氧化物歧化酶、谷胱甘肽过氧化物酶和过氧化物酶活性增高。以上例子说明苯酚极易引起生物体内抗氧化酶类活性改变,从而引起氧化应激反应。Kotkat等发现鲤鱼在亚致死剂量苯酚暴露下能够引发脂质过氧化,红细胞膜磷脂成分、磷脂流动性和渗透性下降。
(3)利用实验红鲫作为指示生物评价含酚废水的可行性
酚是我国工业废水中很普遍的污染毒物,对渔业水体危害极大。关于苯酚对鱼类急性毒性试验的研究,前人已做了大量的工作。研究表明苯酚对剑尾鱼的96h LC50为45.5mg/L,对罗非鱼的96h LC50为28.49mg/L,对金鱼幼鱼24h LC50为41.6mg/L,48h LC50为32.3mg/L,安全浓度为5.8mg/L,对中华鲟稚鱼24h、48h、72h和96h的LC50分别为97mg/L、83mg/L、75mg/L和71mg/L,对斑马鱼24h、48h和96h的LC50分别为56.96mg/L、43.04mg/L和42.67mg/L。本试验中测得苯酚对红鲫24h、48h和96h的LC50分别为38.02mg/L、36.83mg/L和34.48mg/L,跟其他鱼相比,红鲫对苯酚的敏感性更高一些,更适合做水污染的指示生物。目前,生物标志物在环境污染监测方面应用广泛,微核试验、彗星试验,SOD活性作为生物标志物各有优缺点。微核试验操作最简便,可随时随地进行,且只需一台显微镜就可对结果进行统计分析;缺点是微核试验只能检测染色体损伤,因此只有外界污染物浓度足以引起染色体断裂才能用微核试验。彗星试验的不足之处是操作相对复杂,只能在实验室进行,需要荧光显微镜和专门的分析软件对彗星进行分析;但是彗星试验非常灵敏,能检测多种形式的DNA损伤,可从单细胞水平检测DNA损伤,为外界胁迫物的靶点定位提供可能。SOD活性随外界污染物浓度变化反应灵敏,测定无须特别的仪器。总体来说,微核试验、彗星试验、SOD活性具有试验取材方便、技术方法成熟、测定只需常规仪器等优点,且随外界胁迫物强度变化明显,作为生物标记进行含酚废水监测是完全可行的。本试验中性腺GSH-Px随外界胁迫物变化不显著,其作为生物标记物有待进一步的试验验证。
实验红鲫C1HD系为本实验室自主培育的雌核发育纯系,饲养繁殖方法成熟,遗传背景清晰,体形适当,取材方便,本试验中微核试验、彗星试验,SOD活性各项指标随苯酚浓度增加和暴露时间延长变化显著,几种生物标志物结合起来更能全面、科学、准确地反应含酚废水的生物毒性。鱼类是水生生物食物链的重要一员,可从组织、细胞、分子多个层面上反应污染物的综合毒性,因此实验红鲫作为含酚废水监测的指示生物是可行的。
5.结论
(1)苯酚对实验红鲫24h、48h和96h半数致死浓度LC50分别为38.02mg/L、36.83mg/L和34.48mg/L,安全浓度为3.45mg/L。
(2)苯酚胁迫下,除性腺GSH-Px活性外,实验红鲫红细胞微核率、拖尾率、性腺SOD活性变化显著,均可作为生物标志物用于实验红鲫监测含酚废水的毒性。
(3)实验红鲫适合做含酚废水的指示生物。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




