苯酚(phenol)又名石碳酸,广泛应用于化学工业、炼焦、制药、造纸、颜料合成、石油加工等工业部门,是有机工业中的重要有机材料。
1997年美国环保局列出的129种优先控制的有机污染物中,苯酚被确定为中国优先控制的有机污染物之一。国际上对于酚类化合物的环境污染和生态效应给予了普遍的关注和高度的重视。苯酚属持久性有机污染物,细胞原浆型毒物,对所有生物都具有毒杀作用,是一类高毒物质,如果饮用或者食用污染水域中的水或水产品,将直接影响到人体健康。低浓度苯酚可使蛋白变性,高浓度苯酚可使蛋白质凝固,具有神经毒性。苯酚具有高毒性、长期性、隐蔽性和滞后性等特点。高毒性指只有在高剂量下才能引起生物体的毒性效应,低浓度下并无明显的毒性症状;长期性指污染物化学性质稳定,不容易被降解,在环境介质中的存留时间和对生态系统的作用时间较长;隐蔽性指毒物的效应不会直接对生物造成急性症状,往往是一种潜在的功能性效应,不易为人察觉;滞后性指毒物效应潜伏时间长,往往不在当时甚至不在当代表现出来。传统毒理学的方法往往无法全面准确地检测其生态毒性。现有的化学分析方法虽然能定量分析环境或生物体内污染物含量,但仅凭含量来反映污染物对生物的毒性效应缺乏说服力。因此,水生生态毒理学研究迫切需要找出能反映污染物作用机制,并且可以对污染物进行预警检测的指标。生物标志物由于能对污染物低剂量长期暴露的早期损伤做出预警而成为近年来国内外研究的热点。国内已报道很多关于苯酚对水生生物的影响,受试生物主要集中在发光菌、藻类、大型蚤类、甲壳类、鱼类等,研究内容主要集中在急慢性毒性、生长发育和生理代谢影响三个方面。水生生物是水环境化学品污染预警和评价的常用受试生物,其中鱼类充当着重要角色。而实验红鲫体色全红,是水污染优良的安全指示物,其具有以下几个优点:
①生命力强,能正常生活于水温10~30℃的环境中,耐低氧(0.1mg/L)等。②性成熟早,繁殖力强。③体色全红,易于发现变异个体。④体形适当(成体体长130mm左右)、杂食性,饲养成本低。
1995年,南华大学吴端生教授等对红鲫的生物学特性进行了研究,发现红鲫具有满足实验动物基本要求的许多优点,2000年培育出了红鲫近交系C1HD系。众多文献资料表明,国内外不少学者以鲫属鱼类作为实验动物,已经广泛应用于遗传学、胚胎学、内分泌学、毒理学等领域的试验研究,特别是应用于急性毒理试验、评价药品及化学品毒性等。
生物标志物是通过对体液、组织或整个生物体的测量,能够表征对化学污染物的暴露和(或)其效应的生化、细胞、生理、行为或能量上的变化。笼统地说,生物标志物就是可衡量环境污染物的暴露及效应的生物反应,检测结果可以反映污染物与生物效应之间的内在关系。因此,生物标志物可以用于环境污染的探查和快速诊断、环境健康的风险性评价及污染物对生物伤害的早期预报。超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSHPx)是机体内最主要的抗氧化酶,其活性的变化与氧自由基和其最终产物(LPO)的产量直接相关。机体主要通过抗氧化酶(酶系统)和清除剂(非酶系统)清除氧自由基,过多的氧自由基能损伤生物大分子,从而影响细胞的结构和功能。热休克蛋白(Heat Shock Protein,HSP或Hsp)也称应激蛋白(Stess Protein,SP),是由遗传学家Ritossa在1962年研究果蝇唾液腺时发现的。当生物体受到各种外界刺激时,会产生一组结构上非常保守的蛋白质,对细胞具有保护和修复作用。按照蛋白的大小,热休克蛋白共分为五类,分别为HSP110,HSP90,HSP70,HSP60以及小分子热休克蛋白(small Heat Shock Proteins,sHSPs)。研究发现,HSP表达水平的升高几乎是所有生物受到污染刺激后的第一个应激反应。HSP作为生物标志物能比传统的生长、发育等生物学指标更敏感,因为在受到污染胁迫时,应急蛋白诱导蛋白的完整性会受到影响。这一特性国外学者称之为“蛋白毒性”。同时,在水生生物应激试验中,某些物理刺激如注射、采样不会影响HSP的表达,对试验结果造成误差。已有研究表明:处理虹鳟的应激不会改变其肝脏内Hsp70的表达以及肌肉、腮、心脏和肝脏的Hsp70的表达。由于Hsp70的高度保守型,从原核生物到人类体内都能合成Hsp70,因此可作为环境监测指标排除因物种的不同和生存环境的不同而造成的差异因素。
1.实验目的
本实验室已经培育了标准化实验红鲫,并在此基础上拟开展实验红鲫的应用研究,包括生态毒理学应用。为了阐明苯酚对实验红鲫的生化毒理效应,本文研究不同浓度苯酚、不同作用时间对实验红鲫血液常规生化指标、肝脏SOD与GSH-Px活性及主要组织中Hsp70表达的影响,以求探讨实验红鲫应用于生态毒理学研究的可行性。
2.方法
(1)急性毒性试验
按静水毒性试验法将实验红鲫暴露于25mg/L,32mg/L,34.2mg/L,36.9mg/L,40.0mg/L,50.0mg/L,63.0mg/L共7个苯酚浓度组和一个空白对照组的水族箱中,每个浓度再设3个平行组,每组饲养10尾,记录下水温,每12h观察记录一次红鲫的中毒症状和死亡时间,随时捞出死亡个体,并记录各组鱼24h、48h、72h、96h的死亡数量。用直线内插法,以浓度的常用对数为横坐标,死亡率的概率单位为纵坐标,求出各自的半数致死浓度(LC50)以及由公式96h LC50×0.1求安全浓度。
(2)苯酚暴露试验
通过苯酚对实验红鲫的毒理学试验,设置4个染毒组(Ⅰ、Ⅱ、Ⅲ、Ⅳ)含苯酚浓度分别为96h LC50的1/16,1/8,1/4,1/2,即2.16mg/L,4.31mg/L,8.60mg/L,17.24mg/L和一个空白对照组不含苯酚,在染毒后24h,48h,72h,96h分别在四个浓度组取出3尾鱼作如下处理:①湿毛巾包裹鱼尾以上部分,尽量减少刺激,一次性注射器于尾静脉抽血。②解剖并提取肝、肾、心、鳃、脑备用。
(3)血液生化指标的测定
设置4个浓度组与一个空白对照组(同上),苯酚染毒96h,在24h,48h,72h,96h分别在各浓度组抽取3尾实验鱼抽血。收集血清用作生化指标分析。血液生化指标测定包括:钠离子(Na+)、氯离子(Cl-)、总蛋白(TP)、白蛋白(ALB)、谷草转氨酶(AST)、谷丙转氨酶(ALT)、碱性磷酸酶(ALP)、乳酸脱氢酶(LDH)。血液样本送南华大学附一医院生化检验科检测。
(4)肝脏SOD活性、肝脏GSH-Px活性的测定
测定操作参照相关试剂盒使用说明书。
(5)主要器官Hsp70表达
为了研究在低浓度暴露条件下实验红鲫受苯酚胁迫后,肝、肾、心、腮、脑5个器官内应激蛋白Hsp70的诱导情况,并探讨Hsp70作为苯酚水体污染的生物标志物的可行性。本试验把实验红鲫分为4个浓度组(Ⅰ、Ⅱ、Ⅲ、Ⅳ)和一个空白对照组(同上),染毒96h,在24h,48h,72h,96h分别在各个浓度组处死两条鱼,提取肝、肾、心、腮、脑,提取其总蛋白,Western blot分析显示五个器官均表达Hsp70。以β-actin为内参进行灰度扫描分析,Hsp70的表达与苯酚的浓度与染毒时间具有相关性。
(6)统计学分析
所有数据均采用均数±标准差(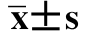 )表示,用SPSS 19.0软件进行统计分析,并经方差齐性分析后进行t检验,P>0.05表示差异不显著,P<0.05表示差异显著,P<0.01表示差异极显著。
)表示,用SPSS 19.0软件进行统计分析,并经方差齐性分析后进行t检验,P>0.05表示差异不显著,P<0.05表示差异显著,P<0.01表示差异极显著。
3.试验结果及讨论
(1)实验红鲫血液常规生化指标应用于生态毒理学研究
1)不同苯酚浓度下红鲫死亡率、半数致死浓度和安全浓度
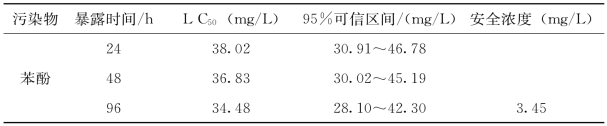
由表4-1和表4-2可知,苯酚胁迫下实验红鲫24h、48h和96h的半数致死浓度分别为38.02mg/L、36.83mg/L、34.48mg/L,安全浓度为3.45mg/L。
表4-1 不同苯酚浓度下红鲫死亡率
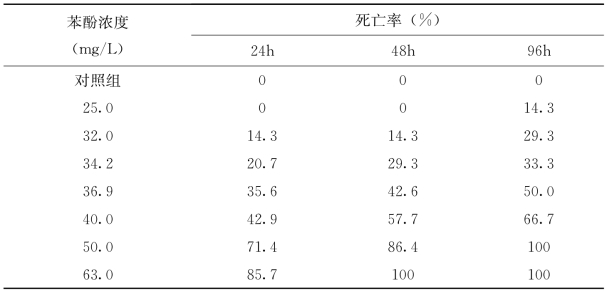
表4-2 苯酚对红鲫的半数致死浓度和安全浓度
2)不同浓度苯酚暴露不同时间后实验红鲫血清蛋白浓度
根据表4-3至表4-6结果显示,染毒24h后,实验红鲫血清总蛋白(TP)、白蛋白(ALB)和球蛋白(GLB)的浓度,随着苯酚浓度由染毒组Ⅰ(2.16mg/L)增加到染毒组Ⅲ(8.60mg/L)和染毒组Ⅳ(17.24mg/L),其浓度值有所增加。但是经过统计学分析,其增加值无统计学意义。根据表4-4、表4-5结果显示,染毒48h和72h后,实验红鲫血清总蛋白(TP),随着苯酚浓度由染毒组Ⅰ(2.16mg/L)增加到染毒组Ⅲ(8.60mg/L)和染毒组Ⅳ(17.24mg/L),其浓度值有所减少,但没有统计学意义。只有白蛋白(ALB)、球蛋白(GLB)浓度值有所增加,且增加值具有显著性意义。根据表4-6,染毒96h后,实验红鲫血清总蛋白(TP)和白蛋白(ALB),随着苯酚浓度由染毒组Ⅰ(2.16mg/L)增加到染毒组Ⅲ(8.60mg/L)和染毒组Ⅳ(17.24mg/L),其浓度值有所减少,但没有统计学意义。也只有球蛋白(GLB)浓度值有所增加,且增加值具有显著性意义。原因是ALB合成的主要场所是肝脏,苯酚暴露后肝脏受到了污染胁迫,ALB的合成受到了影响,因此ALB下降。只有当肝脏出现严重病变或者损伤时,ALB才会显著减少。而GLB的上升则是由于苯酚的污染胁迫引起了机体的应激反应,产生了某些应激蛋白以抵抗有害刺激,导致GLB有所上升。本试验中肝脏虽然受到了污染胁迫,但并未受到实质性损伤,同时发现ALB、GLB、AP水平的波动相对于本试验中苯酚暴露浓度和暴露时间,规律性不强。具体结果见表3~6。
表4-3 不同浓度苯酚暴露24h后实验红鲫血清蛋白浓度(平均值±标准差)

表4-4 不同浓度苯酚暴露48h后实验红鲫血清蛋白浓度(平均值±标准差)
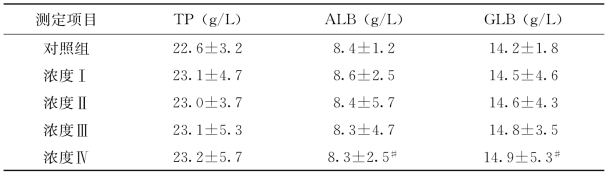
#:与空白对照组比较P<0.05;*:与空白对照组比较P<0.01
表4-5 不同浓度苯酚暴露72h后实验红鲫血清蛋白浓度(平均值±标准差)
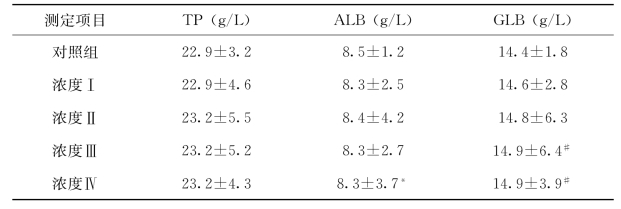
#:与空白对照组比较P<0.05;*:与空白对照组比较P<0.01
表4-6 不同浓度苯酚暴露96h后实验红鲫血清蛋白浓度(平均值±标准差)
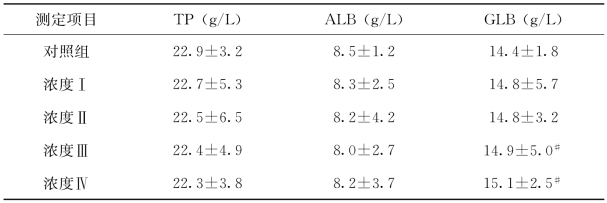
#:与空白对照组比较P<0.05;*:与空白对照组比较P<0.01
3)不同浓度苯酚暴露不同时间后实验红鲫血清酶活性(https://www.xing528.com)
根据表4-7~表4-10试验结果显示,苯酚暴露96h,从染毒组Ⅰ到染毒组Ⅲ和染毒组Ⅳ,谷丙转氨酶(ALT)和谷草转氨酶(AST)均有所增加,ALT增加的幅度较AST大。其中AST染毒组Ⅰ在苯酚暴露24h增加不显著外,其余染毒组随着苯酚浓度的增加和暴露时间的延长而显著增加。
ALT在苯酚暴露24h,染毒组Ⅰ和染毒组Ⅱ增加无显著性,其后各染毒组与对照组相比,浓度显著增加,直到染毒96h染毒组Ⅳ的ALT增加出现平缓。临床上常用AST/ALT的比值来反映肝细胞的损害情况,ALT位于肝细胞浆内,而AST位于肝细胞浆和线粒体内。当肝细胞轻度病变时,仅有肝细胞浆内的酶释出,ALT上升幅度较AST大,代表轻度肝损伤或者急性肝炎早期。苯酚对实验红鲫肝脏产生了污染胁迫,但未造成严重损伤。ALT与AST的浓度随着苯酚暴露浓度的增加与暴露时间的延长出现了相应的变化。可作为衡量苯酚胁迫的重要指标。
表4-7 不同浓度苯酚暴露24h后实验红鲫血清酶活性(平均值±标准差)
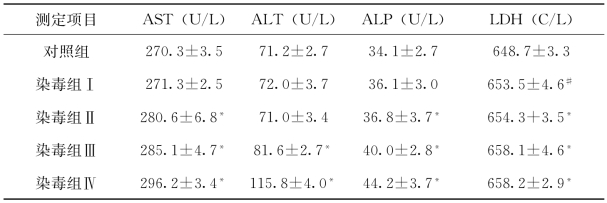
#:与空白对照组比较P<0.05;*:与空白对照组比较P<0.01
表4-8 不同浓度苯酚暴露48h后实验红鲫血清酶活性(平均值±标准差)

#:与空白对照组比较P<0.05;*:与空白对照组比较P<0.01
表4-9 不同浓度苯酚暴露72h后实验红鲫血清酶活性(平均值±标准差)
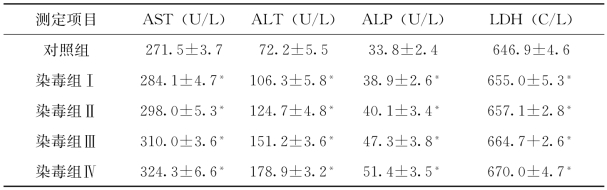
#:与空白对照组比较P<0.05;*:与空白对照组比较P<0.01
表4-10 不同浓度苯酚暴露96h后实验红鲫血清酶活性(平均值±标准差)
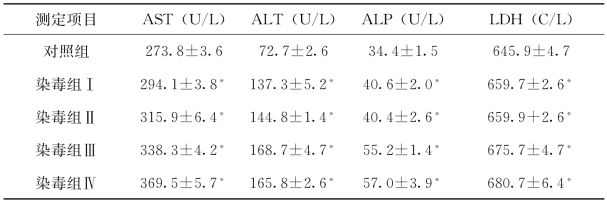
#:与空白对照组比较P<0.05;*:与空白对照组比较P<0.01
4)Na+和Cl-浓度变化情况
只在染毒96h后,染毒组Ⅲ和染毒组Ⅳ出现了下降趋势。其余各染毒组Na+和Cl-浓度无显著变化。血液Na+和Cl-浓度主要反映的是肾脏的受损,当肾脏受损时,对于这类无机离子的重吸收将受影响,导致血液中无机离子的浓度下降。苯酚暴露72h内,随着苯酚浓度的增大,肾脏并未受到损伤。苯酚暴露96h后,肾脏Na+和Cl-重吸收功能受到削弱,可能原因是苯酚对肾脏造成了损伤。
(2)实验红鲫肝脏SOD和GSH-Px活性应用于生态毒理学研究
由表4-11、表4-12和图4-1、图4-2结果显示,染毒24h,48h,72h,96h,SOD活性从染毒组Ⅰ(2.16mg/L)到染毒组Ⅲ(8.60mg/L)和染毒组Ⅳ(17.24mg/L)呈现上升的趋势,原因是苯酚具有氧化毒性,能诱导机体产生过量的活性氧(ROS),体内的防御功能启动,诱导SOD活性增加,将O2-歧化为H2O2,保护细胞免受组织损伤,并随着苯酚浓度的增大,暴露时间的延长而活性持续增加。研究发现,多数污染物对肝脏SOD和GSHPx的活性影响均是在受到轻度污染胁迫时诱导,重度污染胁迫时抑制。各染毒组在苯酚暴露24h其GSH-Px活性被显著抑制,48h,72h,96h其活性开始显著诱导。原因可能是GSH-Px主要底物是H2O2,染毒初期苯酚诱导机体产生过量活性氧,导致SOD活性增加将O-歧化为H2O2,由于染毒24h实验红鲫肝脏SOD歧化反应产生的H2O2还未达到GSH-Px激活的临界点,所以GSH-Px并不升高,又由于苯酚对抗氧化酶有抑制作用,所以GSH-Px在苯酚暴露24h活性被抑制。在苯酚暴露48h后,肝脏累积的H2O2逐渐增多,达到了GSH-Px的临界点,诱导GSH-Px的活性增大,其活性与苯酚浓度和暴露时间有较好的相关性。同时,GSH-Px活性从苯酚暴露48h之后并未出现抑制的趋势,其原因与SOD一致,本实验设置的轻度污染胁迫对GSH-Px活性的影响只达到诱导阶段,并未达到抑制阶段。本实验以苯酚对实验红鲫进行毒性实验,结果显示SOD与GSH-Px活性与苯酚浓度与暴露时间有良好的相关性。综上所述,实验红鲫肝脏SOD和GSH-Px是良好的苯酚水体污染的生物标志物,实验红鲫可应用于生态毒理学研究。
表4-11 不同浓度苯酚暴露后实验红鲫肝脏SOD活性(单位:U/mgprot)
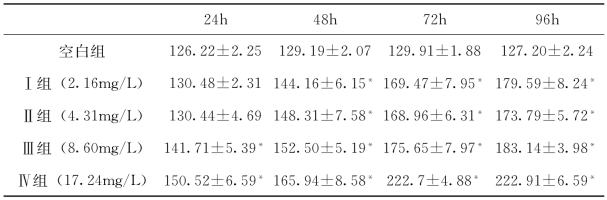
#:与空白对照组比较P<0.05;*:与空白对照组比较P<0.01
表4-12 不同浓度苯酚暴露后实验红鲫肝脏GSH-Px活性(单位:U/g)
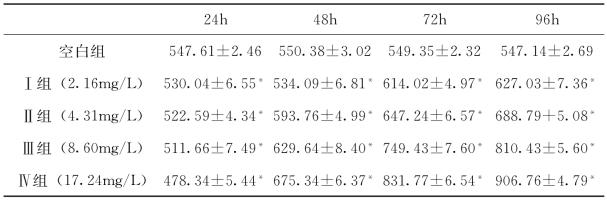
#:与空白对照组比较P<0.05;*:与空白对照组比较P<0.01

图4-1 不同浓度苯酚暴露后实验红鲫肝脏SOD活性(单位:U/mgprot)
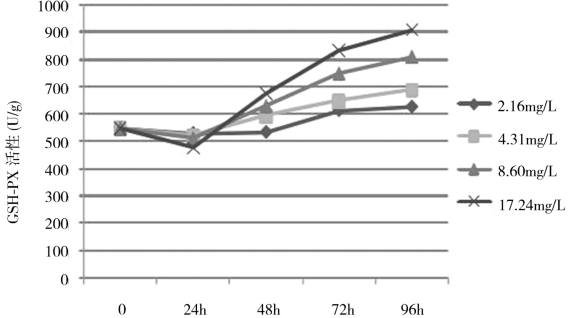
图4-2 苯酚对实验红鲫肝脏GSH-Px活性的影响
(3)血糖浓度
不同染毒组苯酚在不同暴露时间,实验红鲫血糖(GLU)浓度变化见表4-13。由表4-13可知,苯酚暴露96h各染毒组血糖(GLU)的浓度表现为先上升,再下降的趋势。原因可能是在染毒初期机体对苯酚产生了应激反应,需要消耗能量,因此血糖浓度上升。在苯酚暴露72h,由于实验期间并无喂食,高浓度组应激反应消耗的能量较大,因此染毒组Ⅳ的GLU浓度开始下降。在染毒96h各染毒组由于得不到能量补充,血糖均出现了下降。本研究显示,实验红鲫GLU与苯酚胁迫程度并无较大相关性,不适合作为检测苯酚水体污染的重要指标。
表4-13 不同浓度苯酚暴露实验红鲫血糖浓度(平均值±标准差)
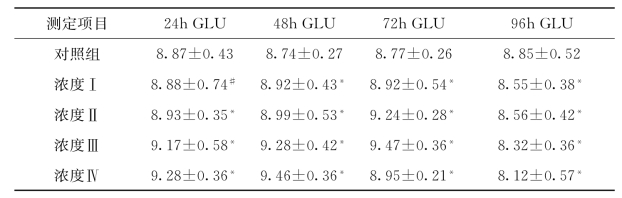
#:与空白对照组比较P<0.05;*:与空白对照组比较P<0.01
(4)实验红鲫主要器官Hsp70应用于生态毒理学研究
苯酚染毒试验中红鲫肝、肾、脑中Hsp70的表达总体趋势为随着苯酚暴露时间从24h到96h,苯酚浓度从染毒组Ⅰ(2.16mg/L)到染毒组Ⅳ(17.24mg/L),Hsp70表达量持续增加。染毒24h的染毒组Ⅰ和染毒组ⅡHsp70相对表达量差异无显著性,染毒组Ⅲ和染毒组Ⅳ差异无显著性,染毒组Ⅰ24h和48h的Hsp70表达量增加不显著,第48h染毒组Ⅲ和染毒组Ⅳ的Hsp70表达量差异不显著,分析原因可能是肝脏作为主要的解毒器官,在受到轻度污染胁迫时已经产生较强的应激反应,诱导产生足够的Hsp70甚至足以抵抗下一级的污染,以至于低浓度污染胁迫下相邻染毒组之间差异不明显。染毒组Ⅳ72h的Hsp70相对表达量略低于48h,染毒组Ⅰ48h的Hsp70相对表达量显著低于24h,分析原因可能是操作上失误。本试验结果显示的是苯酚染毒试验中红鲫心脏和鳃中Hsp70的相对表达量。从染毒24h的染毒组Ⅰ开始直到96h的染毒组Ⅳ,心脏和鳃中Hsp70的表达量呈现极显著增加,反映了红鲫心脏和鳃对苯酚极为敏感,是苯毒性染胁迫的靶器官,其Hsp70的表达量与染毒浓度和暴露时间呈较好的相关性。生物体在受到任意一类有害胁迫后的第一反应就是Hsp表达量增加,Hsp可作为环境污染物的生物标志物(biomarker)应用于生态毒理学。
Hsp70是应激蛋白中最保守、最重要的一种,在大多数生物中含量最多,在污染物应激后,合成也最为显著。Hsp70具有多种生物学功能,包括分子伴侣功能,参与免疫反应,抗细胞凋亡功能,提高细胞的应激耐受性,促进细胞增殖,参与细胞骨架的形成和修复等。本试验中Hsp70保护细胞的机制可能是多方面的综合作用,如参与免疫反应,提高机体整体的免疫力;提高细胞应激耐受性,增强细胞抵抗有害胁迫的能力;通过产生氧自由基的关键酶即还原型辅酶Ⅱ氧化酶,减少氧自由基的产生和增加内源性抗氧化剂活性,加速消除O-。关于Hsp70的相关研究,沈骅等应用Hsp70为生物标志物研究锌、铜对鲫鱼肝脏的影响。研究显示,Hsp70能在机体受到污染胁迫的第一时间产生应激反应,在受到轻度污染胁迫时Hsp70被诱导,在受到重度污染胁迫时Hsp70被抑制。
本试验测得实验红鲫肝脏SOD与GSH-Px,血液常规酶学指标,肝、肾、心脏、鳃、脑Hsp70的表达均与水环境中苯酚浓度呈较好的剂量-效应和时间-效应关系,能直观地反映水体中苯酚对鱼体的损伤,是良好的生物标志物,可用于水环境苯酚污染的预警。
4.结论
(1)苯酚对实验红鲫属于高毒物质。
(2)实验红鲫血液常规酶学指标,肝脏SOD与GSH-Px活性,肝、肾、心脏、鳃、脑中的Hsp70均可作为水环境中苯酚污染的生物监测物。
(3)实验红鲫可以应用于生态毒理学研究。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




