与其他湿法相似,用碱溶液洗涤含SO2的气体时,首先是SO2与水相互反应生成亚硫酸,部分亚硫酸离解成H+、HSO3-及少量的SO2-3离子。同时水溶液中的碱则离解成Na+离子和OH-离子。生成OH-离子时,通过中和反应而使H+离子量减少。
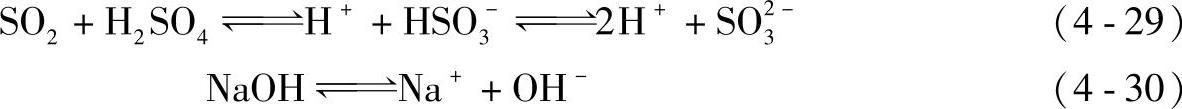
H+和OH-中和反应

亚硫酸钠的生成
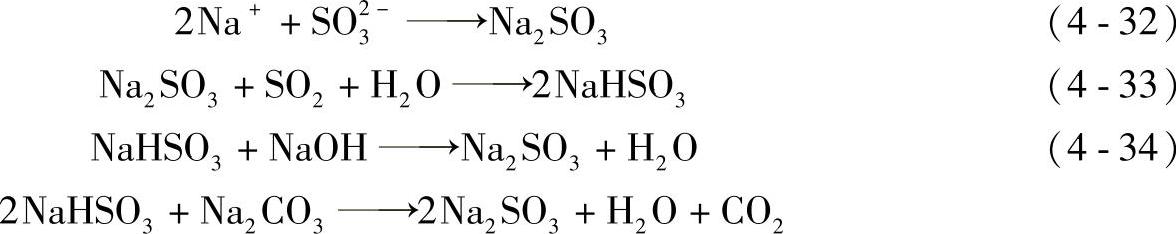
副反应

通过NaOH溶液吸收SO2时,pH值变化可分为如下几个阶段:
pH值自13.0降至8.4的变化,是吸收烟气中大量CO2的反应所致:
2NaOH+CO2→Na2CO3+H2O H=11.5
Na2CO3+CO2+H2O→2NaHCO3 pH=8.4
pH值自7.6至5.6的变化是吸收SO2之故。
Na2CO3+H2SO3→Na2SO3+H2O+CO2↑ pH=7.0
2NaHCO3+H2SO3→Na2SO3+2H2O+2CO2↑
然后再与过剩的SO2反应。(https://www.xing528.com)
Na2SO3+H2SO3→2NaHSO3 pH=4.4
pH=4.4时,Na2SO3全部变为NaHSO3,就不可能继续吸收SO2了。
pH值与Na2SO3-NaHSO3溶液浓度关系如图4-17所示。
从图4-17可知
pH=4.4时,100% NaHSO3,S/C=1
pH=7.5时,90% Na2SO3,S/C=0.55
pH=9.5时,100% Na2SO3,S/C=0.5
式中 S——每升溶液中硫的总物质的量(mol);
C——每升溶液中碱的总有效物质的量(mol)。
钠碱法脱硫一般控制循环槽内pH约为6.5。此时溶液中约60%的Na2SO3,40%的NaHSO3,S/C=0.70。
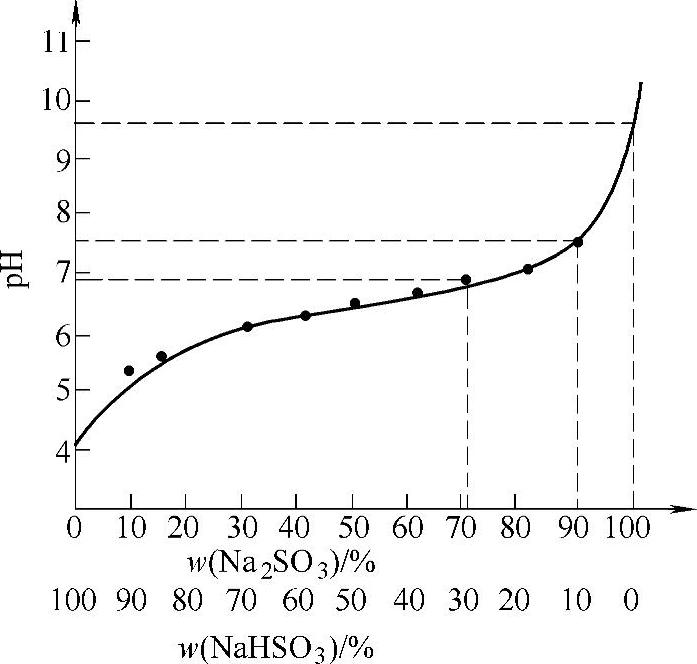
图4-17 pH与Na2SO3-NaHSO3的关系
从图4-18可知,当pH为7.1时,SO2浓度为10×10-6此时吸收液中20%是NaHSO3、80%是Na2SO3,S/C=0.6。
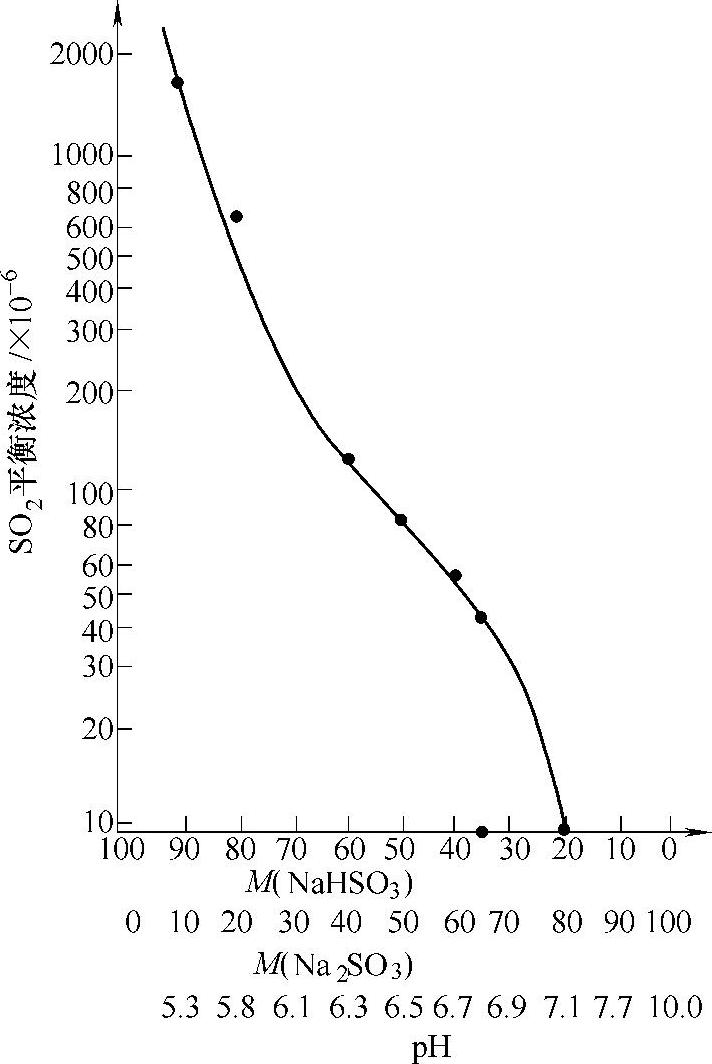
图4-18 SO2平衡浓度与Na2SO3-NaHSO3及pH的关系
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




