N-APPJ在与液体相互作用时会产生羟基(OH·)、单线态氧(1O2)、超氧阴离子(![]() )及过氧亚硝酸(ONOOH)等多种半衰期在纳秒级到毫秒级之间的短寿命活性粒子。国外一些研究人员使用电子自旋共振光谱(electronspin resonance spectroscopy)开展了对液相OH·和
)及过氧亚硝酸(ONOOH)等多种半衰期在纳秒级到毫秒级之间的短寿命活性粒子。国外一些研究人员使用电子自旋共振光谱(electronspin resonance spectroscopy)开展了对液相OH·和![]() 的定量诊断[74,75]。然而由于电子自旋共振谱仪诊断系统价格昂贵、操作复杂等问题,采用该方法的研究者较少。因此这里仅介绍利用荧光探针实现对液相短寿命粒子诊断的方法。
的定量诊断[74,75]。然而由于电子自旋共振谱仪诊断系统价格昂贵、操作复杂等问题,采用该方法的研究者较少。因此这里仅介绍利用荧光探针实现对液相短寿命粒子诊断的方法。
1.OH·的诊断
目前并没有用于OH·检测的商用试剂盒,这里介绍两种当前在文献中经常采用的用于液相OH·诊断的荧光探针,即对苯二甲酸(terephthalic acid,TA)和苯五甲酸(benzenepentacarboxylic acid,BA)。下面对这两种荧光探针检测OH·的基本原理和具体实验方法进行简要介绍。
(1)基本原理。
TA是一种在生物和化学等领域广泛使用的用于液相OH·诊断的荧光探针,它对OH·具有很高的选择性,不会与![]() 等氧化性粒子发生反应[76]。TA和OH·反应的基本原理如图6.6.1所示。TA自身无荧光,与OH·反应后会生成2-羟基对苯甲酸(2-hydroxyterephthalic acid,HTA),HTA在311nm紫外光的激发下会辐射出波长为424nm的荧光,TA则不会,因此通过测量得到的荧光强度可以得到OH·的相对浓度。进一步地,可以配制一系列浓度的HTA标准溶液,利用相同方法得到HTA和对应荧光强度的标准曲线,从而得到OH·的实际浓度。
等氧化性粒子发生反应[76]。TA和OH·反应的基本原理如图6.6.1所示。TA自身无荧光,与OH·反应后会生成2-羟基对苯甲酸(2-hydroxyterephthalic acid,HTA),HTA在311nm紫外光的激发下会辐射出波长为424nm的荧光,TA则不会,因此通过测量得到的荧光强度可以得到OH·的相对浓度。进一步地,可以配制一系列浓度的HTA标准溶液,利用相同方法得到HTA和对应荧光强度的标准曲线,从而得到OH·的实际浓度。
但是,TA作为诊断OH·荧光探针也存在着一些缺陷。如图6.6.1所示,TA的苯环上有4个可以用于OH·结合的位置,在实际反应中,OH·的结合具有随机性,一个TA分子可能会随机与4以内任意个数的OH·结合产生多羟基产物,因此得到的HTA荧光强度与OH·的实际浓度间的对应关系不是太好。使用TA的优点是最终的产物HTA比较容易获得,因此可以通过标定得到OH·的真实浓度。
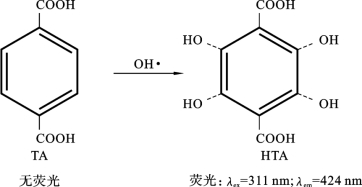
图6.6.1 TA和OH·反应原理图
BA作为一种检测OH·的新型荧光探针,可以很好克服TA的缺陷。BA和OH·反应的基本原理如图6.6.2所示。BA同样自身无荧光,与OH·反应后会生成羟基苯五甲酸(hydroxybenzenepentacarboxylic acid,HBA),HBA在311nm紫外光的激发下会辐射出波长为435nm的荧光,BA则不会[77]。可以看到,相比于TA,BA的苯环上仅有一个位置可以与OH·结合,因此最终得到的HBA的荧光强度与OH·的实际浓度有很好的线性关系。使用BA作为探针的主要缺陷是目前HBA标准品很难获得,难以进行最终的标定,因此只能得到OH·的相对浓度。
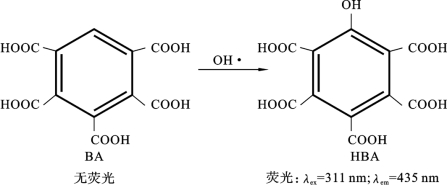
图6.6.2 BA和OH·反应原理图
(2)实验步骤。
在实际检测时,两种荧光探针对应的操作步骤基本相同。首先,先称取一定量的BA或TA粉末溶解到NaOH溶液中得到相应的储备液,接着取适量储备液稀释到合理的浓度作为探针加入到待测溶液中,最后利用荧光酶标仪检测对应的荧光强度。如果想要检测N-APPJ整个放电过程中产生的OH·,则需要在放电前将探针溶液加入到待处理液体中。
应当指出,目前利用TA和BA进行OH·的诊断并没有严格统一的操作规范,针对不同的实验,探针溶液的浓度具体选择多少,以及探针与待测溶液混合后静置的具体时间都需要在正式的实验前不断摸索,找到最佳实验条件。
2.1O2的诊断
(1)基本原理。
目前一种应用比较广泛的用于测量1O2的荧光探针称为(singletoxygen sensor green reagent,SOSG)的荧光探针。SOSG自身发出弱蓝色荧光,在和1O2反应后生成的产物会发出绿色荧光(λex=504nm,λem=525nm),而且该荧光探针对1O2具有高度选择性,不会受到OH·和![]() 等其他ROS的干扰[78]。因此,测量得到的荧光强度可以作为待测溶液中1O2的相对浓度。
等其他ROS的干扰[78]。因此,测量得到的荧光强度可以作为待测溶液中1O2的相对浓度。
(2)实验步骤。
实验过程中1O2具体测量步骤如下。首先,将100μg探针粉末溶解在33μL的甲醇中得到浓度为5mmol/L的储备液,取适量储备液用去离子水稀释到合适的浓度作为最后的探针溶液,剩余储备液-20℃下冻存备用。接着,取适量探针溶液加入到待测溶液中,如果需要检测N-APPJ放电过程中产生的1O2浓度,则需要在放电前将探针加入到待处理液体中。最后利用荧光酶标仪检测对应的荧光强度。
测量步骤中探针溶液的最佳浓度针对不同实验会有所不同,需要在多次实验中不断摸索,通常初始浓度范围可以在1~10μmol/L之间。(https://www.xing528.com)
3.![]() 的诊断
的诊断
如前所述,![]() 浓度的诊断可以采用电子自旋共振谱仪,但该方法具有设备昂贵、操作复杂等缺点。这里介绍一种利用超氧化物歧化酶(superoxide dismutase,SOD)实现对液相
浓度的诊断可以采用电子自旋共振谱仪,但该方法具有设备昂贵、操作复杂等缺点。这里介绍一种利用超氧化物歧化酶(superoxide dismutase,SOD)实现对液相![]() 诊断的方法。
诊断的方法。
(1)基本原理。
SOD是生物体内存在的一种抗氧化金属酶,它能够催化超氧阴离子自由基歧化生成氧和过氧化氢。因此,可以在待测溶液中加入活力值已知的SOD,等SOD与待测溶液中的![]() 反应后,再用SOD活力检测试剂盒测定反应后溶液中剩余的SOD活力值,最后得到的待测溶液消耗的SOD活力值就可以间接获得待测溶液中
反应后,再用SOD活力检测试剂盒测定反应后溶液中剩余的SOD活力值,最后得到的待测溶液消耗的SOD活力值就可以间接获得待测溶液中![]() 的浓度。
的浓度。
关于SOD活力的测定,目前已经有许多成熟的商用检测试剂盒,这些试剂盒大多采用的是WST-1法或WST-8法。WST-1和WST-8是由日本同仁化学研究所(DOJINDO)开发的两种水溶性四唑盐试剂,利用WST-1和WST-8检测SOD活力的原理如图6.6.3所示。可以看到两种方法的原理基本相同,即WST-1或WST-8可以和黄嘌呤氧化酶催化产生的![]() 反应产生水溶性的甲臜染料(formazandye),而这一反应步骤可以被SOD所抑制,因此通过对WST-1或WST-8产物的比色分析即可计算SOD的酶活力。只是WST-8是一种新开发的水溶性四唑盐,因此WST-8法比WST-1法更加稳定、灵敏度更高。
反应产生水溶性的甲臜染料(formazandye),而这一反应步骤可以被SOD所抑制,因此通过对WST-1或WST-8产物的比色分析即可计算SOD的酶活力。只是WST-8是一种新开发的水溶性四唑盐,因此WST-8法比WST-1法更加稳定、灵敏度更高。
(2)实验步骤。
实验过程中需要的SOD可以直接从生物试剂公司购买。实验时SOD标准溶液需现用现配,具体地,SOD粉末可以直接用双蒸水或磷酸盐缓冲溶液溶解,未用完的SOD粉末和溶液需在-20℃冷冻保存。
SOD加入到待测溶液后需要静置一段时间,让溶液中的![]() 与SOD充分反应,具体的静置时间及加入的SOD初始活力值需要通过预实验摸索确定。之后再利用SOD活力检测试剂测量溶液中剩余的SOD活力值。
与SOD充分反应,具体的静置时间及加入的SOD初始活力值需要通过预实验摸索确定。之后再利用SOD活力检测试剂测量溶液中剩余的SOD活力值。
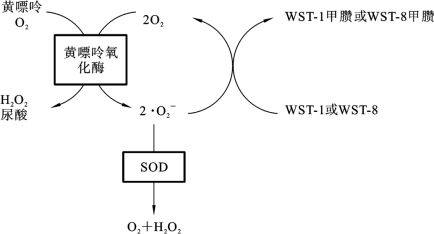
图6.6.3 利用WST-1或WST-8检测SOD活力原理示意图
4.ONOOH/ONOO-的诊断
N-APPJ与液体相互作用时生成的两种寿命较长的活性粒子H2O2和![]() ,它们可能通过化学反应生成ONOOH。ONOOH属于弱酸,其pKa为6.8[79],因此在酸性条件下它主要以分子形式存在,而在中性或碱性环境中则主要以离子形式(ONOO-)存在。ONOOH/ONOO-被认为在N-APPJ杀菌和选择性诱导癌细胞凋亡等生物医学效应中发挥着重要作用[75,80,81]。在早期的研究中,由于ONOOH/ONOO-自身寿命很短,同时缺乏特异性荧光探针,因此对液相环境中ONOOH的诊断研究非常少。近年来,一些从事化学领域的研究人员陆续研发了多种对ONOOH/ONOO-具有高灵敏度和高选择性的荧光探针,使对ONOOH/ONOO-的精确定量诊断成为可能[82-84]。这里介绍一种基于罗丹明酰肼的新型远红外荧光探针。
,它们可能通过化学反应生成ONOOH。ONOOH属于弱酸,其pKa为6.8[79],因此在酸性条件下它主要以分子形式存在,而在中性或碱性环境中则主要以离子形式(ONOO-)存在。ONOOH/ONOO-被认为在N-APPJ杀菌和选择性诱导癌细胞凋亡等生物医学效应中发挥着重要作用[75,80,81]。在早期的研究中,由于ONOOH/ONOO-自身寿命很短,同时缺乏特异性荧光探针,因此对液相环境中ONOOH的诊断研究非常少。近年来,一些从事化学领域的研究人员陆续研发了多种对ONOOH/ONOO-具有高灵敏度和高选择性的荧光探针,使对ONOOH/ONOO-的精确定量诊断成为可能[82-84]。这里介绍一种基于罗丹明酰肼的新型远红外荧光探针。
(1)基本原理。
该探针对ONOOH/ONOO-具有高度选择性,反应生成的产物在600nm的光的激发下可以发射出638nm的荧光[83],具体反应原理如图6.6.4所示。测量得到的荧光强度与溶液中ONOOH/ONOO-的浓度具有良好的线性关系,因此通过配制一系列浓度的ONOOH标准溶液,利用相同方法得到ONOOH浓度和对应荧光强度的标准曲线,利用标准曲线标定便可以得到被测液体中ONOOH/ONOO-的实际浓度。
(2)实验步骤。
实验时,首先取适量探针粉末用PBS缓冲液溶解得到储备液,再取适量储备液稀释到合适的浓度作为最后的探针溶液,然后将探针溶液加入到待测溶液中,混合均匀并充分反应后利用荧光酶标仪测量相应的荧光强度(λex=600 nm,λem=638nm)。最后,将ONOOH标准品稀释成不同浓度后用同样的方法测量荧光强度获得标准曲线,根据标准曲线即可得到待测液体中ONOOH/ONOO-的实际浓度。
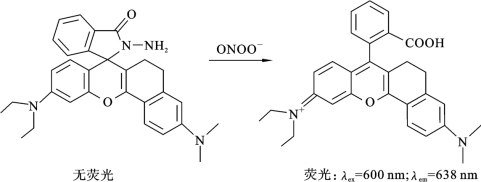
图6.6.4 ONOOH/ONOO-反应原理图
同样地,探针溶液的最佳浓度范围需要通过预实验摸索得到。此外,ONOOH标准溶液需在冰水浴上用NaOH溶液稀释,可以延缓ONOOH/ONOO-的分解速度。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




