一般来说,共振光散射的产生是由于分子吸收一定波长的激发光,从基态跃迁到激发态后,激发态的分子在返回基态的过程中发射出与激发波长相同的散射光,其散射强度会显著增大。然而,本实验发现DNA—EB体系的共振光散射强度随DNA浓度增大而明显降低,这个现象与在水溶液中是完全相反的。为了解释这个现象,实验中分别对不同DNA浓度下DNA—EB体系在水相与离子液体相中的吸收光谱进行了考察,结果如图3-2所示。
如图3-2(a)所示,在水溶液中随DNA浓度增大,EB的最大吸收波长发生明显红移。其原因是在水溶液中当EB分子与双螺旋DNA接触时,EB分子嵌入DNA双螺旋结构的碱基对孔穴中[25],EB与DNA发生键合反应有新的化学键产生,因此最大吸收波长发生改变;同时,随DNA浓度增大,EB在波长430~530nm范围内吸光度明显降低,这主要是由于DNA浓度增大,与DNA发生键合反应的EB分子也增多,从而导致水溶液中游离的EB分子浓度降低。
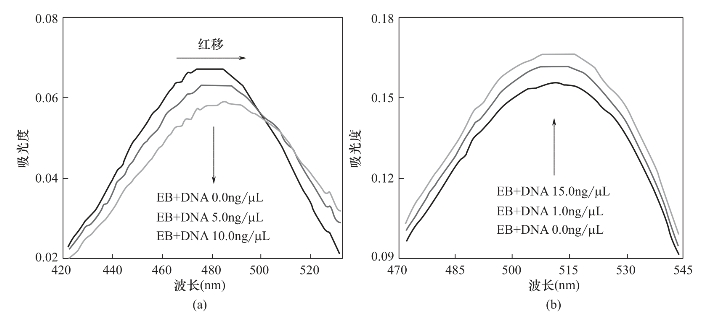
图3-2 DNA—EB体系的吸收光光谱
(a)水相:DNA浓度为0~5.0ng/μL,EB浓度为10ng/μL。
(b)DNA萃取进入IL相:DNA浓度为0~15ng/μL,体积为200μL;EB浓度为2.0μg/μL,体积为10μL;IL体积为100μL;乙腈体积为1000~1900μL;萃取时间为30min。(https://www.xing528.com)
从图3-2(b)可以看出,在离子液体相中,随DNA浓度增大,EB在470~540nm范围内的吸光度增大,这表明溶液中游离的EB浓度增大。这主要是由于在离子液体相中,离子液体的Bmim+与DNA首先发生结合反应[26],Bmim+插入DNA双螺旋结构中,从而阻止了EB分子与DNA的嵌入反应,EB分子只能通过静电吸引作用在DNA表面发生聚集,从而使溶液中EB浓度在局部浓集,导致其吸光度增大。从图中还可以看出,随着DNA浓度的增大,EB分子的最大吸收波长没有发生变化,这表明在离子液体相中EB分子没有嵌入DNA双螺旋结构中而与DNA发生键合反应。
通过对DNA—EB体系的吸收光谱的研究,认为EB分子与DNA的结合方式在水相与离子液体相中是完全不同的。在水溶液中EB插入DNA的双螺旋结构中与DNA发生键合反应,从而使游离的EB分子浓度降低;而在离子液体相中,EB分子与DNA没有发生键合反应反应,仅通过静电吸引作用在DNA表面聚集,从而导致EB在局部发生浓集。其结合示意如图3-3所示。

图3-3 在水相和离子液体相(IL)中DNA与EB的结合方式示意图
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




