根据自噬发生的过程是否会形成自噬体双层膜结构,自噬可分为经典自噬(Canonical autophagy)和非经典自噬(Non-canonical autophagy)两种类型。经典自噬是指在自噬发生过程中会形成自噬体的双层膜结构,这个过程涉及以下几个阶段:前自噬体诱导与形成、自噬体装配和延伸、自噬溶酶体成熟,被包裹内容物的降解与再利用,该自噬类型涉及多种细胞因子的参与(这部分在后面会陆续讲到)。
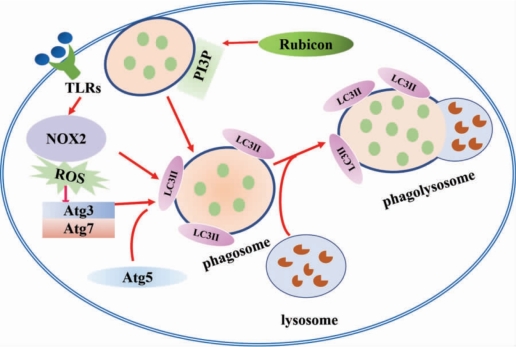
非经典自噬主要是指以胞内大分子为目标的LC3 相关吞噬作用(LC3-associated phagocytosis,LAP)。其具体过程如图7-1 所示,与经典自噬不同的是非经典自噬不会形成自噬体的双膜结构,通常情况下,病原体等吞噬物表面的脂多糖、肽聚糖等与天然免疫细胞表面的Toll 样受体(TLR2、TLR4)及胞内受体NLRs(NOD1、NOD2)等结合,并通过Toll 样受体将LC3 直接招募到单层膜吞噬体,促进吞噬体的成熟和巨噬细胞内微生物的杀灭。虽然该吞噬及LC3 募集过程中的吞噬泡没有典型的自噬泡双层膜结构,也不需要传统自噬机制的核心起始前复合物(如ULK1/2、FIP2000 和Atg13)的参与。但是非经典自噬吞噬论也可以和溶酶体快速融合并在后期和经典自噬会共用许多蛋白,包括Atg3、Atg5、Atg7 和Beclin-1 等。除此之外,在这一过程中,需要NADPH 氧化酶2(NADPH oxidase-2,NOX2)催化产生ROS 协助吞噬体完成对LC3 的招募。重要的是,虽然Rubicon 作为经典自噬途径中的一个非必要基因,在非经典自噬途径中是不可或缺的调控因子。它持续将PI3P(phosphatidylinositol-3-phosphate,磷脂酰肌醇-3-磷酸)积聚到吞噬体,同时还稳定了NOX2 复合物的形成,并为之后脂化的LC3II 与吞噬体的结合提供了保障。
 (https://www.xing528.com)
(https://www.xing528.com)
图7-1 非经典自噬的形成过程
根据细胞内物质运输到溶酶体的途径以及生理功能的不同,哺乳动物的细胞自噬可以分为三种类型:微自噬(Microautophagy)、巨自噬(Macrophagy)和分子伴侣介导的自噬(Chaperone-mediated autophagy,CMA)。微自噬是指溶酶体通过膜内陷或向外突出,从而主动、直接包裹长寿命蛋白,同时负责溶酶体自体吞噬的蛋白质、老化细胞器的降解,并在溶酶体内降解,维持其自稳状态。所以微自噬不形成双层膜的自噬小体以及自噬溶酶体,而是溶酶体形成核内多泡体的结构。而巨自噬由内质网来源的膜将一些损坏的蛋白或细胞器等降解物包被形成双层膜的自噬体,然后自噬体与溶酶体融合形成自噬溶酶体,溶酶体通过水解酶对其进行降解并得以循环利用。第三种分子伴侣介导的自噬是指胞质内蛋白结合到分子伴侣后被转运到溶酶体腔中,然后被溶酶体酶消化。分子伴侣介导的自噬主要是借助一种胞浆内的分子伴侣蛋白HSC73,识别底物蛋白的特定五肽氨基酸序列KFERQ,并主动结合形成分子伴侣-底物复合物。该复合物与溶酶体膜受体LAMP-2A 特异性结合,使底物去折叠并被运输至溶酶体中降解。分子伴侣介导的自噬底物是可溶的蛋白质分子,在清除蛋白质时有选择性,而微自噬和巨自噬无明显的选择性。以上这几种自噬的方式,目前研究较为深入的是巨自噬,所以提到自噬,一般都是指巨自噬。巨自噬机制相对较为复杂,涉及基因较多,截至目前其具体形成机制尚未完全阐明。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。




